作为用于检测癌症和癌症易感性的新生物标志物的DNA损伤敏感性的制作方法
作为用于检测癌症和癌症易感性的新生物标志物的dna损伤敏感性
1.发明的领域
2.本发明涉及可以用作用于检测癌症的生物标志物的标志物。更具体地,本发明涉及对基因组dna损伤敏感性(dds)的分析,所述基因组dna损伤敏感性(dds)作为癌症或癌症易感性、或特征在于dna损伤应答(ddr)紊乱的其它疾病状态的生物标志物。本发明的生物标志物也可以用于研究药物、风险因素和/或环境影响对癌症的易感性的影响,或更概括地是对损害基因组dna损伤敏感性(dds)的风险因素的易感性的影响。
3.发明的背景
4.最近已经研究了dna损伤敏感性的诊断和预后作用。在本发明中,可以实施用于确定作为增殖性疾病的标志物的基因组dna损伤敏感性(dds)的方法。该方法基于单细胞凝胶电泳(scge)。
5.scge,也称为彗星试验(comet assay),是一种用于损伤的dna,诸如dna单链断裂和双链断裂的直接可视化和定量的灵敏方法。待检查或处理的细胞可以包埋例如到琼脂糖中,并可以作为所谓的凝胶点沉积在载体材料上,诸如例如沉积在目标载体或膜上。然后将那些包埋的细胞裂解,并以碱性方式处理以使dna变性,或者供选择地保持在中性环境中以除去细胞膜和大部分蛋白质。两种方式都导致与核基质连接的超螺旋dna,一种有时被称为类核的结构。随后的电泳导致损伤的dna当暴露于电场时将其自身从类核移开,即带负电荷的dna片段移动到正极(plus pole)并产生所谓的“彗星”。对已经从彗星的头部迁移出来进入尾部的dna的量定量,并用作样品中存在的dna损伤的定量量度。彗星尾部的成功定量主要受(i)凝胶电泳系统的性能和(ii)dna可视化和定量方法,例如荧光显微镜和成像软件的类型的影响,并且以手动、部分自动化或完全自动化的方式实施。高性能凝胶电泳系统例如由wo2016/141495已知。由wo2019/135008已知适合筛查受试者的dna损伤的单细胞凝胶电泳装置和方法。
6.根本的生物学原理是健康个体和癌症患者的基因组dna对辐射,诸如电磁辐射的反应不同。在wo2014/041340a1中已经描述了dna对辐射损伤的敏感性和人对癌症的易感性之间的相关性。主要的差异在于发明人可以表明相关性是相反的。使用本发明的方法,可以表明来自健康受试者的健康替代细胞,诸如例如外周血单核细胞(pbmc),与癌症患者的健康替代细胞,例如pbmc相比,对电磁辐射具有更高的敏感性。这迄今为止是未知的。已经提出在肿瘤发生期间,细胞的染色体情况在改变。它以包括dna高甲基化或低甲基化、dna可及性和转录结合因子或组蛋白修饰的多种方式影响染色质结构(zhao等人2020;mao等人2016;综述:brock等人2007;mcanena等人2016)。但是没有描述基因组dna变得对辐射更不敏感。
7.发明的概述
8.本发明的目的是提供用于癌症的早期和高灵敏度检测的具有强预测能力的生物标志物。该目的是通过检测针对辐射的dna损伤抗性,以及使用本发明的方法,来自健康对照的细胞的基因组dna比来自所有癌症分期的癌症患者或具有增加的癌症风险的个体的细
胞的基因组dna更敏感的认知实现的。
9.本发明特别涉及与确定基因组dna对辐射损伤的抗性相关的离体或体外方法,所述基因组dna对辐射损伤的抗性作为增殖性疾病和增殖性疾病的易感性的生物标志物,其中基因组dna的抗性增加指示增殖性疾病和/或易感性增加。换言之,本发明涉及基因组dna损伤敏感性(由辐射诱导的)作为增殖性疾病及其易感性的生物标志物的离体或体外用途,其中基因组dna损伤敏感性降低指示增殖性疾病和/或其易感性增加。本发明的方法适合癌症筛查、癌症的(癌症早期阶段的)早期诊断、治疗和缓解后癌症复发的监测。大多数涉及肿瘤的癌症的分期为五大组,0至iv期。可以表明,使用本发明可以检测到甚至非常早的分期(诸如0和/或i期)。
10.癌症分期是指癌症的程度,诸如肿瘤有多大,以及它是否已经扩散。所述程度经常主要基于大小及其定位来评估,但其它因素,诸如组织病理学评估也在肿瘤疾病的总体评估中起重要作用。肿瘤“分期”的知识对于恶性肿瘤疾病的治疗计划和预后是关键的。uicc(国际抗癌联盟,union internationale contre le cancer)tnm恶性肿瘤分类(tnm classification of malignant tumors,tnm)是一种用于对癌症扩散程度分类的全球公认的标准。t类别描述原发性肿瘤部位和大小,n类别描述区域淋巴结受累,以及m类别描述远处转移扩散存在与否。
11.生物标志物也可以用于监测对癌症治疗的响应或用于研究对特定治疗选项响应的可能性(反应性),以便找到最佳治疗策略。另一用途可以是关于药物、风险因素和/或环境影响对癌症的易感性的影响,或更概括地是对损害基因组dna损伤敏感性(dds)的风险因素的易感性的影响的研究。因此,可以使细胞、细菌、酵母、原生动物、植物或动物与候选物质(可能的活性剂、风险因素)接触。然后,使用根据本发明的方法筛查候选物质是否对基因组dna损伤敏感性(dds)和对癌症易感性、癌症进展或增殖性疾病的治疗有影响。
12.术语“增殖性疾病”在本文中是指肿瘤,特别是实体瘤、癌症、恶性肿瘤及它们的转移。增殖性疾病的实例是腺癌、脉络膜黑素瘤、急性白血病、听神经瘤、壶腹癌、肛门癌、星形细胞瘤、基底细胞癌、胰腺癌、硬纤维瘤、膀胱癌、支气管癌、非小细胞肺癌(nsclc)、乳腺癌、伯基特淋巴瘤(burkitt's lymphoma)、子宫体癌(corpus cancer)、cup综合征(未知原发灶的癌症)、结肠直肠癌、小肠癌、小肠肿瘤、卵巢癌、子宫内膜癌、室管膜瘤、上皮癌类型、尤文氏肿瘤(ewing's tumors)、胃肠道肿瘤、胃癌、胆囊癌(gallbladder cancer)、胆囊癌(gallbladder carcinomas)、子宫癌、宫颈癌(cervical cancer)、宫颈癌(cervix)、成胶质细胞瘤、妇科肿瘤、耳鼻喉肿瘤、血液肿瘤、毛细胞白血病、尿道癌、皮肤癌、皮肤睾丸癌、脑肿瘤(神经胶质瘤)、脑转移瘤、睾丸癌、垂体肿瘤、类癌、卡波西肉瘤(kaposi's sarcoma)、喉癌、生殖细胞肿瘤、骨癌、结肠直肠癌、头颈肿瘤(耳、鼻和喉区域的肿瘤)、结肠癌、颅咽管瘤、口腔癌(口腔区域和嘴唇中的癌症)、中枢神经系统的癌症、肝癌、肝转移瘤、白血病、眼睑肿瘤、肺癌、淋巴结癌(霍奇金/非霍奇金(hodgkin's/non-hodgkin's))、淋巴瘤、胃癌、恶性黑素瘤、恶性肿瘤、胃肠道恶性肿瘤、乳腺癌、直肠癌、成神经管细胞瘤、黑素瘤、脑膜瘤、霍奇金病(hodgkin's disease)、蕈样肉芽肿、鼻癌、神经鞘瘤、成神经细胞瘤、肾癌、肾细胞癌、非霍奇金淋巴瘤(non-hodgkin's lymphomas)、少突神经胶质瘤、食道癌、溶骨性癌和成骨性癌、骨肉瘤、卵巢癌、胰腺癌、阴茎癌、浆细胞瘤、头颈部鳞状细胞癌(scchn)、前列腺癌、咽癌、直肠癌、成视网膜细胞瘤、阴道癌、甲状腺癌、施耐伯格病(schneeberger disease)、
食道癌、脊髓瘤(spinalioms)、t细胞淋巴瘤(蕈样肉芽肿)、胸腺瘤、管癌(tube carcinoma)、眼部肿瘤、尿道癌、泌尿系肿瘤、尿路上皮癌、外阴癌、疣外观、软组织肿瘤、软组织肉瘤、维尔姆氏瘤(wilm's tumor)、宫颈癌和舌癌。如本文使用的癌症是指涉及异常细胞生长的疾病,其具有侵入或扩散至身体的其他部分的可能性。
13.癌症可以根据被推测为肿瘤起源的细胞类型来分类。因此,根据本发明的离体或体外方法涉及确定基因组dna对辐射损伤的抗性,其作为增殖性疾病,诸如癌(源自上皮细胞)、肉瘤(分别由结缔组织产生或源自骨髓外间充质细胞的细胞)、淋巴瘤和白血病(由造血细胞引起)、生殖细胞肿瘤和胚细胞瘤(源自未成熟的“前体”细胞或胚胎组织)的生物标志物。
14.癌症组包括乳腺癌、前列腺癌、肺癌、胰腺癌和结肠癌等。肉瘤组包括骨癌和源自软骨、脂肪和神经细胞的癌症等。本发明涉及的增殖性疾病可以特别地选自:膀胱癌、乳腺癌、结肠和直肠癌、子宫内膜癌、肾癌、白血病、肝癌、肺癌、黑素瘤、非霍奇金淋巴瘤、胰腺癌、前列腺癌和甲状腺癌。如本文描述的生物标志物优选用于检测实体瘤,并且特别是乳腺癌、肺癌、前列腺癌、结肠癌或对这些癌症之一的易感性增加。乳腺癌包括非浸润性和浸润性导管癌以及隐匿性浸润性乳腺癌。术语“肺癌”包括小细胞肺癌(sclc)和非小细胞肺癌(nsclc)。结肠直肠癌和前列腺癌主要指分别在肠、结肠、直肠或前列腺内的腺癌。
15.测定基因组dna对损伤的敏感性可能有助于筛查和监测人类恶性肿瘤。目前可以鉴别例如由于熟悉的事件、遗传倾向(遗传变异、遗传缺陷)或环境影响(诸如暴露于毒素或吸烟)而具有较高癌症风险的人。本发明使得用简单的测试来监测这些人成为可能。监测对癌症治疗的响应可以是本发明的另一种可能的应用,因为生物标志物还可以用于以非浸润性方式监测成功的抗癌治疗和缓解后癌症的复发。本发明的一个目的还是随访护理,其意指检查在成功治疗后癌症的复发。
16.本发明的一个实施方案涉及关于确定基因组dna对辐射损伤的抗性的离体或体外方法,所述抗性作为增殖性疾病和对增殖性疾病的易感性的生物标志物,其中基因组dna源自患者的健康替代细胞。样品不是从癌症本身获得的。优选的是基因组dna源自全血细胞或源自含有例如pbmc或更具体地主要是淋巴细胞的外周血细胞。样品中的细胞浓度可以是每个点大约200-400个细胞。在本发明中,优选的是一个样品代表琼脂糖凝胶中的一个点。对于对照和对于双重测量(doubletted measurement),在根据本发明的方法中,每个个体收集更多的血液并将该血液样本分成几个样品可能是适合的。
17.用于在基因组dna内引入dna损伤的辐射可以是紫外光和更优选的紫外线b辐射。最广泛地定义为10-400纳米的紫外线辐射的电磁光谱可以被细分成多个范围。一种是紫外线b,其是具有280-315nm波长的中间范围。
18.与确定作为增殖性疾病和对增殖性疾病的易感性的生物标志物的基因组dna对辐射损伤的抗性相关的离体或体外方法可以适合测试化合物、药物和/或环境影响对癌症易感性的影响。
19.已知有不同的方法来定量确定dna损伤,并且它们中的大多数分析从肿瘤获得的肿瘤dna或来自外周血的循环肿瘤dna(ctdna)。这些方法最经常基于检测在肿瘤dna中分子水平上的序列改变。当循环肿瘤细胞或ctdna需要从用于测序的血液中被捕获时,这些可能受到低敏感性的影响。这里使用完全不同的方法,通过收集活的血细胞,诸如pbmc,激发它
们,并且最后在单细胞凝胶电泳(也称为彗星试验)中测定它们,评估随后确定的dna损伤。可以进行自动分析。这加强意义并确保单细胞凝胶电泳(“彗星试验”)测试的性能、互操作性和可调度性。本方法可以与确定至少一种另外的癌症的生物标志物相组合。本发明的一个实施方案涉及作为增殖性疾病及其易感性的生物标志物的基因组dna对辐射损伤的抗性的用途,其中使用单细胞凝胶电泳测定法将dna损伤确定为归一化的dna尾部。这样的测定可以如下进行:将液体样品施加在载体板上,大部分在琼脂糖凝胶内。在将样品引入琼脂糖凝胶之前,可以照射样品。然而,优选的是,样品在引入琼脂糖凝胶后暴露于辐射。然后裂解样品中的细胞。将载体板定位在由凝胶电泳装置的至少一对电极产生的均匀电场中。通过控制在容纳于载体板上的样品的位置处产生的电场的强度和方向,进行单细胞凝胶电泳(scge)。单个类核被描绘成带白色的点,也称为彗星(点的颜色可以根据染色或成像而变化)。每个单个彗星代表单个细胞,其显示在一侧的头部和在另一侧的尾部。彗星的取向取决于电场中单个细胞的取向。根据彗星/单个细胞尾部和头部之间的比率可以确定dna损伤。
20.本发明的另一方面涉及用于测定基因组dna对辐射损伤的抗性的离体或体外方法,其包括:
21.a)提供含有血细胞的样品,
22.b)照射样品的血细胞,
23.c)进行细胞裂解,和
24.d)使用单细胞凝胶电泳测定法确定基因组dna损伤。
25.在所述方法中,基因组dna的抗性增加指示增殖性疾病和/或对增殖性疾病易感性的增加。全血样品或含有分离的外周血(单核)细胞的样品适合该方法。最适合的是使用液体样品,所谓的液体活组织检查。
26.照射样品内的细胞。使用的辐射可以是紫外线辐射,优选在紫外线b范围内的紫外线辐射。在辐射之前或之后,将样品的细胞包埋在琼脂糖凝胶中。照射后立即裂解细胞。一个实施方案涉及一种方法,其中在照射血细胞后少于10分钟,优选少于7分钟或少于5分钟,更优选少于3分钟发生细胞裂解。如本文所使用的细胞裂解是指细胞的打开。裂解可能受到酶或去污剂或其它离液剂的影响。也可以使用机械破碎细胞膜,如通过重复冷冻和解冻、超声处理、加压或过滤。然而,期望避免会使dna变性或降解的机械剪切力。
27.已经表明,电磁辐射在健康人的细胞中比在癌症患者的各自的细胞中诱导更多的dna损伤。因此,非常令人惊讶的是,健康测试者的细胞比癌症患者的细胞更容易受到损伤。在现有技术中,显示相反的效果,例如anderson等人2014(anderson d,najafzadeh m,gopalan r等人,et al.sensitivity and specificity of the empirical lymphocyte genome sensitivity(lgs)assay:implications for improving cancer diagnostics.faseb j.2014;28(10):4563-4570.doi:10.1096/fj.14-254748)。然而,本发明人的结果显示,癌症患者的血细胞的基因组dna针对紫外线b损伤比来自健康个体的细胞得到更好的保护。
28.目前,对于该差异没有明确的科学的合理解释。不同的各种假设都是很可能的。癌症基于肿瘤细胞的基因组的病理变化。很可能的是来自患者的循环健康细胞,诸如外周血单核细胞(pbmc)接受直接或间接信号,所述信号使得这些细胞保护其基因组免受dna损伤。
包括归一化的dna尾部(dnatail normalized,dtn)的比较/评价。归一化的dna尾部(dtn)被计算为紫外线暴露后的时间点时的dna尾部(dnatail,dt,所测量的尾部中的彗星的总光强度的百分比)%减去无扰动条件(或对照或基线)下的dt%。使用andor的可以根据彗星选项(comet options)的选择,并且特别是头部对称(head symmetry)选项的选择/取消选择来改变结果。优选的(dt%)的计算基于%头部dna(headdna)=(头部光强度(head.optinten)/(头部光强度+尾部光强度(tail.optinten))
×
100。光强度(optinten)=各个区域中的光强度尾部dna(tail-dna)=100-%头部dna。
36.有可能使用相当简单的算法。因此,可以确定和比较健康人和分别为患者或疑似癌症患者的测量值之间的绝对差。然而,也有可能使用其它算法,例如基于相对差异或校准单个实验。然而,一个实施方案涉及根据本发明的方法,其中使用单细胞凝胶电泳测定法确定基因组dna损伤包括计算和评价dt%,其作为用于如何分析数据的一种可能的算法。
37.附图的简述
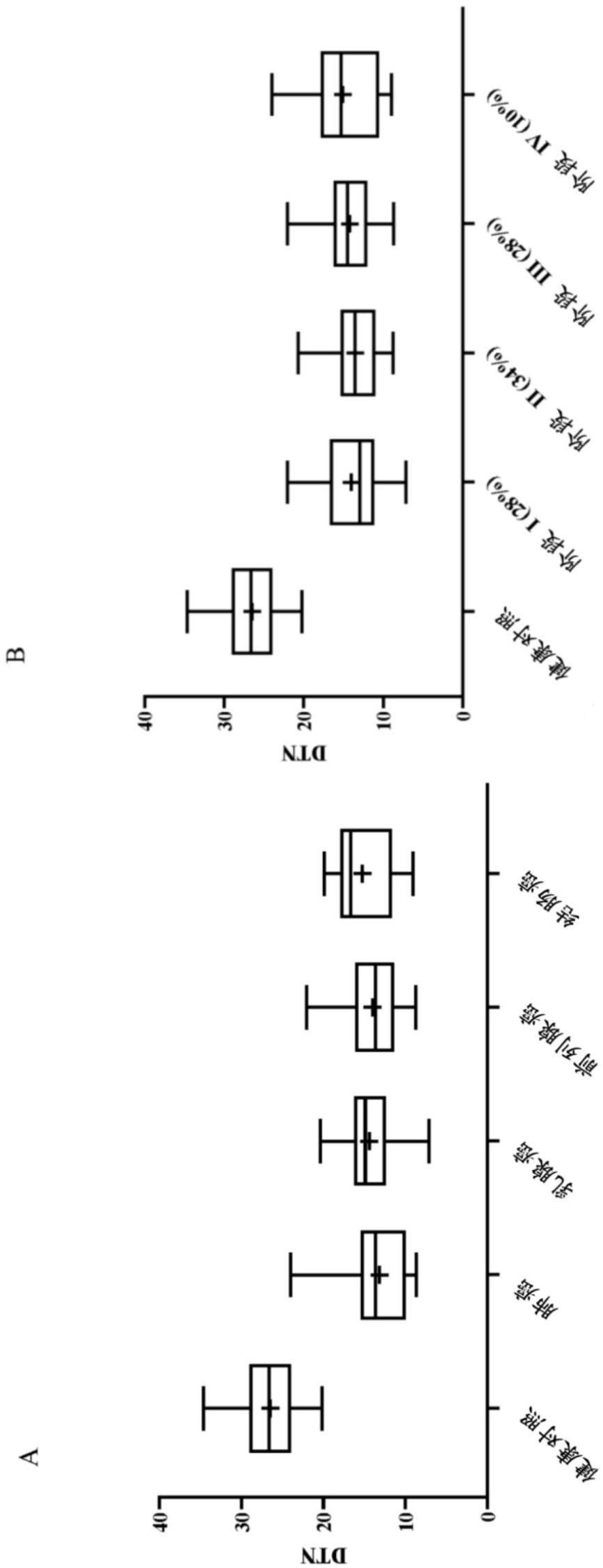
38.图1是使用所描述的发明的方法收集的数据的图形化表示。它说明与19位乳腺癌、23位肺癌、42位前列腺癌和15位结肠癌患者相比,源自31位健康供者的样品的dtn(用基线值归一化的紫外线b暴露后的dt%)。箱线图显示中值(箱内的线)、75%百分位数(箱的顶部)和25%百分位数(箱的底部),并且触须线表示值的最小值和最大值。“+”代表平均值。(a)显示由来自四种最重要癌症类型的dtn确定的dna损伤敏感性。(b)与a相同的数据,但如果已知,按癌症分期分类。乳腺癌患者的0期包括在i期中。百分比描述在样品群体中的频率。
39.图2说明使用所描述的发明的方法的数据,其为与23位肺癌患者和13位良性肿瘤患者相比,源自31位健康供者的样品的dtn(用基线值归一化的紫外线b暴露后的%dna尾部)值。每个点代表单个个体对象。水平线表示平均值。(a)显示与健康对照组相比肺癌患者和良性组群的易感性。(b)与a中相同的数据,其中肺癌样品按分期分类。(c)与a中相同的肺癌数据,如果已知,按肺癌类型分组。(d)按分期分类的仅来自乳腺癌患者的样品的敏感性。
40.我们的数据揭示所描述的实施方案用作以单细胞水平定量dna损伤差异,并且同样地测量细胞样品中对诱导dna损伤的紫外光的敏感性的有效且准确的工具,以最终使用结果确定受试者对癌症的易感性。
41.优选实施方案的描述
42.所述方法的实施方案的以下更详细的描述代表所述技术的示例性实施方案。
43.为了从受试者获得一个或多个样本,通过静脉穿刺抽取外周血,并且可以用于以下测定方法中。优选的方案描述使用分离的外周血单核细胞(pbmc),然而不排除使用全血代替的可能性。根据国际上常见的整体分期分组(overall stage grouping),其也称为罗马数字分期(roman numeral staging)进行肿瘤的分期。该系统使用数字i、ii、iii和iv(加上0)来描述癌症的进展。所述分期是指以下:
44.0期:原位癌,异常细胞在其正常位置生长(“原位”来自拉丁语“在其位置”)。
45.i期:癌症局限于身体的一部分。i期癌症如果足够小,可以被手术除去。
46.ii期:癌症是局部晚期的。ii期癌症可通过化学疗法、辐射或手术治疗。
47.iii期:癌症也是局部晚期的。癌症被指定为ii期还是iii期可取决于癌症的具体
类型;例如,在霍奇金病中,ii期表示仅在膈膜一侧上受影响的淋巴结,而iii期表示膈膜上方和下方受影响的淋巴结。因此,ii和iii期的具体标准根据诊断而不同。iii期可通过化学疗法、辐射或手术治疗。
48.iv期:癌症经常已经转移或扩散到其它器官或遍及身体。iv期癌症可通过化学疗法、辐射或手术治疗。尽管进行治疗,但iv期癌症患者的死亡率会显著更高,例如,癌症会进展至晚期。
49.为了分别定量dna损伤和dna损伤敏感性(dds),在暴露于紫外线辐射之前(对照/基线)收集样品和在暴露于紫外线辐射之后立即收集样品。该所谓的时间零(t0)时间点是由于实际原因,诸如在15分钟或更短时间内,诸如在12分钟、10分钟、8分钟或甚至5分钟内实现移液所需的时间。
50.紫外线暴露可以通过辐射所制备的细胞悬浮液(例如,重悬于细胞培养基中或细胞培养板中的pbs中的pbmc细胞)或直接辐射在具有琼脂糖的板(玻璃板),诸如4d lifeplates上作为点装载的样品来进行。当对点样品进行辐射时,时间点t0可能更准确。
51.图1和2中显示的数据是通过将悬浮液中的pbmc细胞暴露于紫外线b辐射而获得的。下面描述除辐射之外的另外的过程。
52.将分离的pbmc与低熔点琼脂糖(在pbs中的lma)混合,并保持在设定在37℃的加热块中,得到最终浓度为0.4%的lma。混合后,直接将琼脂糖/细胞混合物(含有200-400个细胞)的等分试样施加到4d lifeplate上。在4d lifeplate上的琼脂糖包埋细胞中的那些在本文中被称为点。使点在4℃下聚合1-2分钟,随后在裂解缓冲液(nacl、edta、三(羟甲基)氨基甲烷(tris)-碱、月桂酰肌氨酸钠,triton-x-100)中在4℃下裂解细胞1小时。在放入4d lifetank中之前,将4d lifeplate在双蒸水(ddh2o)中短暂清洗。其中,将载玻片浸入冷电泳溶液(基于naoh)中,并在4℃下进行解旋40分钟。随后,将载玻片以1v/cm电泳30分钟,并在4℃下持续冷却。电泳后,将lifeplate在中和缓冲液(tris-base)中清洗两次,每次5分钟,在ddh2o中冲洗,然后将点在etoh中固定10分钟。将样品在37℃下干燥1小时或室温下过夜,并将dna通过sybr
tm gold(50-240nm在30mm tae中,ph 8.0)染色30分钟。在用ddh2o短暂清洗后,将板在脱色溶液(来自abcbiopply)中孵育两次,达30分钟,随后在室温下干燥过夜或在37℃下在黑暗中干燥2小时。
53.载玻片用显微镜bx63(olympus)以10倍物镜和相应的软件cells dimension成像。用andor komet 7.1进行彗星的评分。
54.发明人使用源自相同样本(相同患者)的样品来分别研究时间点或辐射位置的影响。
55.在引入琼脂糖凝胶之前或之后,对源自相同样本的样品进行照射。测定方案仅在照射时间点上变化(v1=在引入琼脂糖凝胶之前照射细胞和v2=在引入琼脂糖凝胶之后照射细胞)。对5个健康患者样本和5个患有肺癌的患者的样本进行测试。结果与辐射的时间点无关,原始数据的差异在之前记录的统计偏差内(采用未改变的测定方案)。对于每个个体患者的样品,诊断结果是相同的(参见表1)。
56.表1:在引入琼脂糖凝胶之前或之后,使用照射时间点不同的方案版本处理的样品的结果的比较。
57.v1=在引入琼脂糖凝胶之前照射细胞;v2=在引入琼脂糖凝胶后照射细胞
58.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1