一种基于金属有机框架杂化纳米片的电化学生物传感器及其用于检测汗液中乳酸含量的方法
1.本发明属于疲劳标志物电化学检测分析技术领域,更具体地,涉及一种金属有机框架纳米片和乳酸氧化酶修饰三电极体系纸基电极的工作电极,以及利用该纸基电极检测乳酸的检测方法。
背景技术:
2.乳酸是由于运动过程中,体内葡萄糖的代谢过程中产生的中间产物。由于运动相对过度,超过了有氧运动的强度,而导致机体内产生的乳酸不能在短时间内进一步分解为水和二氧化碳,氧气供应不足而形成无氧代谢,从而导致大量的过度产物乳酸在体内形成堆积。乳酸堆积会无法通过正常的血液循环代谢,就会在体内堆积,挤压血管,阻碍血液的正常流通,出现肌肉酸胀、疼痛等症状。过多的乳酸堆积还有可能出现乳酸中毒,表现为低血压,过度通气,继而出现意识障碍、嗜睡、恶心、呕吐、心悸,严重者甚至会发生昏迷。
3.目前常用的检测乳酸的方法包括酸碱滴定法、edta定钙法、旋光法、层析检测法等。其中,高效液相色谱法(highperformanceliquidchromatography,hplc)和质谱法(massspectrometer,ms)有较好的灵敏度,但是耗时费力和维护成本昂贵,难以应用到现场检测;其他方法灵敏度一般,且普遍操作较为复杂。随着科学和社会发展与进步,进一步提高乳酸检测生物传感器的灵敏度和便捷性并用于现场检测成为研究的热门话题。
4.因此,有必要开发一种高灵敏度,快速,简便,低成本的检测方法,对乳酸进行实时监测。
技术实现要素:
5.本发明的目的是一种基于金属有机框架杂化纳米片和乳酸氧化酶修饰的三电极体系纸基电极的工作电极,以及利用该纸基电极检测乳酸的检测方法。该方法能够高灵敏的检测汗液中的乳酸含量。
6.为了实现上述目的,本发明第一方面提供一种金属有机框架杂化纳米片和乳酸氧化酶修饰三电极体系纸基电极,该电极体系包括以下组分:
7.(1)修饰过的工作电极:碳电极;
8.(2)参比电极:ag/agcl;
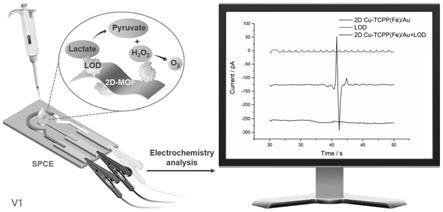
9.(3)对电极:碳电极;
10.其中,所述修饰过的碳电极能够对乳酸进行氧化还原反应。
11.本发明的原理如图1所示,首先,将cu-tcpp(fe)/au金属有机框架纳米片通过滴涂的方式修饰在工作电极上。然后,将乳酸氧化酶通过滴涂的方式修饰在工作电极上。当乳酸存在时,乳酸氧化酶氧化乳酸为丙酮酸和h2o2,然后cu-tcpp(fe)/au催化h2o2,产生o2和h2o,同时产生电子,从而引起电流变化。通过连接电化学工作站即可以检测产生电流的大小。其中电流值的大小与乳酸的浓度成正相关关系,可以对其进行定量检测,制作标准曲线。对待
测样品进行同样方法测定,将测得的电流值代入标准曲线,得到其中乳酸的浓度。
12.基于本发明的上述原理,可设计具有三电极体系的纸基电极。所述电极的油墨可以单独提供,也可以通过丝网印刷技术将其打印在普通纸基上。
13.根据本发明,金属有机框架纳米片需要具有优异的h2o2电化学催化氧化性能,从而引起电流变化。所述金属有机框架杂化纳米片优选为cu-tcpp(fe)/au杂化纳米片。
14.本发明中,所述氧化酶需具有氧化乳酸产生h2o2的能力,根据酶对其底物具有高度特异性和高度催化效能的特点,所述氧化酶优选为乳酸氧化酶。
15.基于电化学反应原理和本发明的上述原理,本领域技术人员可设计合适的电极体系,包括三电极体系和两电极体系。根据本发明一种优选实施方式,所述电极采用三电极体系。包括工作电极,参比电极和对电极。
16.根据本发明,所述金属有机框架纳米片,2d-mof表面优选金纳米颗粒,因为金纳米颗粒具有良好的电催化性能,金属卟啉基mof纳米片与aunps的结合可能模拟酶级联反应。
17.本发明中,所述金属有机框架杂化纳米片优选为cu-tcpp(fe)2d mof纳米片上长金。该金属有机框架杂化纳米片可通过本领域常规方法制备得到。
18.根据本发明一种具体实施方式,上述cu-tcpp(fe)/au杂化纳米片可通过以下方法制得:
19.(1)称取36mg三水硝酸铜,聚乙烯吡咯烷酮(pvp)150mg,量取三氟乙酸(1.0m)600μl,放于250ml圆底烧瓶中,量取180ml n,n-二甲基甲酰胺(dmf):乙醇(3:1)溶液加入容量瓶中。
20.(2)然后在搅拌下,逐滴加入溶解在60ml dmf:乙醇(3:1)溶液中的四(4-羧基苯基)氯化卟吩铁(ⅲ)66mg。
21.(3)将该混合溶液超声15min。
22.(3)将圆底烧瓶放入水浴锅中,加热至80℃,然后保持反应4h。
23.(4)拿出放置室温,离心15min,转速为10000转/min,得红色固体。
24.(5)将得到的固体用20ml乙醇洗涤3次,加入乙醇后,振荡使其溶解,再超声5-10min,使其完全溶解,离心15min,转速为10000转/min。
25.(6)将最后离心得到的固体,加入无水乙醇溶解,振荡,超声5-10min,使其完全溶解,然后将其混合在一起,混合均匀以后,4℃密封保存。
26.(7)量取114ml cu-tcpp(fe)纳米混合溶液(0.1mg/l)乙醇溶液加入试管中,量取1140μl haucl4(10mm)加入试管中,将混合物搅拌1min。
27.(8)随后加入285μl冰的,刚配制的nabh4水溶液(0.1m),混匀即可。
28.(9)将上述混合溶液放入离心机,离心15min,转速10000转/min,去掉上清液,得到固体。
29.(10)加入20ml无水乙醇将此固体溶解,振荡,使其完全溶解,超声5-10min,使其完全溶解,重复该过程2次。
30.(11)将上清液移除,得固体。
31.(12)将固体溶解于20ml无水乙醇中,振荡,超声5-10min,使其完全溶解,4℃密封保存。
32.本发明的第二方面提供利用上述基于乳酸氧化酶和cu-tcpp(fe)/au双重作用产
生电流变化实时检测汗液中乳酸含量的检测方法,该方法包括:
33.(1)获取cu-tcpp(fe)2d mof金属有机框架纳米片;
34.(2)将cu-tcpp(fe)与三水合四氯金酸(haucl4)反应,从而形成cu-tcpp(fe)/au杂化纳米片;
35.(3)将乳酸氧化酶用1xpbs溶液溶解后,在无菌条件下分装到离心管中,离心20s,放置于-20℃保存;
36.(4)通过丝网打印技术制备三电极体系的纸基电极;
37.(5)将步骤(2)所得cu-tcpp(fe)/au溶液滴涂到步骤(4)所得的纸基电极的工作电极上,放置于4℃冰箱中干燥;
38.(6)向步骤(5)干燥后的工作电极上通过滴涂的方法修饰乳酸氧化酶,放置于4℃冰箱中干燥保存;
39.(7)将步骤(6)修饰好的电极从冰箱中拿出,量取100μl乳酸标准溶液加入电极的工作区域;该区域为亲水区域;
40.(8)测量步骤(7)所得反应产物溶液的电流信号,建立乳酸标准溶液浓度与电流信号的标准曲线;
41.(9)将含有乳酸的待测液进行上述测试,将得到的电流信号值代入步骤(8)的标准曲线,计算待测液中乳酸的浓度;
42.本发明中,cu-tcpp(fe)/au杂化纳米片、与所述乳酸氧化酶以及纸基电极与所述纸基电极连接的电化学工作站可统称为乳酸生物传感器。
43.本发明中,所述乳酸氧化酶分装可采用本领域常规的方法进行,例如,用1xpbs缓冲溶液将乳酸氧化酶稀释成1u/μl,然后在无菌条件下,每10μl一个离心管进行分装,然后离心,置于-20℃保存,这样可以避免反复冻融导致乳酸氧化酶失活。
44.根据本发明,所述一系列浓度梯度的乳酸标准品溶液的浓度范围可以为0.013-10nmol/l。
45.所述测量步骤(8)所得反应产物溶液的电流信号的条件与所测溶液的浓度有关,采用计时电流法。测量条件优选包括:最大电流10a,最小电流值1pa,测量时间为100s。
46.本发明中,修饰工作电极的cu-tcpp(fe)/au的体积的量优选包括如下步骤:
47.(1)将cu-tcpp(fe)/au混悬液和1mm乳酸标准溶液从冰箱中拿出,放置室温;
48.(2)取5个纸基电极,编号为
①
,
②
,
③
,
④
,
⑤
,在工作电极上分别修饰50μl,60μl,73μl,80μl,90μl的cu-tcpp(fe)/au混悬液和5μl乳酸氧化酶,置于4℃冰箱保存;
49.(3)将电化学工作站打开,设置好参数后,预热20min;
50.(4)量取100μl 1mm乳酸标准溶液滴加到纸基电极的工作区域,使其浸润工作电极,参比电极和对电极,然后红线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好以后,直接点击开始即可,比较不同体积的cu-tcpp(fe)/au的电流值大小,确定最佳反应体积为73μl。
51.根据本发明,修饰工作电极的乳酸氧化酶的体积的量优选包括如下步骤:
52.(1)将cu-tcpp(fe)/au混悬液和1mm乳酸标准溶液从冰箱中拿出,放置室温;
53.(2)取5个纸基电极,编号为
①
,
②
,
③
,
④
,
⑤
,在工作电极上修饰73μl cu-tcpp(fe)/au混悬液和1μl,3μl,5μl,8μl和9μl的乳酸氧化酶,放置于4℃冰箱保存;
54.(3)将电化学工作站打开,设置好参数后,预热20min;
55.(4)量取100μl 1mm乳酸标准溶液滴加到纸基电极的工作区域,使其浸润工作电极,参比电极和对电极,然后红线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好以后,直接点击开始即可,比较不同体积乳酸氧化酶的电流值大小,确定乳酸氧化酶最佳体积为5μl。
56.根据本发明,该实验的ph值优选包括如下步骤:
57.(1)将cu-tcpp(fe)/au混悬液从冰箱中拿出,放置室温;
58.(2)取6个纸基电极,编号为
①
,
②
,
③
,
④
,
⑤
,
⑥
,在工作电极上分别修饰73μl cu-tcpp(fe)/au混悬液和乳酸氧化酶5μl,放置于4℃冰箱保存。将电化学工作站打开,设置好参数后,预热20min;
59.(3)分别量取100μlph=3.08,ph=4.02;ph=5.03;ph=7.00;ph=8.10;ph=9.10的1xpbs缓冲溶液滴加到纸基电极的工作区域,使其浸润工作电极,参比电极和对电极,然后红线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好以后,直接点击开始即可,比较不同ph的1xpbs缓冲溶液的电流值大小,确定ph=7.00为最佳测试条件。
60.本发明用纸基电极替代了传统的电解池,进一步缩小了实验成本,提高了实验的便携性和可操作性;通过添加乳酸氧化酶和cu-tcpp(fe)/au杂化纳米片,提高了电子转移的速度和反应的比表面积。因此,本发明的方法具有灵敏度高、检测范围宽、特异性好等优点,对乳酸的超灵敏检测具有重要的实际意义,对于实现现场快速、超灵敏检测技术具有很好的指导意义。
61.本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
62.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解的是,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
63.图1为本发明的检测原理图。
64.图2为cu-tcpp(fe)/au杂化纳米片的透射电镜图。
65.图3为修饰了cu-tcpp(fe)/au杂化纳米片和乳酸氧化酶后的工作电极的扫描电镜图。
66.图4为以乳酸标准品的浓度的对数为横坐标,各浓度对应的电流值为纵坐标绘制的标准曲线。
67.图5为基于cu-tcpp(fe)/au和乳酸氧化酶纸基电化学检测乳酸方法的特异性实验,其中各种物质的浓度均为1mm。
具体实施方式
68.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。
69.下述各实施例中,硝酸铜、三水合物购自上海麦克林生化科技有限公司,聚乙烯吡咯烷酮(pvp)化学试剂购自sigma公司,n,n-二甲基甲酰胺(dmf)购自罗恩试剂,meso-四(4-羧基苯基)卟吩氯化铁购自上海麦克林生化科技有限公司,实验中所用到的乳酸标准品购自阿法埃莎(中国)化学有限公司,乳酸氧化酶和人工汗液购自上海源叶生物科技有限公司。电化学工作站购自荷兰ivium电化学工作站。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
70.实施例一
71.本实施例提供一种基于cu-tccp(fe)/au金属有机框架纳米片及乳酸氧化酶纸基电化学生物传感器的汗液中乳酸含量的实时检测方法的建立,包括以下步骤:
72.(1)cu-tcpp(fe)2d mof合成方法:
73.①
称取36mg三水硝酸铜,聚乙烯吡咯烷酮(pvp)150mg,量取三氟乙酸(1.0m)600μl,放于250ml圆底烧瓶中,量取180mln,n-二甲基甲酰胺(dmf):乙醇(3:1)溶液加入容量瓶中。
74.②
然后在搅拌下,逐滴加入溶解在60mldmf:乙醇(3:1)溶液中的四(4-羧基苯基)氯化卟吩铁(ⅲ)66mg。
75.③
将该混合溶液超声15min。
76.④
将圆底烧瓶放入水浴锅中,加热至80℃,然后保持反应4h。
77.⑤
拿出放置室温,离心15min,转速为10000转/min,得红色固体。
78.⑥
将得到的固体用20ml乙醇洗涤3次,加入乙醇后,振荡使其溶解,再超声5-10min,使其完全溶解,离心15min,转速为10000转/min。
79.⑦
将最后离心得到的固体,加入无水乙醇溶解,振荡,超声5-10min,使其完全溶解,然后将其混合在一起,混合均匀以后,4℃密封保存。
80.(2)cu-tcpp(fe)/au杂化纳米片的合成方法:
81.①
量取114ml cu-tcpp(fe)纳米混合溶液(0.1mg/l)乙醇溶液加入试管中,量取1140μl haucl4(10mm)加入试管中,将混合物搅拌1min。
82.②
随后加入285μl冰的,刚配制的nabh4水溶液(0.1m),混匀即可。
83.③
将上述混合溶液放入离心机,离心15min,转速10000转/min,去掉上清液,得到固体。
84.④
加入20ml无水乙醇将此固体溶解,振荡,使其完全溶解,超声5-10min,使其完全溶解,重复该过程2次。
85.⑤
将上清液移除,得固体。
86.⑥
将固体溶解于20ml无水乙醇中,振荡,超声5-10min,使其完全溶解,4℃密封保存即可。
87.(3)纸基电极的制备:
88.①
用打印机将蜡打印到普通的纸张上,并在90℃下处理5分钟,以使蜡均匀地渗透到纸张上,创建一个专为这个范围设计的疏水图案。
89.②
然后,使用丝网打印机打印三个电极。工作电极和对电极使用碳墨水打印,参比电极使用ag/agcl墨水打印。由此产生的工作电极表面积为39mm2。
90.(4)修饰纸基电极的制备:
91.①
将cu-tcpp(fe)/au混悬液从4℃冰箱中拿出,放置室温。
92.②
量取73μl的混悬液通过滴注的方式对工作电极进行修饰,每次量取25μl,分三次进行修饰,每修饰完一次把电极放置于4℃冰箱中干燥2h。
93.③
将乳酸氧化酶从-20℃冰箱中拿出,融解后,量取5μl对工作电极采用滴注的方式进行修饰,修饰好以后,将电极放置于4℃冰箱中干燥保存即可。
94.(5)将1.0n的乳酸标准溶液从4℃冰箱中拿出,用1xpbs缓冲液分别配置成0.000013μm,0.00004μm,0.00012μm,0.0004μm,0.001μm,0.003μm,0.01μm的乳酸溶液。
95.(6)打开电化学工作站,设置参数最大电流为10a,最小电流为1pa,时间设置为100s,预热20min。
96.(7)取步骤5)配置好的不同浓度乳酸溶液100μl,依次滴加到纸基电极的工作区域,使溶液浸润工作电极,参比电极和对电极。。
97.(8)红色线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好电极后,直接点击开始即可。
98.(9)检测不同浓度的乳酸(0.000013,0.00004,0.00012,0.0004,0.001,0.003,0.01μm),并得到各个浓度的电流值大小。利用软件计算得到其标准曲线为f=82.00019lgc+250.59491(r2=0.9985),检测范围是0.013-10nmol/l,检出限是0.91pm/l(s/n=3)。以电流值为纵坐标,乳酸标准品浓度为横坐标绘制标准曲线,如图4所示。
99.实施例二
100.基于cu-tcpp(fe)/au金属有机框架纳米片及乳酸氧化酶纸基电化学生物传感器检测人工汗液中乳酸的方法,包括以下步骤:
101.(1)以四种不同浓度向人工汗液中添加乳酸:0,0.05,0.5和5nmol/l。将人工汗液和乳酸在试管中混合,得到五种不同浓度的待测样品,放置于4℃冰箱中保存待用。
102.(2)将cu-tcpp(fe)/au混悬液从4℃冰箱中拿出,放置室温。
103.(3)量取73μl的混悬液通过滴注的方式对工作电极进行修饰,每次量取25μl,分三次进行修饰,每修饰完一次把电极放置于4℃冰箱中干燥2h。
104.(4)将乳酸氧化酶从-20℃冰箱中拿出,融解后,量取5μl对工作电极采用滴注的方式进行修饰,修饰好以后,将电极放置于4℃冰箱中干燥保存即可。
105.(5)打开电化学工作站,设置参数最大电流为10a,最小电流为1pa,时间设置为100s,预热20min。
106.(6)向步骤(4)修饰好的电极工作区域添加步骤1)配制的乳酸标准溶液100μl,使溶液浸润工作电极,参比电极和对电极。
107.(7)红色线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好电极后,直接点击开始即可。
108.(8)通过标准曲线计算检测的浓度与实际添加浓度比较,回收率的范围为109%-118%,rsd范围为1.71%-6.32%。结果表明该检测方法可以应用到实际汗液检测,并且前处理简单。
109.实施例三
110.基于cu-tcpp(fe)/au金属有机框架纳米片及乳酸氧化酶纸基电化学生物传感器
的汗液中乳酸含量的实时检测方法特异性实验,包括以下步骤:
111.(1)将乳酸,nacl,kcl,cacl2,尿素,核黄素,葡萄糖试剂用1xpbs缓冲溶液配制成1mm的溶液,置于4℃冰箱中保存。
112.(2)将cu-tcpp(fe)/au混悬液从4℃冰箱中拿出,放置室温。
113.(3)量取73μl的混悬液通过滴注的方式对工作电极进行修饰,每次量取25μl,分三次进行修饰,每修饰完一次把电极放置于4℃冰箱中干燥2h。
114.(4)将乳酸氧化酶从-20℃冰箱中拿出,融解后,量取5μl对工作电极采用滴注的方式进行修饰,修饰好以后,将电极放置于4℃冰箱中干燥保存即可。
115.(5)打开电化学工作站,设置参数最大电流为10a,最小电流为1pa,时间设置为100s,预热20min。
116.(6)向步骤(4)修饰好的电极工作区域添加步骤1)配制的不同溶液100μl,使溶液浸润工作电极,参比电极和对电极。
117.(7)红色线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好电极后,直接点击开始即可。
118.(8)通过电化学工作站测得每个溶液的电流值大小,然后通过软件处理得到其柱状图,横坐标为不同的溶液,纵坐标为电流值,如图5所示。
119.为了验证本发明检测方法的特异性,选取nacl,kcl,cacl2,尿素,核黄素,葡萄糖和1xpbs缓冲溶液进行检测。由图5可知,本发明检测方法的特异性良好,待测物为乳酸时的电流值显著高于其他类似物的电流值。其他类似物几乎没有与乳酸氧化酶结合,对电流几乎没有影响,电流值变化不大。
120.实施例四
121.基于cu-tcpp(fe)/au金属有机框架纳米片及乳酸氧化酶纸基电化学生物传感器的汗液中乳酸含量的实时检测方法的重复性,包括以下步骤:
122.(1)将cu-tcpp(fe)/au混悬液和1mm乳酸溶液从4℃冰箱中拿出,放置室温。
123.(2)取一个纸基电极,量取73μl的混悬液通过滴注的方式对工作电极进行修饰,每次量取25μl,分三次进行修饰,每修饰完一次把电极放置于4℃冰箱中干燥2h。
124.(3)将乳酸氧化酶从-20℃冰箱中拿出,融解后,量取5μl对工作电极采用滴注的方式进行修饰,修饰好以后,将电极放置于4℃冰箱中干燥保存即可。
125.(4)打开电化学工作站,设置参数最大电流为10a,最小电流为1pa,时间设置为100s,预热20min。
126.(5)向步骤(4)修饰好的电极工作区域添加100μl 1mm乳酸溶液,使溶液浸润工作电极,参比电极和对电极。
127.(6)红色线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好电极后,直接点击开始即可。
128.(7)重复测量3次,记录每一次的电流值大小,计算其相对标准偏差。结果如表1所示。
129.表1
[0130][0131]
实施例五
[0132]
基于cu-tcpp(fe)/au金属有机框架纳米片及乳酸氧化酶纸基电化学生物传感器的汗液中乳酸含量的实时检测方法的重现性,包括以下步骤:
[0133]
(1)将cu-tcpp(fe)/au混悬液和1mm乳酸溶液从4℃冰箱中拿出,放置室温。
[0134]
(2)取三个纸基电极,量取73μl的混悬液通过滴注的方式对工作电极进行修饰,每次量取25μl,分三次进行修饰,每修饰完一次把电极放置于4℃冰箱中干燥2h。
[0135]
(3)将乳酸氧化酶从-20℃冰箱中拿出,融解后,量取5μl对工作电极采用滴注的方式进行修饰,修饰好以后,将电极放置于4℃冰箱中干燥保存即可。
[0136]
(4)打开电化学工作站,设置参数最大电流为10a,最小电流为1pa,时间设置为100s,预热20min。
[0137]
(5)向步骤(4)修饰好的电极工作区域添加100μl 1mm乳酸溶液,使溶液浸润工作电极,参比电极和对电极。
[0138]
(6)红色线接工作电极,蓝色线接参比电极,黑色线接对电极,连接好电极后,直接点击开始即可。
[0139]
(7)通过电化学工作站测量可以得到每个纸基电极的电流值大小,计算其相对标准偏差。结果如表1所示。
[0140]
为了验证本发明检测方法的重复性和重现性,选取1mm乳酸溶液进行测量。由表1可知,其相对标准偏差(rsd%)分别为0.88和2.45。结果表明所制备的基于cu-tcpp(fe)/au和乳酸氧化酶的生物传感器具有极好的可重复性和可再现性。
[0141]
以上实施例均以乳酸为检测对象。
[0142]
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1