基于等离子体修饰电极的神经节苷脂GD2移动检测装置
基于等离子体修饰电极的神经节苷脂gd2移动检测装置
技术领域
1.本发明涉及传感器领域,尤其涉及一种基于等离子体修饰电极的神经节苷脂(gd2)移动检测装置,将传感分析结果实时移动显示在手机微信小程序中。
背景技术:
2.神经母细胞瘤(neuroblastoma,nb)起源于肾上腺髓质或椎旁交感神经系统,是儿童最常见的颅外实体瘤,临床病程广泛,具有自发分化、快速进展和致命的特点
[1,2]
。目前神经母细胞瘤微小病灶检测的方法主要包括免疫细胞学、流式细胞术及定量逆转录聚合酶链式反应
[3]
。2009年国际神经母细胞瘤危险度分级协作组(inrg)定义了通过免疫细胞学和定量逆转录聚合酶链式反应作为神经母细胞瘤国际通用的微小病灶检测方法
[4]
。骨髓涂片技术计数方法存在缺陷,误差较大,不能可靠地检测到微小病灶,无法准确地量化浸润性肿瘤细胞的数量。并且,神经母细胞瘤细胞不具有特异性的形态,特别是作为单细胞存在时,可能无法在显微镜下检测到,假阴性形态学结果发现高达10%
[5]
。当肿瘤细胞浸润率低于0.1%时,常规细胞形态学几乎检测不到
[6]
。免疫细胞学染色计数法,显色剂带自荧光,在进行碱性磷酸酶驱动的底物反应时,不能进行荧光标记物的后续分析,计数需要依赖于操作者个人经验,不能做到完全客观
[7]
。因此需要更精确的微小病灶检测方法来检测高危nb患儿的骨髓转移情况。
[0003]
参考文献:
[0004]
[1]utnes,p.;lokke,c.;flaegstad,t.;einvik,c.,clinicallyrelevantbiomarkerdiscoveryinhigh-riskrecurrentneuroblastoma.cancerinformatics2019,18.
[0005]
[2]张淑萍,沈乐园,宋一玲,彭雄文,陈跃琼.ect骨显像和骨髓涂片在神经母细胞瘤骨转移中的临床应用[j].现代肿瘤医学,2020,28(06):989-993.
[0006]
[3]倪燕.基于gd2免疫细胞学的微小病灶检测在高危神经母细胞瘤中的临床意义[d].天津医科大学,2019.
[0007]
[4]beiske,k.;burchill,s.a.;cheung,i.y.;hiyama,e.;seeger,r.c.;cohn,s.l.;pearson,a.d.j.;matthay,k.k.,consensuscriteriaforsensitivedetectionofminimalneuroblastomacellsinbonemarrow,bloodandstemcellpreparationsbyimmunocytologyandqrt-pcr:recommendationsbytheinternationalneuroblastomariskgrouptaskforce.britishjournalofcancer2009,100(10),1627-1637.
[0008]
[5]wachowiak,r.;rawnaq,t.;metzger,r.;quaas,a.;fiegel,h.;kaehler,n.;rolle,u.;izbicki,j.r.;kaifi,j.;till,h.,universalexpressionofcelladhesionmoleculencaminneuroblastomaincontrasttol1:implicationsfordifferentrolesintumorbiologyofneuroblastomapediatricsurgeryinternational2008,24(12),1361-1364.
[0009]
[6]mehes,g.;luegmayr,a.;kornmuller,r.;ambros,i.m.;ladenstein,r.;gadner,h.;ambros,p.f.,detectionofdisseminatedtumorcellsinneuroblastoma-3logimprovementinsensitivitybyautomaticimmunofluorescenceplusfish(aipf)analysiscomparedwithclassicalbonemarrowcytology.americanjournalofpathology2003,163(2),393-399.
[0010]
[7]swerts,k.;ambros,p.f.;brouzes,c.;navarro,j.m.f.;gross,n.;rampling,d.;schumacher-kuckelkorn,r.;sementa,a.r.;ladenstein,r.;beiske,k.,standardizationoftheimmunocytochemicaldetectionofneuroblastomacellsinbonemarrow.journalofhistochemistry&cytochemistry2005,53(12),1433-1440.
技术实现要素:
[0011]
本发明针对神经节苷脂gd2阳性细胞,提供了一种基于等离子体修饰电极的神经节苷脂gd2移动检测装置,实现现阶段对于gd2阳性细胞的精准检测,详见下文描述:
[0012]
一种基于等离子体修饰电极的神经节苷脂gd2移动检测装置,所述装置包括:神经节苷脂gd2传感电极和差分脉冲电化学芯片,
[0013]
利用丝网印刷电化学三电极传感器件,通过计时电流法在ito工作电极上完成纳米石墨烯杂化金等离子体修饰;并利用等离子体静电吸附神经节苷脂gd2抗体;
[0014]
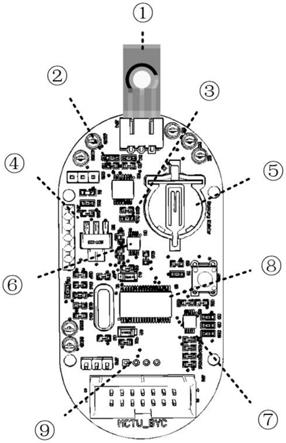
通过差分脉冲电化学芯片实现对gd2阳性细胞的高灵敏特异性检测。
[0015]
其中,所述利用丝网印刷电化学三电极传感器件为:
[0016]
制作ito电极片基底;在距离基底底端第一预设值处的中间位置作为工作电极的圆心,留出某一圆形作为工作电极,其余部分覆上一层隔水层;
[0017]
印刷上宽度为第二预设值的ag/agcl层作为电极接口和参比电极;涂覆一圈碳层作为对电极,该碳层与工作电极共圆心;在对电极和参比电极的外围覆上一层隔水层。
[0018]
进一步地,所述通过计时电流法在ito工作电极上完成纳米石墨烯杂化金等离子体修饰为:
[0019]
将羧基化石墨烯分散液与氯金酸等体积混合,取多滴加在制作好的ito电极片上,利用计时电流法在电极上修饰纳米石墨烯杂化金等离子体,设置负电位和沉积时间。
[0020]
其中,所述差分脉冲电化学分析器件包括:恒电位仪模块、跨阻放大器模块、基准源模块、电源管理模块、数模转换模块、模数转换模块、微控制器模块、蓝牙通信模块。
[0021]
优选地,所述数模转换模块在所述微控制器模块的命令下由数模转换芯片产生差分脉冲电化学的电压激励;所述恒电位仪模块用于对数模转换模块产生的电压激励进行调理和控制,保证参比电极和工作电极之间的电压;
[0022]
所述跨阻放大器模块将电化学反应电流转换为可测的电压信号,经过滤波电路处理后输送到模数转换模块进行信号采集,所述模数转换模块将采集到的数据发送给微控制器模块,所述微控制器模块进行数据解析,并将解析后的数据按照特定通信格式发送给蓝牙通信模块最终到达上位机进行显示输出。
[0023]
其中,利用制备的等离子体修饰的神经节苷脂gd2传感电极,在差分脉冲电化学分析器件中,对gd2阳性细胞进行传感检测;
[0024]
根据所检测的不同浓度的gd2阳性细胞的差分脉冲电流峰值与dmem缓冲液下检测
的电流峰值差的绝对值|
△
i|和gd2阳性细胞浓度的对数绘制拟合曲线,得到线性相关性方程。
[0025]
进一步地,通过所述蓝牙通信模块,将等离子体修饰的神经节苷脂gd2传感电极上的电化学检测数据,实时显示在移动终端。
[0026]
本发明提供的技术方案的有益效果是:
[0027]
1、本发明首次提出利用差分脉冲电化学手段检测gd2阳性细胞,现阶段常用方法是细胞学检查,灵敏度低,可靠性不高,因此本发明公开了差分脉冲电化学移动分析装置,依托微信小程序实时读取检测数据,具有线性范围宽,灵敏度高,响应速度快优点,便于实现对gd2阳性细胞的快速检测和智能联网分析;
[0028]
2、在检测癌症标记物gd2阳性细胞时,纳米石墨烯杂化金等离子体修饰电极起到了前端信号放大的作用,无需二抗的引入,可直接利用抗原抗体特异性结合,减少了特异性传感电极制备过程中的生物固定步骤,放大了电流信号,增加了检测精度,扩大了检测范围,能够满足临床对于痕量gd2阳性细胞精准检测的需求。
附图说明
[0029]
图1为等离子体修饰电极的gd2移动检测装置的结构示意图;
[0030]
图2为电化学三电极传感器件制作步骤的示意图;
[0031]
图3为纳米石墨烯杂化金等离子体修饰电极循环伏安表征的示意图;
[0032]
图4为纳米石墨烯杂化金等离子体修饰电极过程计时电流的示意图;
[0033]
图5为差分脉冲电化学激励信号的示意图;
[0034]
图6为不同浓度gd2阳性细胞的差分脉冲电化学检测曲线的示意图;
[0035]
其中,(a)0cells/ml,(b)1
×
102cells/ml,(c)5
×
102cells/ml,(d)1
×
103cells/ml, (e)5
×
103cells/ml,(f)1
×
104cells/ml,(g)5
×
104cells/ml,(h)1
×
105cells/ml,(i)5
×
105cells/ml。
[0036]
图7为不同浓度gd2阳性细胞的差分脉冲电流峰值与dmem缓冲液下检测的电流峰值差的绝对值|
△
i|和gd2阳性细胞浓度的对数(lg[gd2])之间的拟合曲线的示意图;
[0037]
图8为蓝牙选择和连接界面的微信小程序界面示意图;
[0038]
图9为参数选择和控制界面的微信小程序界面示意图;
[0039]
图10为数据显示和绘图界面的微信小程序界面示意图。
具体实施方式
[0040]
为使本发明的目的、技术方案和优点更加清楚,下面对本发明实施方式作进一步地详细描述。
[0041]
本发明实施例采用纳米石墨烯杂化金等离子体修饰电极,其中基底材料氧化铟锡(ito) 具有极高的透光率和导电率,纳米石墨烯杂化金等离子体具有良好的光催化增强电化学信号效应,可以极大地提高检测精度和灵敏度。此外等离子体通过静电吸附将gd2抗体固定在传感器上作为敏感层,利用抗原抗体特异性结合,特异性识别骨髓gd2阳性细胞。并且通过构建移动式差分脉冲电化学分析系统,依托小程序实时读取检测数据,实现对gd2 阳性细胞的快速检测和智能联网分析,对于临床有很大的研究应用价值。
[0042]
本发明实施例公开了一种基于等离子体修饰电极的神经节苷脂gd2移动检测装置,参见图1,该装置包括:神经节苷脂gd2传感电极1和差分脉冲电化学分析器件。
[0043]
一、神经节苷脂gd2传感电极1:
[0044]
利用丝网印刷技术电化学三电极传感器件(工作电极为氧化铟锡(ito)、参比电极为银/氯化银(ag/agcl)、对电极为碳);然后通过计时电流法在ito工作电极上完成纳米石墨烯杂化金等离子体修饰;并利用等离子体静电吸附神经节苷脂gd2抗体。
[0045]
1、制作电化学三电极传感器件:
[0046]
如图2所示,制作长为20mm,宽为8.5mm的ito电极片基底;在距离底端12mm处的中间位置作为工作电极的圆心,留出直径为4mm的圆形作为工作电极,其余部分覆上一层隔水层,防止工作电极溶液流出;印刷上宽度为1mm的ag/agcl层作为电极接口和参比电极;涂覆一圈碳层作为对电极,该碳层与工作电极共圆心,内直径为5.8mm,外直径为7.4mm,保证三电极体系,使得工作系统稳定;在对电极和参比电极的外围继续覆上一层隔水层,减少外界的干扰。
[0047]
上述数值仅是本技术的一个实例,本发明实施例对此不做限制。
[0048]
2、纳米石墨烯杂化金等离子体修饰:
[0049]
将1mg/ml的羧基化石墨烯分散液与1%氯金酸等体积混合,取100μl滴加在制作好的ito电极上,利用计时电流法在电极上修饰纳米石墨烯杂化金等离子体,其中设置负电位e=-0.6v,沉积时间设置30s、40s和50s。如图3所示,使用循环伏安法对纳米石墨烯杂化金等离子体修饰电极进行电化学性能表征,裸电极在电压0.338v处出现峰值为48.5μa 的氧化峰,当沉积t=30s时,在电压0.216v处出现峰值电流为97.9μa;当沉积t=40s时,在电压0.216v处出现峰值电流为126.3μa;当沉积t=50s时,在电压0.214v处出现峰值电流为99.0μa。沉积时间选取40s,当沉积t=40s时,计时电流约为-140μa时趋于稳定(图 4)。
[0050]
3、在步骤(2)制备的纳米石墨烯杂化金等离子体修饰电极上通过静电吸附作用固定神经节苷脂gd2抗体,100μl浓度为1mg/ml的gd2抗体滴加在步骤(2)制备的修饰电极上,4
°
下静置1h后用纯水冲洗掉多余未吸附的抗体,制成用于检测的gd2抗体/纳米石墨烯杂化金等离子体修饰ito电极。
[0051]
二、差分脉冲电化学分析器件
[0052]
参见图1,该器件由恒电位仪模块2、跨阻放大器模块3、基准源模块4、电源管理模块5、数模转换模块6、模数转换模块7、微控制器模块8、蓝牙通信模块9组成,通过该分析器件实现对gd2阳性细胞的高灵敏特异性检测。
[0053]
(2.1)该器件采用5v直流电源供电,电源管理模块5负责将输入的5v转为稳定的
±
5v 和3.3v,其中恒电位仪模块2、跨阻放大器模块3工作在
±
5v电压下,基准源模块4、数模转换模块6、模数转换模块7、微控制器模块8工作在3.3v电压下,蓝牙通信模块9工作在5v电压下。基准源模块4采用az431芯片产生1.24v的基准电压,作为系统的零电压,精度为
±
0.1mv。微控制器模块8采用低功耗的msp430fr5959芯片作为总控制中心,负责任务的调度、中断执行、数据处理。数模转换模块6作为激励信号发生器,在微控制器的命令下由数模转换芯片dac8562产生差分脉冲电化学的电压激励。恒电位仪模块2 作为差分脉冲电化学检测的核心模块,选用两个双电源四运放的集成运算放大器芯片 ad8674进行设计构建,主要作用是对数模转换模块6产生的电压激励进行调理和控制,保证参比电极和工作电极之间
的电压精准且稳定。跨阻放大器模块3由ad8674的双电源放大器组成,将电化学反应电流转换为可测的电压信号,经过滤波电路处理后输送到模数转换芯片ads1115进行信号采集。模数转换模块7将采集到的数据发送给微控制器,微控制器进行数据解析,并将解析后的数据按照特定通信格式发送给蓝牙通信模块9(hc-06),最终到达上位机进行显示输出。
[0054]
(2.2)差分脉冲电化学电压激励信号的控制参数为:初始电压-0.4v、终止电压0.4v、增量0.005v、振幅0.05v、脉宽0.05s、周期0.5s、采样频率4hz(图5)。使用定时器中断作为任务调度核心函数,每1ms中断一次,在特定的时间节点进行输出电压的变化,由此产生需要的时序激励波形,信号采集同样在中断函数中执行,在特定的时间节点进行信号采集和输出。控制的芯片包括:msp430fr5959微控制器芯片、dac8562数模转换芯片、 ads1115模数转换芯片。
[0055]
(2.3)电压输出部分:dac8562芯片具有16位精度,两个输出通道,参考电压选择 5v内部参考源,增益gain为2。输出电压公式为:vout=(din/216)
·
vref
·
gain(这里 din为程序写入值,vref为2.5v,gain为2)。硬件设计中控制工作电极电压始终为0v,只需改变参比电极的输出电压,考虑到基准电压约1.24v,经过换算,写入值din= (1.24-vout)
·216
·
(1/5)=(1.24-vout)
·
13107。如要输出0.2v的电压时,程序写入值应为1.04
·
13107=13631(取整)。
[0056]
(2.4)时序控制部分:每次进入定时器中断时计数n加1,数值代表第n毫秒。对于第一个周期,在第0ms时,设置输出初始电压-0.4v,写入值为21495;第445ms时进行电流信号采集,代表激励信号上跳前的电流值i1;第450ms时进行幅度为0.05v的上跳,设置输出电压为-0.35v,写入值为20840;第455ms时再次进行电流信号采集,代表激励信号上跳后的电流值i2,差分脉冲电化学的实际电流响应值i=i
2-i1;第500ms时进行幅度为 0.045v的下跳,设置输出电压为-0.395v,写入值为21430,相对于上跳完成了+0.005v的增量,此时第一个周期结束。在接下来的每个周期里,同样需要完成一次上跳、一次下跳和两次采样,直到输出电压达到终止电压时结束。
[0057]
(2.5)利用第一部分制备的等离子体修饰的神经节苷脂gd2传感电极1,在步骤(2.1) ~(2.4)构建的差分脉冲电化学分析器件中,对gd2阳性细胞进行传感检测,初始电压-0.4v、终止电压0.4v、增量0.005v、振幅0.05v、脉宽0.05s、周期0.5s、采样频率4hz。测试曲线如图6所示,首先电极上滴加对照组100μl的dmem缓冲液,得到第一条测试曲线,在电压为0.035v时出现峰值电流为66.84ma;之后在电极上滴加100μl的102cells/ml的 gd2阳性细胞溶液,得到第二条测试曲线,在电压为0.035v时出现峰值电流为60.60ma;在电极上滴加100μl的5
×
102cells/ml的gd2阳性细胞溶液,得到第三条测试曲线,在电压为0.040v时出现峰值电流为58.70ma;在电极上滴加100μl的1
×
103cells/ml的gd2 阳性细胞溶液,得到第四条测试曲线,在电压为0.040v时出现峰值电流为56.76ma;在电极上滴加100μl的5
×
103cells/ml的gd2阳性细胞溶液,得到第五条测试曲线,在电压为 0.045v时出现峰值电流为54.30ma;在电极上滴加100μl的1
×
104cells/ml的gd2阳性细胞溶液,得到第六条测试曲线,在电压为0.055v时出现峰值电流为44.40ma;在电极上滴加100μl的5
×
104cells/ml的gd2阳性细胞溶液,得到第七条测试曲线,在电压为0.040v 时出现峰值电流为38.57ma;在电极上滴加100μl的1
×
105cells/ml的gd2阳性细胞溶液,得到第八条测试曲线,在电压为0.045v时出现峰值电流为31.63ma;在电极上滴加100μl 的5
×
105cells/ml的gd2阳性细胞
溶液,得到第九条测试曲线,在电压为0.050v时出现峰值电流为22.31ma。可以发现,在0.05v附近出现峰值电流,并且随着gd2阳性细胞浓度的提高,差分脉冲电化学曲线的峰值电流逐渐降低。
[0058]
(2.6)根据所检测不同浓度的gd2阳性细胞的差分脉冲电流峰值与dmem缓冲液下检测的电流峰值差的绝对值|
△
i|和gd2阳性细胞浓度的对数(lg[gd2])绘制拟合曲线(图7),得到线性相关性方程:
△
i=9.753
×
lg[gd2]-14.01,检测范围为102~5
×
105cells/ml,相关系数r2是0.9532,检测下限可达102cells/ml。
[0059]
三、上位机微信小程序:
[0060]
通过步骤(2.1)~(2.4)构建的差分脉冲电化学分析器件中的蓝牙通信模块9,将等离子体修饰的神经节苷脂gd2传感电极1上的电化学检测数据,实时移动显示在手机微信小程序中。主要分为三个界面:蓝牙选择和连接界面(图8)、参数选择和控制界面(图9)、数据显示和绘图界面(图10)。
[0061]
(3.1)蓝牙选择和连接界面中,设置“打开蓝牙”和“关闭蓝牙”的开关按钮,设计下拉刷新蓝牙设备的功能,在蓝牙设备显示列表里设计蓝牙信号强度的标志,分为四个强度等级,满格表示信号最强;蓝牙连接后,设置“断开蓝牙”的按钮,方便用户灵活使用。
[0062]
(3.2)在参数选择和控制界面中,实现初始电压、终止电压、增量、振幅、脉宽和周期六个参数的可调,调节方式为手动数字输入方式;最下方设计“开始检测”按钮,点击后自动进入数据显示和绘图界面。
[0063]
(3.3)在数据显示和绘图界面中,显示绘图区域,在其下方设置“清除画板”和“保存图像”两个按钮,用户可在检测完成后进行相关操作。绘图区域下方为数据显示区域,用户可实时看到数据的具体数值,同样在数据显示区域的下方设有“清除数据”和“保存数据”的按钮,方便用户进行相关操作。本发明实施例对各器件的型号除做特殊说明的以外,其他器件的型号不做限制,只要能完成上述功能的器件均可。
[0064]
本领域技术人员可以理解附图只是一个优选实施例的示意图,上述本发明实施例序号仅仅为了描述,不代表实施例的优劣。
[0065]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1