一种用于小麦叶片表面苯菌酮的质谱成像检测方法
1.本发明涉及分子成像技术领域,更具体地涉及一种用于小麦叶片表面苯菌酮的质谱成像检测方法。
背景技术:
2.苯菌酮(mf)是主要用于防治禾谷类作物、番茄、黄瓜和葡萄白粉病和眼点病的一种二苯甲酮类杀菌剂,由于其良好的预防和治疗效果,目前已经多种农作物上大量应用。该农药的施药方式一般为兑水后喷洒于农作物叶片表面,但目前并没有能直接在实际叶片表面检测物质种类及浓度的分析检测仪器装置。
3.质谱成像法(mass spectrometry imaging,msi))是由质谱技术发展而来的一种新型分子成像技术。它通过直接扫描生物组织切片,同时获得生物分子的定性、定量和定位的信息,具有免标记、高通量和高分辨等优点,在药物分析、癌症研究和环境毒理等各种研究领域具有广泛的应用前景。然而,对农药分子而言(尤其是苯菌酮),使用质谱成像法精确获得其在实际叶片表面的空间分布及直接检测其浓度的实际范例十分匮乏。同时,使用msi分析农药分子时需要加入基质,而现有技术中常用的基质易对目标物产生较大干扰。
技术实现要素:
4.为了解决上述现有技术中的农药难以在植物叶片表面直接进行分析的问题,本发明提供一种用于小麦叶片表面苯菌酮的质谱成像检测方法。
5.根据本发明的用于小麦叶片表面苯菌酮的质谱成像检测方法,其包括如下步骤:s1,提供表面附着有苯菌酮的小麦叶片;s2,将基质通过升华法涂覆到小麦叶片的表面;s3,设置喷涂厚度范围为0.7μm-1.5μm,激光斑点直径及激光强度范围为(40μm-75μm,56.4%-71.0%)和成像步长为(30μm-50μm,30μm-50μm)进行maldi-msi分析。
6.优选地,在步骤s1中,小麦叶片表面附着的苯菌酮的沉积量≥2.0ng。在一个优选的实施例中,小麦叶片表面附着的苯菌酮的浓度为100μm,沉积量为40.0ng。
7.优选地,在步骤s2中,基质为chca或dhb。
8.优选地,步骤s2具体包括:在升华仪的狭缝腔体中装入基质的粉末以进行涂覆。
9.优选地,升华仪设定基质的涂覆厚度为1.2μm。
10.优选地,该质谱成像检测方法还包括结合冷冻切片技术观察苯菌酮在小麦叶片中的纵向截面分布。
11.优选地,该质谱成像检测方法还包括配置不同浓度梯度的苯菌酮溶液,利用质谱成像仪建立外标法标准曲线,以对苯菌酮进行定量分析。
12.优选地,确定浓度检测限的苯菌酮溶液的浓度梯度为1μm、5μm、10μm、15μm、20μm。
13.优选地,外标法标准曲线的苯菌酮浓度分别为20μm、50μm、80μm、100μm。
14.根据本发明的用于小麦叶片表面苯菌酮的质谱成像检测方法,通过筛选基质的种类,进一步优化涂覆方法和仪器参数,能够有效避免基质对目标物的干扰,通过仪器参数优
化使得成像热图清晰直观。该方法是一种原位分析方法,相对于传统的技术方法(例如液相色谱、高分辨质谱等),要对叶片表面的农药进行定性定量分析,必须对农药进行洗脱处理,在洗脱方法上还需要探索、验证与优化,且现有的前处理步骤会降低检测的精确性(如定量分析),而本发明首次提出通过质谱成像仪对叶片表面苯菌酮进行定性定量的研究,尤其是定量方面,将外标法用于质谱成像仪中对叶片表面苯菌酮浓度定量的研究,具有快速简便,无需前处理,检测限低,灵敏度高,物质空间分布情况直观明了的优点。
附图说明
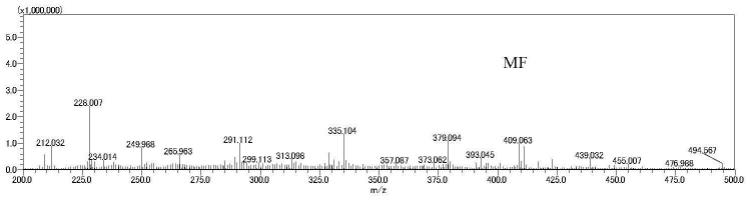
15.图1a是根据本发明的实施例的mf的质谱信号图,其中c
mf
=500μm,横坐标为质荷比(m/z),纵坐标为质谱峰平均强度,苯菌酮的m/z([m+h]
+
)为409.06和411.06;
[0016]
图1b是根据本发明的实施例的mf的在金属靶板孔位上的空间分布图;
[0017]
图2a是根据本发明的实施例的正离子模式且基质为chca的mf的质谱信号图;
[0018]
图2b是根据本发明的实施例的正离子模式且基质为dhb的mf的质谱信号图;
[0019]
图2c是根据本发明的实施例的负离子模式且基质为9aa的mf的质谱信号图;
[0020]
图3a是根据本发明的实施例的采用dhb基质在喷枪法下的质谱信号;
[0021]
图3b是根据本发明的实施例的采用dhb基质在喷枪法下的空间分布;
[0022]
图3c是根据本发明的实施例的采用dhb基质在基质升华法下的质谱信号;
[0023]
图3d是根据本发明的实施例的采用dhb基质在基质升华法下的空间分布;
[0024]
图4是根据本发明的实施例的基质升华法不同喷涂厚度下mf的空间分布图;
[0025]
图5a是根据本发明的实施例的不同激光斑点直径及激光强度下mf的离子质谱峰;
[0026]
图5b是根据本发明的实施例的不同激光斑点直径及激光强度下mf的空间分布图;
[0027]
图6a是根据本发明的实施例的不同成像步长下mf的离子质谱峰;
[0028]
图6b是根据本发明的实施例的不同成像步长下mf的空间分布图;
[0029]
图7a是根据本发明的实施例的c
mf
=1μm(沉积量0.4ng)时正离子模式且基质为chca下的mf质谱信号图;
[0030]
图7b是根据本发明的实施例的c
mf
=5μm(沉积量2.0ng)时正离子模式且基质为chca下的mf质谱信号图;
[0031]
图8是根据本发明的实施例的外标法标准曲线图;
[0032]
图9是根据本发明的实施例的mf在小麦叶片表面的分布特征;
[0033]
图10是根据本发明的实施例的mf在小麦叶片的纵向截面分布。
具体实施方式
[0034]
下面结合附图,给出本发明的较佳实施例,并予以详细描述。
[0035]
本发明所用到的质谱成像仪购自日本岛津公司(imscope trio
tm
)。
[0036]
实施例1
[0037]
本实施例可用于苯菌酮在植物叶片表面原位定性定量分析。该实施例为苯菌酮在实际叶片表面原位定性定量分析的具体实施方法。
[0038]
(1)小麦的培养
[0039]
实验所用小麦是在人工气候培养箱中经土培获得,具体操作如下:麦种经清洗后
浸泡育种,再平铺至育苗纸黑暗催芽。芽长1cm左右开始在条件设定的人工气候培养箱中培养,光照与黑暗循环。光照时间14小时,温度20℃,湿度75%,光强25000lx;黑暗时间10小时,温度15℃,湿度65%,光强0。小麦培养至5叶期开始用于实验。
[0040]
(2)方法初探
[0041]
称取一定量mf溶于乙腈(acn)中配置成浓度为500μm的mf标准品溶液,将chca溶解于acn/h2o(1:1,v:v)中形成10mg
·
ml-1
溶液(含0.1%三氟乙酸)。将mf标准品溶液与chca基质溶液按1:1(v:v)混匀。吸取0.5μl的mf/chca混合液滴于金属靶板孔位上,干燥后在正离子模式下进行maldi-msi分析。图1a给出了mf的质谱信号:已知正离子模式下mf的两种溴同位素结构([m+h]
+
=409.06/411.06),而图1a中明显检测到该信号;图1b给出了mf在金属靶板孔位上的空间分布:其中左一为测定靶点处光学图像,中间为mf信号及强度分布,右一为光学图像与mf信号合成图,明显可以看出该方法用于mf原位定性的可行性。本次初步点涂实验检测到了mf在金属靶板上的分布,证明利用maldi-msi技术对农药分子进行分析检测是可行的。
[0042]
(3)基质的选择与优化
[0043]
利用双面导电胶将小麦叶片固定至涂有氧化铟锡涂层的导电载玻片上,再将mf标准品溶液稀释至浓度为100μm后滴加到实验叶片表面,滴加量3μl,自然干燥。分别将α-氰基-4-羟基肉桂酸(chca)、2,5-二羟基苯甲酸(dhb)和9-氨基吖啶(9aa)溶解于acn/h2o(1:1,v:v)中形成10mg
·
ml-1
溶液。采用干滴法分别将3种基质溶液滴加至叶片表面的样品上,滴加量3μl,再次干燥后进行检测。图2a给出了正离子模式且基质为chca的mf的质谱信号,图2b给出了正离子模式且基质为dhb的mf的质谱信号,图2c给出了负离子模式且基质为9aa的mf的质谱信号,由本次实验发现chca和dhb这两种基质在正离子模式下的优势明显,mf的质谱峰信号很强,其中dhb的基质峰干扰较少。虽然chca基质峰较多且信号较强,但并不干扰mf的质谱检测。
[0044]
(4)基质涂覆方法的选择与优化
[0045]
含mf叶片样品的准备同(3),基质选择dhb,分别采用喷枪法和基质升华法涂覆。喷枪法中dhb溶解于acn/h2o(1:1,v:v)中形成10mg
·
ml-1
溶液,取4ml装入商业喷枪(platinum 0.2,千代田,日本)的枪杯中,调节枪口风量阀及枪尾出液阀至喷速最低,每层喷涂10s且间歇10min,共涂10层,完全干燥后测样。基质升华法则直接在狭缝腔体装入适量的dhb粉末,升华仪(imlayer
tm
,岛津,日本)程序设定基质厚度1.2μm。图3a给出了在喷枪法下的质谱信号,图3b给出了在喷枪法下的空间分布,图3c给出了在基质升华法下的质谱信号,图3d给出了在基质升华法下的空间分布,其中,图3b和图3d的左图为mf信号及强度分布图,右图为叶片表面光学图像与mf信号合成图。对比两种基质涂覆方式,mf的质谱信号响应均良好,但喷枪法的基质杂峰过多,且通过mf空间分布图可以看出,物质的原本空间分布被破坏,主要由喷枪气流及液滴冲刷导致。基质升华法则操作简便,基质无须配制,不用耗时喷涂及干燥,基质厚度可控,实验易重复,基质杂峰较少。因为基质升华过程缓和,能够保持原有mf空间分布。
[0046]
(5)基质升华法喷涂厚度优化
[0047]
含mf叶片样品的准备同(3),基质选择及涂覆方法准备同(4)中基质升华法。升华仪程序设定基质厚度分别为0.7μm、1.0μm、1.2μm和1.5μm。图4给出了不同基质厚度下mf的
空间分布图。由mf的成像图可以看出,上述4个喷涂厚度均较清晰,因此喷涂厚度的最佳范围为0.7μm-1.5μm,其中1.2μm为最佳的基质升华法喷涂厚度。
[0048]
(6)成像质谱仪参数优化
[0049]
叶片表面滴加mf浓度为100μm,滴加量3μl,基质dhb,基质升华法程序设定基质厚度1.2μm。首先根据dhb基质激光斑点直径及与之匹配的最优激光强度进行二者的同步优化。图5a给出了不同激光斑点直径及激光强度下mf的离子质谱峰,图5b给出了不同激光斑点直径及激光强度下mf的空间分布图。通过mf的离子质谱峰可以看出,由于激光强度大,离子化程度高,(150μm,87.1%)和(180μm,89.9%)两组mf峰强值最大,但同时基质及杂质的峰强值也大,在同一离子质谱图中观察,mf峰并不明显,而组合(40μm,56.4%)和(75μm,71.0%)的mf峰在质谱图中更为明显,因此激光直径在20-60μm范围内,激光强度在56.4-71.0%范围内即可。其中(40μm,56.4%)组合的mf成像图最为清晰和完整。
[0050]
然后选取了6个步长梯度进行实验,旨在选取最佳的成像步长范围。图6a给出了不同成像步长下mf的离子质谱峰,图6b给出了不同成像步长下mf的空间分布图。由mf的成像图可以看出,步长为(30μm,30μm)的成像图十分清晰,(50μm,50μm)次之。由于最优的激光斑点直径为40μm,若选择成像步长为(30μm,30μm),则激光扫描时相邻斑点之间存在重合区域,保证了分析区域的全面性;而(50μm,50μm)则表明激光斑点之间还存有10μm的未分析区域,但分析时间比(30μm,30μm)少0.3h。所以,最佳步长的范围可定为(30μm,30μm)-(50μm,50μm)区间内。
[0051]
(7)方法最低检测限的确定及外标法标准曲线的测定
[0052]
方法经过基质、涂覆方法及参数的优化后,接下来确定该方法的仪器最低检测限,测试方法灵敏度。将mf标准品溶液稀释至浓度分别为1μm、5μm、10μm、15μm、20μm,滴加量1μl,则自然干燥后的mf沉积量分别为0.4ng、2.0ng、4.0ng、6.0ng、8.0ng。基质选择chca,基质升华仪设定基质厚度1.2μm。maldi-msi激光斑点直径40μm,激光强度56.4%,成像步长30μm
×
30μm。在mf沉积量为0.4ng处,成像图基本看不到mf的存在与分布。设置检测峰高为0.10%时,质谱图也没有出现0.4ng mf的物质峰。但在沉积量为2.0ng处能看到mf分布与同位素质谱峰。图7a为c
mf
=1μm(沉积量0.4ng)时正离子模式且基质为chca下的mf质谱信号图,图7b为c
mf
=5μm(沉积量2.0ng)时正离子模式且基质为chca下的mf质谱信号图,由图中可以看出当c
mf
=1μm时,未能检测到mf质谱信号,而当c
mf
=5μm时,可以检测出mf的两种溴同位素结构。根据本实验结果,mf最低检测限为2.0ng。annangudi等建立杀菌剂唑菌胺酯在小麦叶片的maldi-msi检测方法的最低检测限为60.0ng,相比之下,本发明的检测方法灵敏度提高了30倍。
[0053]
测定外标法的标准曲线以对叶片表面mf进行定量分析。将mf母液稀释得到浓度梯度分别为20μm、50μm、80μm、100μm的标准品,滴加到小麦叶片表面,滴加量3μl,自然干燥后测样。基质chca,涂覆厚度1.2μm,maldi-msi参数同最低检测限的测定。如图8所示,平均峰值与mf的摩尔浓度呈正相关关系,且该方法的外标法标准曲线相关系数为0.9946,相关性较好,可用于mf在叶片表面上的定量分析。
[0054]
(7)mf在小麦叶片表面和纵向截面上的分布特征
[0055]
为了解mf在小麦叶片表面的分布特征,先对小麦叶片表面进行扫描电子显微镜(sem)分析,然后在小麦叶片表面滴加mf(500μm)标准品溶液8μl,将样品进行maldi-msi分
析,基质chca,涂覆厚度1.2μm,maldi-msi参数设置同(6)。通过sem分析可见小麦叶片上表皮呈现出一列列有序的瓦楞状结构,表面有褶皱,叶毛、气孔器和叶缝等结构清晰可见。
[0056]
图9为mf在小麦叶片表面的分布特征,其中左图为mf信号及强度分布图,右图为叶片表面光学图像与mf信号合成图,可以看出施药后作物体上的杀菌剂分布与作物形态有密切关系。在以上实验基础上,结合冷冻切片技术,直接观察mf渗入后在小麦叶片的纵向截面分布。滴加mf(500μm)标准品溶液8μl至叶片干燥。明胶:h2o=1:9(m:m)于40℃溶化后将含mf的叶片样品冷冻包埋于模具中,在-20℃利用组织冷冻培养基将包埋样品固定于样本盘中,利用冷冻切片机进行切片,厚度设置为60μm。基质chca,涂覆厚度1.2μm,maldi-msi参数设置同(6)。图10为mf在在小麦叶片的纵向截面分布,其中左图为mf信号及强度分布图,右图为叶片表面光学图像与mf信号合成图,结果证明,该方法结合冷冻切片技术能够得到mf渗入后在小麦叶片的纵向截面分布图,直观明了。
[0057]
(8)农业生产mf商业制剂的原位检测
[0058]
mf商业制剂(巴斯夫
·
英腾,悬浮剂,42%)经hplc外标法测定浓度为0.8m。本实验稀释mf商业制剂至100μm,在小麦叶片上的滴加量为3μl。基质dhb,涂覆厚度1.2μm,maldi-msi参数设置同(6)。实验结果表明,基于maldi-msi构建的叶片表面mf的原位分析方法适用于实际使用的mf商业制剂的检测,具有实际应用的意义。
[0059]
如此,本发明对比涂覆3种不同有机基质下苯菌酮(mf)质谱信号强度和基质质谱峰的干扰情况,筛选出最佳基质;选择不同的涂覆方式,根据mf的质谱图和空间分布图确定最佳的涂覆方式;设置不同喷涂厚度,根据mf空间分布图确定最佳的喷涂厚度范围;设置不同的激光强度及成像步长,优化仪器参数;设置5个mf低质量梯度确定该方法最低检测限;配置不同浓度梯度的mf溶液,利用质谱成像仪建立标准曲线,可对mf进行定量分析;基于maldi-msi技术并结合冷冻切片技术直接观察mf渗入后在小麦叶片的纵向截面分布;最后运用该方法对实际农业生产的mf商业制剂进行检测。本发明提供用于小麦叶片表面mf的质谱成像检测方法快速简便,无需进行前处理,既可以直观明了地观察mf及其光解产物在实际叶片表面的空间分布,也能准确对mf进行定量,能够很好的应用于实际。
[0060]
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1