一种检测胰岛素受体胞外段抗体的试剂盒
1.本发明属于生物医药技术领域,具体涉及一种检测胰岛素受体胞外段抗体的试剂盒。
背景技术:
2.b型胰岛素抵抗综合征(type b insulin resistance syndrome,tbirs)是由于体内产生针对胰岛素受体的自身抗体所致的一种临床综合征,严重的高血糖和胰岛素抵抗是该病的主要临床特征。b型胰岛素抵抗综合征的诊断主要依靠临床和免疫两个方面,免疫诊断即检测胰岛素受体抗体。胰岛素受体抗体阳性是确诊的标准。由于实验条件限制,胰岛素受体抗体的检测尚未在临床广泛开展,尚无成熟的试剂盒,所以目前多数病例研究仍依靠临床诊断。
3.胰岛素受体抗体的检测在过去缺少一个高效、准确的方法。较早出现的一种检测方法是通过采用胰岛素的竞争性结合实验来间接的推测胰岛素受体抗体的存在,此方法较为耗时,且只适用于少量样品的分析,目前只能在世界范围内的少数实验室中进行。2008年出现了使用s
35
标记的胰岛素受体与样本结合(ping zhou et al.2008),通过免疫沉淀法进行胰岛素受体抗体的检测,但该方法使用了胰岛素受体的全长蛋白进行标记,而胰岛素受体蛋白作为一个跨膜蛋白,具有疏水性,在翻译过程中会不可避免的出现聚集,影响翻译的效率与实验的稳定;此外胰岛素受体蛋白的胞外段结构域富含二硫键,也不适合用此方法进行蛋白的表达,会导致二硫键的缺失,影响整个蛋白原有空间结构的形成。
技术实现要素:
4.本发明的目的是提供一种检测胰岛素受体胞外段抗体的试剂盒,通过构建胰岛素受体蛋白胞外段质粒并将其表达得到抗原蛋白,经i
125
放射性标记后,实现对胰岛素受体胞外段抗体检测。
5.为了实现上述目的,本发明采用以下技术方案:
6.一种检测胰岛素受体胞外段抗体的试剂盒,包括:放射性i
125
标记的胰岛素受体胞外段蛋白、tbst缓冲液、蛋白a琼脂糖和蛋白g琼脂糖;
7.所述放射性i
125
标记的胰岛素受体胞外段蛋白是采用na-i
125
对胰岛素受体胞外段蛋白进行标记后得到,所述胰岛素受体胞外段蛋白的氨基酸序列如seq id no.1所示。
8.进一步地,所述采用na-i
125
对胰岛素受体胞外段蛋白进行标记,具体过程为:将na-i
125
加至磷酸缓冲液中,再加入胰岛素受体胞外段蛋白和氯胺-t,然后加入还原剂偏重亚硫酸钠,经柱层析得到标记后的蛋白。
9.本发明构建了包括胰岛素受体蛋白胞外段结构域(由a链及部分b链组成)的质粒,经过细胞转染得到抗原蛋白inrab,然后将其进行i
125
放射性标记,标记后的inrab仍然具有良好的生物活性,且能够携带足够的放射信号。基于以上的改进本发明成功建立了首个针对胰岛素受体胞外段抗体inraba的检测试剂盒。
附图说明
10.图1为不同模拟样本添加量下inraba检测的放射读数。
11.图2为健康人群rbainraba检测的结果。
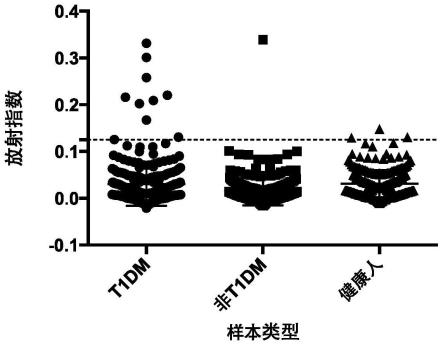
12.图3为inraba分别在非t1dm、t1dm及健康人群中的分布结果。
具体实施方式
13.胰岛素受体抗体的检测对临床诊断b型胰岛素抵抗综合征具有极高的参考意义。鉴于过去采用全长蛋白的检测方法的低效以及不稳定,本发明先评估了胰岛素受体蛋白的整体结构,选择单独拆分出胰岛素受体蛋白胞外段结构域(由a链及部分b链组成),避开跨膜的疏水区域后,使其具有良好的亲水性,便于后续反应的进行。由于胞外段结构域富含二硫键的特殊性,原有报道的s
35
放射配体法并不适合该部分结构的表达。因此本发明在申请人已有的i
125
放射配体法检测平台上,保留该结构域全部二硫键的完整性,完成对该胞外段蛋白的i
125
放射性标记,标记后的胰岛素受体胞外段蛋白inrab仍然具有良好的生物活性,且能够携带足够的放射信号。基于以上的改进本发明成功建立了首个针对胰岛素受体胞外段蛋白inrab的抗体(inraba)检测试剂盒。
14.该试剂盒的原理是将合成的胰岛素受体胞外段蛋白,标记i
125
同位素后置于液相环境进行结合,血清中的胰岛素受体胞外段抗体在液相环境中与之结合,形成聚合物,被琼脂糖抓取固定于pvdf平板上,血清中的抗体量通过结合的抗原蛋白上放射性信号计算即可得到。
15.本发明在现有的放射配体检测法基础上,总结过往的胰岛素受体抗体检测的经验与不足,结合胰岛素受体蛋白跨膜的结构特点,首次将胰岛素受体拆解为两部分,一部分为胞外段,一部分为胞内段,该拆解有效的解决了过往检测中因跨膜区域不溶于水带来的蛋白质聚集不良影响,也对针对不同位点的抗体进行了有效区分。
16.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
17.实施例1
18.一、实验材料
19.1.样本来源:inraba检测阳性质控样本来自于购买的针对inrab胞内段蛋白的商品化抗体。阴性质控血清标本取自于无糖尿病家族史的健康志愿者。糖尿病(dm)血清533例,其中1型糖尿病(t1dm 270例),非1型糖尿病(非t1dm 263例)。健康人345例来自招募人群[年龄(28.6
±
4.6)岁;男176例,女169例];糖耐量检测(ogtt)空腹及2h血糖正常,排除心、脑、肝、肾等慢性及内分泌疾病,无糖尿病家族病史及自身免疫疾病史。所有研究对象均签署知情同意。
[0020]
2.主要试剂及仪器:na-125
i(nez033l,perkinelmer),蛋白a琼脂糖pa(17-5280-02,ge);蛋白g琼脂糖pg(17061805,ge);96孔pvdf微孔过滤板(3504,corning);闪烁液(microscint-20,perkin-elmer);tbst缓冲液(tris-base 2.424g,nacl 8.70g,tween-20 1.5ml,加蒸馏水定容至1000ml,ph7.4);抗原缓冲液(tbst缓冲液加牛血清白蛋白0.25mg/
250ml);inraba(ab44914,abcam);sephadex g-50(17004301,ge);无机盐购自sigma。co2培养箱(thermo),nanodrop2000(thermo),βcounter液体闪烁计数仪(2450microplate counter,perkin-elmer)。
[0021]
二、实验方法
[0022]
1.构建inrab质粒
[0023]
inrab质粒序列包括信号肽+a链+部分b链。
[0024]
2.转染细胞,纯化抗原蛋白
[0025]
培养293f细胞处于对数生长期,活力大于95%,将孵育好的质粒添加到细胞中,37℃悬浮培养,第4天计数细胞,观察细胞状态及死亡率,收获细胞。收集细胞沉淀,12000rpm15min,弃细胞上清,沉淀用于下游纯化。细胞破碎后,利用低压层析系统,样品与ni-ida-sepharose cl-6b亲和层析柱孵育后的混合体缓慢加入纯化空柱中。收集的蛋白溶液加入透析袋中,使用含300mm nacl ph8.0的50mm tris进行透析过夜,获得纯化抗原蛋白。
[0026]
蛋白的氨基酸序列(seq id no.1)如下:
[0027]
matggrrgaaaapllvavaalllgaaghlypgevcpgmdirnnltrlhelencsvieghlqillmfktrpedfrdlsfpklimitdylllfrvygleslkdlfpnltvirgsrlffnyalvifemvhlkelglynlmnitrgsvrieknnelcylatidwsrildsvednyivlnkddneecgdicpgtakgktncpatvingqfvercwthshcqkvcptickshgctaeglcchseclgncsqpddptkcvacrnfyldgrcvetcpppyyhfqdwrcvnfsfcqdlhhkcknsrrqgchqyvihnnkcipecpsgytmnssnllctpclgpcpkvchllegektidsvtsaqelrgctvingsliinirggnnlaaeleanlglieeisgylkirrsyalvslsffrklrlirgetleignysfyaldnqnlrqlwdwskhnltitqgklffhynpklclseihkmeevsgtkgrqerndialktngdqascenellkfsyirtsfdkillrwepywppdfrdllgfmlfykeapyqnvtefdgqdacgsnswtvvdidpplrsndpksqnhpgwlmrglkpwtqyaifvktlvtfsderrtygaksdiiyvqtdatnpsvpldpisvsnsssqiilkwkppsdpngnithylvfwerqaedselfeldyclkglklpsrtwsppfesedsqkhnqseyedsageccscpktdsqilkeleessfrktfedylhnvvfvprpsrkrrslgdvgnvtvavptvaafpntsstsvptspeehrpfekvvnkeslvisglrhftgyrielqacnqdtpeercsvaayvsartmpeakaddivgpvtheifennvvhlmwqepkepnglivlyevsyrrygdeelhlcvsrkhfalergcrlrglspgnysvriratslagngswteptyfyvtdyldvpsniak。
[0028]
3.抗原蛋白标记同位素
[0029]
3mci的na-i
125
,体积20μl,加入80μl 0.2m的磷酸缓冲液pb,再加入50μl抗原蛋白溶液。加入20μg/μl的氯胺-t(溶解于50mm pb溶液),震荡1.5min。立即加入40μg/20μl的还原剂偏重亚硫酸钠(溶解于50mm pb溶液),震荡反应2min.过柱sephadex g-50,70mm巴比通溶液洗脱,收集标记好的抗原蛋白溶液。
[0030]
4.待测样本与抗原蛋白的结合与检测
[0031]
每孔各加8μl样本血清或模拟样本,每个标本和质控血清均为双复孔,取适量标记抗原,用6ml tbst缓冲液稀释标记抗原至20000cpm/60μl,向其中每孔加60μl稀释后的inrab抗原,每孔cpm值要求≥20000,标记抗原与血清混匀振荡1小时,4℃冰箱中过夜。孵育pvdf板,150μl tbst/孔,4℃冰箱中过夜。次日,倒去pvdf板中的液体,每孔中加25μl的蛋白a/g混合琼脂糖(62.5%的pa与20%的pg按4:1配制),依次从96孔平板各孔中取出50μl混合液转移至96孔pvdf过滤板上,4℃冰箱中混匀1h沉淀抗原-抗体复合物后取出,真空泵抽吸
去液体,先向pvdf过滤板各孔中加200μl tbst缓冲液洗涤沉淀物,真空泵抽吸去液体留取沉淀物,再加150μl缓冲液重复洗涤7次,置于烘箱烘干后每孔加入60μl闪烁液,置96孔βcounter计数仪上计数,每孔计数1min。
[0032]
按下式计算结果:
[0033]
放射指数(index)=(标本血清cpm-阴性质控cpm)/(阳性质控cpm-阴性质控cpm)。
[0034]
所有数据均采用spass26软件进行统计,对所有计量资料符合正态分布的以用均数
±
标准差表示,组间比较采用t检验、单因素方差分析、方差分析趋势性检验。p《0.05为差异显著,具有统计学意义。
[0035]
三、实验结果
[0036]
1.inrab抗原蛋白携带放射性信号捕获inraba的有效性判断
[0037]
将购买的inraba作为模拟样本,与带有放射性信号的inrab抗原共同孵育,进行捕获。根据上述实验方法,检测不同模拟样本量下的放射读数。
[0038]
如图1所示,放射性读数随着模拟样本加样量的递减而递减,经过方差分析趋势性检验p《0.0001,趋势性极显著。因此该inrab抗原可有效捕获inraba,其携带的放射信号随着抗体含量的变化而变化。
[0039]
后续实验中使用购买的抗体作为阳参,根据信噪比(s/n)》15(s/n:不同inraba添加量的cpm值/阴参的cpm值)以及成本综合考虑,选用0.2ug抗体,cpm约4693作为阳参的加样量,如表1。
[0040]
表1不同inraba添加量下信噪比(s/n)
[0041][0042]
2.inraba检测的正常人界值判定
[0043]
取115例健康人血清进行rbainraba的测定,计算放射指数,取99%百分位点为界值,经计算阳性界值为0.125,阳性判断标准为≥0.125,如图2所示。
[0044]
3.inraba检测的批内批间差异
[0045]
根据inraba指数低、中、高在正常人和患者中选择3份血清在批内和批间各重复检测5次(n=5),批内和批间变异系数(coefficient of variance,cv)见表2。
[0046]
表2 inraba检测的批内批间差异
[0047][0048]
结果显示rba inraba检测指数的批内cv为4.81%~8.83%,批间cv为6.69%~
12.70%,阴阳性结果判断重复性100%。
[0049]
4.inraba在不同人群中的分布
[0050]
检测inraba分别在t1dm、非t1dm及健康人群中的百分比,分别为3.7%(10/270)、0.38%(1/263)及0.87%(2/230),经单因素方差分析p《0.01,差异极显著。如图3所示。
[0051]
本发明固件的胰岛素受体胞外段蛋白inrab可有效携带放射性信号,通过放射配体法可有效识别inraba,填补了inraba检测的空白。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1