一种基于蛋白冠的血清高丰度蛋白去除方法
1.本发明属于生物技术领域,具体涉及一种基于蛋白冠的血清高丰度蛋白去除方法。
背景技术:
2.对血清中蛋白含量水平变化的检测可以反映出机体的健康状态、是否感染疾病以及给予药物后对机体的影响。血清蛋白的组成具有高度复杂性,而其中的高丰度蛋白严重影响了低丰度蛋白的检出,无法全面、系统、有效地反映机体的真实情况,这极大限制血清样品所提供的生物学信息。
3.目前研究表明,血清蛋白组成相当复杂(含量变化范围约10个数量级),主要由体内组织或感染微生物、寄生虫等分泌,血清蛋白组的变化反映了药物暴露、条件或疾病对机体的影响,这些血清蛋白也被称为蛋白质生物标志物。但是血清中的20种高丰度蛋白占有血清总蛋白99%以上的比重,包括白蛋白(50-55%)、免疫球蛋白、转铁蛋白、载脂蛋白等。而剩余的1%是由10000多种低丰度蛋白组成(含量大部分处于μg/l和ng/l水平),且不包括转录后修饰的蛋白。因此,血清蛋白组学是目前最复杂且最难分析的蛋白组学。目前,液相色谱-质谱联用技术(liquid chromatography-tandem mass spectrometry,lc-ms)是提高血清蛋白组学研究广度和深度的最常用手段。然而,在分析过程中所有血清蛋白的肽段碎片会根据自身性质随溶剂的极性梯度被洗脱进入仪器,被共洗脱的血清高丰度蛋白信号会严重影响低丰度蛋白信号的检测,最终导致血清蛋白鉴定个数不足以有效反映机体情况。因此,从血清样品中去除高丰度蛋白或富集低丰度蛋白是提高血清蛋白组学的广度和深度的最前端,也是最有效的手段。
4.蛋白冠(protein corona,pc)是由蛋白质和纳米颗粒(nanoparticles,nps)表面之间的氢键、静电力、溶剂力和范德华相互作用形成的。研究表明这个过程是具有一定无差别性的,可以在一定程度实现血清中高丰度蛋白的去除或者低丰度蛋白的富集。氧化铁纳米颗粒(iron oxide nanoparticles,ionps)是一种具有良好磁性和生物相容性的纳米材料,已在生物医学领域具有广泛的应用研究,可用于造影诊断、组织修复、光热治疗、药物载体等。ionps特有的磁性可以使其在形成pc后借助外加磁场进行分离,不仅避免了常规离心方法导致pc分离不纯的问题,而且利用相对温和的磁力可以避免因离心力导致蛋白团聚而造成的样品损失。
5.目前商品化的方法采用高丰度蛋白去除离心柱方法(品牌:thermo scientific;货号:a36369),其通过与2ml离心管配套使用,将10ul血清样品负载于离心柱上,用不同溶剂配合离心机实现高丰度蛋白的去除。现有商品化的高丰度蛋白去除离心柱的主要缺点如下:
6.1)成本高:商品化离心柱套装目前有2种规格,2802元/6根和8477元/24根,最便宜的一根高于350元(处理一个血清样品),对大批量样品进行处理成本过高;
7.2)存在样品损失:离心和过柱子方法可能会造成部分蛋白变性团聚,在蛋白重悬
和酶解过程种可能无法进行高效的碎片化,造成样品损失。
技术实现要素:
8.针对现有技术中存在的问题,本发明的目的在于提供一种基于蛋白冠的血清高丰度蛋白去除方法。本发明结合pc和lc-ms技术有效的实现血清中高丰度蛋白的去除和低丰度蛋白的富集,从血清样品中鉴定到更多种类的蛋白,进而提高血清蛋白组学的广度和深度。
9.本发明的技术方案为:
10.一种基于蛋白冠的血清高丰度蛋白去除方法,其步骤包括:
11.1)制备氧化铁纳米颗粒ionps,并将所制备ionps用超纯水定容,得到ionps储备液;
12.2)将提取的血清稀释后加入所述ionps储备液,于室温条件下震荡孵育,使ionps表面吸附血清蛋白,形成蛋白冠pc;
13.3)对步骤2)所得溶液进行磁分离,使pc从溶液中分离,去除溶液管中的溶液;
14.4)清洗pc,以去除溶液管中吸附不稳定的pc和管壁上残留的血清蛋白;
15.5)对步骤4)清洗后的pc上的蛋白进行蛋白酶切;
16.6)洗脱酶切后的肽段;
17.7)对步骤6)所得的肽段溶液样品进行样品脱盐、样品转移,得到去除高丰度蛋白的血清肽段样品。
18.进一步的,制备所述ionps的方法为:
19.11)将1g fecl3·
6h2o与2g无水醋酸钠溶解于30ml乙二醇中,50℃水浴磁力搅拌至试剂完全溶解;
20.12)在步骤11)的溶液中加入6.5ml 1,6-己二胺,50℃下水浴磁力搅拌均匀;将所得均匀溶液转移至50ml聚四氟内衬不锈钢反应釜中,在高温干燥箱中反应6h;反应结束后自然冷却至室温;
21.13)将步骤12)所得ionps内核分别用超纯水和无水乙醇清洗多次,每次用强磁铁分离并用超声波清洗仪使ionps内核重新悬浮,清洗结束后用磁铁分离出ionps;
22.14)称取10mg的ionps,用50ml无水乙醇超声分散均匀;
23.15)在步骤14)的溶液中加入0.5ml浓度为4m的naoh溶液和0.5ml正硅酸乙酯;在超声条件下机械搅拌,实现ionps表面修饰。
24.进一步的,将所制备ionps分别用超纯水和无水乙醇清洗,每次清洗用强磁铁分离ionps并超声重新悬浮,清洗结束后将ionps用磁铁分离,用超纯水定容1ml得到ionps储备液。
25.进一步的,所述ionps储备液中ionps的浓度为9.5-10mg/ml。
26.进一步的,形成蛋白冠pc的方法为:取2μl血清至1.5ml低吸附离心管中,用0.01m的pbs溶液稀释100倍至200μl,加入10μl ionps储备液,于室温条件下600rpm震荡孵育1小时,形成蛋白冠pc。
27.进一步的,进行蛋白酶切的方法为:用200μl 0.01m的pbs复溶步骤4)清洗后的pc,加入3μl 200mm的二硫苏糖醇,于55℃下600rpm震荡孵育45min还原蛋白;加入3μl 400mm的
碘乙酰胺,于室温下避光静置30min进行烷基化;加入4μl 0.5μg/μl的胰酶溶液,室温下300rpm震荡孵育过夜,加入200ul 0.1%的三氟乙酸终止酶切。
28.进一步的,洗脱酶切后的肽段的方法为:利用200μl 0.1%的tfa清洗pc多次,每次磁吸6秒钟分离pc收集上清液并合并至低吸附离心管中,得到肽段溶液样品。
29.本发明的优点如下:
30.1)节约样品:与商品化柱子相比,单个样品的处理过程只需要2ul血清样品,可以大幅度节约血清样品用于其他生化分析;
31.2)节约成本:合成所需要的原材料价格低廉,经计算,合成1g产物的成本价格约为500元,处理一个血清样品所需要的ionps质量为0.1mg,单个样品的处理价格约为5元,可以在低成本条件下进行大批量样品的处理;
32.3)磁性分离:利用相对温和的磁力分离pc表面吸附的血清蛋白,与常规离心方法处理相比,既可以节约时间(从30min缩减到6s),又可以避免因离心力导致蛋白团聚而造成的样品损失,能够提供更丰富的血清蛋白组学信息。
33.因此,本发明可以在大幅度节约血清样品和经济成本的前提下,实现对大批量血清样品中高丰度蛋白的去除和低丰度蛋白的富集,显著提高血清蛋白组学的蛋白鉴定数量。同时使用相对温和的磁分离技术得到pc结构,可以避免因离心力导致蛋白团聚而造成的样品损失,能够提供更丰富的血清蛋白组学信息。
附图说明
34.图1为本发明的技术方案流程图。
35.图2为nano组和serum组的蛋白鉴定数及cv值;
36.(a)nano组和serum组的蛋白鉴定数,(b)nano组和serum组的cv值。
37.图3为nano组和serum组鉴定到蛋白的丰度信息。
38.图4为本技术路线富集和去除的蛋白丰度分布信息。
具体实施方式
39.下面结合附图对本发明进行进一步详细描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
40.本发明提供了一种结合pc和lc-ms技术对血清蛋白组学进行信息挖掘的技术路线,可以实现血清中高丰度蛋白的去除以及低丰度蛋白的检出。具体技术方案流程如图1:
41.1.ionps合成:将1g fecl3·
6h2o与2g无水醋酸钠溶解于30ml乙二醇中,50℃水浴磁力搅拌10min至试剂完全溶解,此时溶液为棕黄色悬浊液;加入6.5ml 1,6-己二胺,溶液迅速变为棕红色透明液体,继续维持50℃下水浴磁力搅拌10min;将所得的均匀溶液转移至50ml聚四氟内衬不锈钢反应釜中,在高温干燥箱中198℃下反应6h;反应结束后自然冷却至室温,产物ionps内核分别用超纯水和无水乙醇清洗三次,每次用强磁铁分离并用超声波清洗仪使其重新悬浮,清洗结束后用磁铁分离,于低温冷冻干燥机中冻干成粉末后密封保存备用。称取10mg ionps内核,用50ml无水乙醇超声分散均匀;使用注射泵逐滴加入0.5ml浓度为4m的naoh溶液和0.5ml正硅酸乙酯;在超声条件下机械搅拌2小时,实现ionps的表面修饰,经过条件实验测试对比,本操作流程所得到的最终产物具有最佳的水溶性。将所得到的
产物ionps分别用超纯水和无水乙醇清洗三次,每次用强磁铁分离产物并超声重新悬浮,清洗结束后将产物用磁铁分离,用超纯水定容1ml保存备用,储备液中ionps的浓度为9.5-10mg/ml。
42.2.血清提取:新鲜提取的大鼠血液,于室温静置4小时至出现明显分层,使用离心机在4000rpm条件下离心10min获得血清样品,样品分装后冷冻备用,可置于-80℃冰箱备用。
43.3.pc形成:血清样品于4℃冰箱解冻后,取2μl血清至1.5ml低吸附离心管中,用0.01m的pbs(即0.01摩尔的pbs)溶液稀释100倍至200μl,加入10μl ionps储备液,于室温条件下600rpm震荡孵育1小时,本条件能使ionps表面充分吸附血清蛋白,形成pc结构。
44.4.磁分离pc:孵育结束形成pc后,将低吸附离心管置于dynamag
tm-2magnet磁吸架上6秒钟,使pc从溶液中分离,吸去溶液。
45.5.清洗pc:用200μl 0.01m的pbs溶液清洗pc三次,每次磁吸6秒钟收集pc,弃置管内pbs溶液,以去除吸附不稳定的蛋白和管壁上残留的血清蛋白;蛋白冠结构上存在稳定吸附的和不稳定吸附的蛋白,不稳定吸附的蛋白会影响检测的可重复性,磁吸过程是保留ionps形成pc上稳定吸附的蛋白,因此本操作可以显著减少实验误差,提高可重复性。
46.6.蛋白酶切pc上的蛋白:用200μl 0.01m的pbs复溶步骤5中磁分离的pc,加入3μl 200mm的二硫苏糖醇(dtt),于55℃下600rpm震荡孵育45min还原蛋白;加入3μl 400mm的碘乙酰胺(iaa),于室温下避光静置30min进行烷基化;加入4μl 0.5μg/μl的胰酶溶液,室温下300rpm震荡孵育过夜,加入200ul 0.1%的三氟乙酸(tfa)终止酶切,得到ionps和酶切后的肽段。
47.7.洗脱酶切后的肽段,得到肽段溶液:200μl 0.1%的tfa清洗pc三次,每次磁吸6秒钟分离ionps收集上清液液中的肽段并合并至1.5ml低吸附离心管中,共三份平行样品标记为nano组。
48.8.非pc肽段样品制备:取2μl血清至1.5ml低吸附离心管中,用0.01m的pbs溶液稀释100倍至200μl,于室温条件下600rpm震荡孵育1小时,加入3μl 200mm的dtt,于55℃下600rpm震荡孵育45min还原蛋白;加入3μl 400mm的iaa,于室温下避光静置30min进行烷基化;加入4μl 0.5μg/μl的胰酶溶液,室温下300rpm震荡孵育过夜,加入200ul 0.1%的tfa终止酶切,共三份平行样品标记为serum组。
49.对步骤7、8所得样品分别进行步骤9~10的处理:
50.9.样品脱盐:用2ml乙腈活化waters hlb c18固相萃取柱,用4ml 0.1%的tfa平衡柱子,将样品反复过柱子3次充分吸附肽段,用2ml 0.1%的tfa脱盐4次,最后用1ml含0.1%tfa的70%乙腈将肽段洗脱至1.5ml低吸附离心管中。
51.10.样品转移:将收集了肽段溶液的1.5ml低吸附离心管置于旋转蒸发仪中,30℃下真空旋转干燥,样品用50μl 0.1%甲酸水1%乙腈溶液复溶,于20000rpm下高速离心1h,取上清20μl至专用进样瓶。
52.11.ms进样:液相型号为ultimate 3000rslc,流动相a为0.1%甲酸水,流动相b为0.1%甲酸水80%乙腈溶液,流速为300nl/min,梯度为95min;质谱型号为orbitrap fusion lumos,数据采集模式为数据依赖性采集(data-dependent acquisition,dda)的二级质谱分析。
53.12.数据分析:对采集的数据文件进行蛋白鉴定分析和生物信息学分析,对nano组和serum组所得到的结果进行比对,得到的结果如下。
54.图2(a)中显示nano组中共鉴定到1070个蛋白,而serum组只鉴定到573个蛋白,其中的507个蛋白被共同鉴定到,有563个蛋白是nano组特有的,仅有66个蛋白是serum组特有的。通过变异系数(coefficient variation,cv)对所鉴定到全部蛋白图2(b)左和共同蛋白图2(b)右在各组内三份平行样中的重复性进行分析,结果均显示nano组中蛋白鉴定的重复性得到了显著提高。
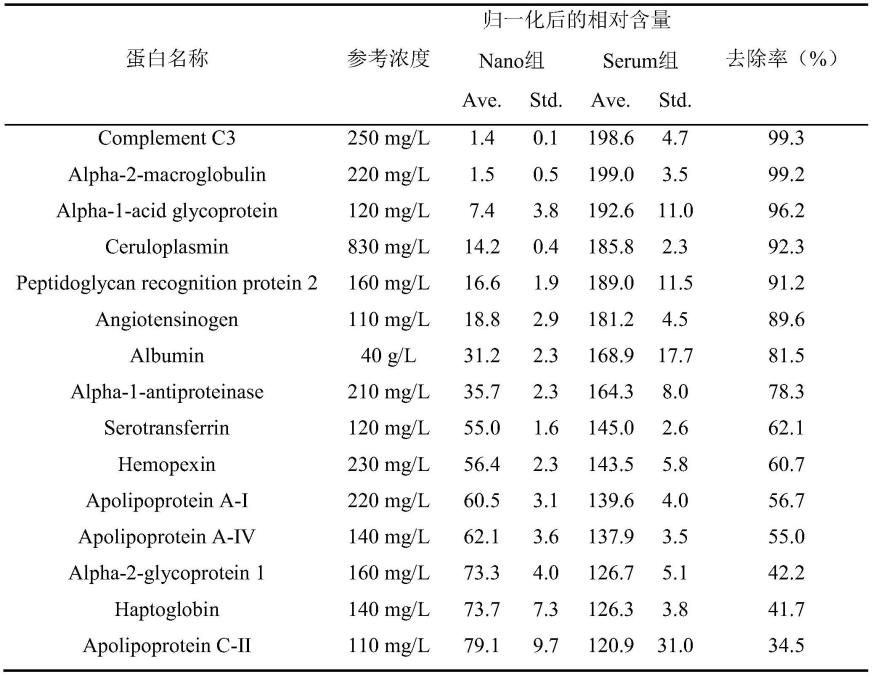
55.为了得到nano组和serum组鉴定到蛋白的丰度信息,我们根据人类蛋白质图谱项目的数据库数据(https://www.proteinatlas.org/humanproteome/blood),分别对nano组和serum组样本中检测到蛋白的含量进行了分析。首先,我们列举了15种高丰度蛋白在nano组和serum组的检测相对含量信息(表1),结果显示本技术路线可以有效实现高丰度蛋白的去除。
56.表1为15种高丰度蛋白在nano组和serum组的检测相对含量信息。
[0057][0058]
进而对所鉴定到蛋白的丰度进行统计,发现在nano组中分别有147个mg/l、342个μg/l和175个ng/l级别的蛋白(406个蛋白无含量信息),在serum组中分别有138个mg/l、202个μg/l和46个ng/l级别的蛋白(187个蛋白无含量信息),nano组的低丰度蛋白(μg/l和ng/l)数量显著提高。以上结果表明本技术路线可以有效实现高丰度蛋白的去除,并显著提高低丰度蛋白的检出。
[0059]
进而对本技术路线所鉴定到蛋白的富集和去除情况进行分析,以nano组和serum组蛋白相对含量比值》2定义为蛋白被富集,以nano组和serum组蛋白相对含量比值《0.5定
义为蛋白被去除。由图4可见,本技术路线对血清中的大部分高丰度蛋白都有显著的去除效果,同时对大部分低丰度蛋白都具有显著的富集能力。
[0060]
尽管为说明目的公开了本发明的具体实施例,其目的在于帮助理解本发明的内容并据以实施,本领域的技术人员可以理解:在不脱离本发明及所附的权利要求的精神和范围内,各种替换、变化和修改都是可能的。因此,本发明不应局限于最佳实施例所公开的内容,本发明要求保护的范围以权利要求书界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1