v-ATPase作为早期阿尔兹海默症生物标志物
v-atpase作为早期阿尔兹海默症生物标志物
技术领域
1.本发明涉及早期阿尔兹海默症的诊断领域,尤其涉及v-atpase作为早期阿尔兹海默症生物标志物中的应用。
背景技术:
2.阿尔茨海默病(alzheimer' s disease,ad)是一种与年龄相关的进行性神经系统变性疾病。ad的核心症状是记忆障碍伴有其他认知域的损害,并对正常生活、工作造成影响。ad起病隐蔽、病程呈不可逆发展,致残率高,因此,早期诊治对提高 ad病患生存率、尤其对提高其生存质量意义重大
1.。
3.目前检测早期ad经典生物标志物有β淀粉样蛋白42(amyloidβ-protein 42,aβ
42
),总tau(t-tau)和磷酸化tau(p-tau),以及新发现的神经颗粒蛋白及microrna。通常ad患者脑脊液(cerebro-spinal fluid, csf)中的t-tau 和 p-tau显著增加,aβ
42
显著减少
2.、ad患者csf神经颗粒蛋白显著增加
3.以及mir-100、mir-1274a和mir-146a在ad中具有显著差异表达
4.。现有的生物标志物不能满足临床需求,使得寻找早期ad生物标志物已迫在眉睫。
4.v-atpase:是一种依靠水解atp提供能量来转移质子的多亚基复合物,主要分布于真核细胞内多种细胞器的内膜系统上,在人体的肾,脑,睾丸,内耳,骨骼,皮肤等器官有广泛表达。v-atpase全酶是由两个亚单位v0和v1构成的多亚基聚合体,v0是含5种亚基(a、d、e、c、c”)的跨膜蛋白,v1位于细胞质,包括8种亚基(a、b、c、d、e、f、g、h)
5.。atp6v1a
6.和atp6v0a1的突变
7.会导致v-atpase不能行使功能,导致溶酶体酸化失败,从而引起自噬小体和自噬溶酶体在脑内大量堆积,引起认知障碍。
5.app/ps1小鼠:可表达突变的人类早老素(deltae9)和人鼠淀粉样前体蛋白(appswe)融合体,app/ps1(ad)双转基因小鼠这两个基因的表达都由小鼠朊病毒蛋白启动子启动。人类早老素基因的deltae9突变是该基因的第九个外显子缺失产生的,此突变会导致早发性老年痴呆症。对小鼠脑蛋白匀浆进行免疫检测发现,人类早老素蛋白高水平地替代了可检测到的小鼠内源性蛋白。并且,在app/ps1(ad)双转基因的小鼠脑匀浆中还检测到人源淀粉样前体蛋白。据报道,该双转基因模型鼠在7月龄大脑可见老年斑,随着月龄增加,大脑皮层老年斑数量体积明显增加,9-12月龄小鼠大脑出现与ad患者相似的老年斑
8.。
技术实现要素:
6.为了弥补现有技术的不足,本发明的目的在于提供一种v-atpase作为诊断早期阿尔兹海默症生物标志物。
7.为了实现上述目的,本发明采用如下技术方案:本发明提供了检测尿液v-atpase水平的试剂在制备诊断早期阿尔兹海默症的试剂或试剂盒中的应用。
8.作为本发明的一个优选例,所述的检测尿液v-atpase水平的试剂为elisa试剂。
9.采用上述技术方案的有益效果是:
1.本发明通过水迷宫证实4月龄app/ps1小鼠未出现学习记忆障碍;硫磺素-s染色表明4月龄app/ps1小鼠未出现aβ斑块。说明小鼠还未出现ad的表征。
10.2.本发明通过检测4月龄小鼠尿液中v-atpase含量,与wt型小鼠相比,app/ps1小鼠尿液中v-atpase的含量增加。蛋白免疫印迹(wb)实验检测到4月龄app/ps1小鼠海马部位的atp6v1a、atp6v0a1表达水平降低。
11.3.本发明4月龄app/ps1小鼠在淀粉样斑块及学习记忆障碍出现之前,app/ps1小鼠已经出现了v-atpase变化。证实v-atpase可作为早期阿尔兹海默症的生物标志物。
12.4.本发明采用尿液检测是无创的,优于传统的脑脊液和血液检测。
附图说明
13.图1为4月龄app/ps1小鼠的学习记忆能力。(a)4月龄app/ps1 小鼠第1-4天平均逃避潜伏期。(b)4月龄app/ps1小鼠第5天空间探索轨迹图。
14.图2为4月龄app/ps1及wt小鼠海马部位的老年斑沉积。(40
×
,标尺=200μm)
15.图3为app/ps1小鼠尿液中v-atpase的含量。(n=6, app/ps1 vs wt,*p《0.01)。图4为4月龄app/ps1小鼠海马v-atpase亚基的表达水平。(a) atp6v0a1,atp6v1a的代表性条带。(b和c)atp6v0a1,atp6v1a的 蛋白表达水平的定量统计。(n=6,app/ps1 vs wt,*p《0.05)。
具体实施方式
16.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
17.(一)实施方法:(1)动物分组4月龄雄性app/ps1小鼠9只,野生型小鼠9只(spf级),体重(22
±
5g)。所有实验动物均饲养于spf级动物房,环境安静,相对恒定室温(22
±
1℃)和湿度(55%
±
5%),动物自由饮食饮水。实验前适应性喂养2周。水迷宫后直接进行取材;(2)水迷宫实验4月龄app/ps1小鼠行morris水迷宫检测小鼠记忆能力,装置主要由隐藏平台、直径120cm,高度50cm的白色圆盆、自动记录分析系统组成。利用自动分析系统将水盆分为四个象限,隐藏平台始终固定在第一象限或者第三象限,隐藏平台直径60 cm,高29cm,实验执行过程中该平台始终淹没在水下1cm;为期5天迷宫实验分为两个步骤完成:前1-4天为定位航行测试,该步骤中所有小鼠每天均被训练3次,全部训练结束后,记录小鼠在60s内找到隐藏平台的时间,即逃避潜伏期,如果小鼠在规定时间内未找到,引导小鼠找到隐藏平台,并让其停留20s后结束;第5天空间探索测试中,撤掉水池中隐藏平台,小鼠只执行一次下水任务并记录60s内的轨迹,目标现象停留时间;最后根据系统记录的相应指标,进行数据处理,
统计分析;(3)取材及标本制备行为学实验结束后,每组随机选取3只小鼠,利用戊巴比妥钠(50 mg/kg)腹腔注射麻醉后打开胸腔暴露心脏,0.01 m 磷酸盐缓冲液(phosphate belanced solution,pbs)从心尖位置缓慢地被注入洗净血液后,用预冷的4%的多聚甲醛灌注固定至小鼠头颈部位僵硬,四肢发白后终止灌流,断头取脑,将完整大脑用4%的多聚甲醛溶液固定,48 h后,用30%蔗糖溶液脱水;剩余小鼠麻醉后迅速取脑于冰盒上分离出海马组织装于ep管中标记并置于-80 ℃低温冰箱保存,用于后续相关指标检测;(4)硫磺素-s染色利用硫磺素-s染色观察小鼠海马老年斑沉积。4%多聚甲醛固定48 h后的大脑用30%蔗糖溶液脱水3天后,在冰冻切片机上连续切片(切片厚度30
µ
m,包含完整的海马结构)。用载玻片将切片贴好,切片37℃复温20 min,pbs溶液漂洗2次/5 min,取100
µ
l1%硫磺素-s覆盖住组织,避光染20 min,pbs漂洗3次/5 min,70%的乙醇洗脱10 min,pbs洗3次,每次5 min,滤纸轻轻擦掉组织旁边水分,用正置显微镜4
×
观察老年斑,每只小鼠分别选取相同冠状切面的3张脑片拍摄并使用image-pro plus软件对海马区域老年斑进行统计;(5)elisa检测尿液中v-atpase含量收集小鼠尿液,1000xg离心20min,取上清进行后续检测;elisa试剂盒购至上海江莱生物科技有限公司。具体检测步骤如下:江莱生物小鼠v-atp酶试剂盒室温平衡60min, 标准品孔加不同浓度的标准品50
µ
l,样本孔加待测样本50
µ
l, 空白孔加样本稀释液50
µ
l
→
每孔加入辣根过氧化物酶(hrp)标记的检测抗体100
µ
l, 封孔,37℃温育60min
→
弃去液体,拍干,加满洗涤液反复洗涤拍干5次,加入底物a,b各50
µ
l,37℃避光敷育15min,每孔加50
µ
l,15min内,450nm下测定各孔的od值;(6)蛋白免疫印迹(western blot, wb)实验1)海马组织蛋白的提取:取海马50mg,加入300μl裂解液(ripa:pmsf:蛋白磷酸酶抑制剂混合物=100:1:1),冰上裂解30min后,4℃离心(12000rpm, 10min),收集上清;2)二喹啉甲酸(bicinchoninic acid, bca)法测定蛋白浓度:(a)将5mg/ml的蛋白标准品用pbs稀释成0.5mg/ml的标准品备用;(b)按每孔200
µ
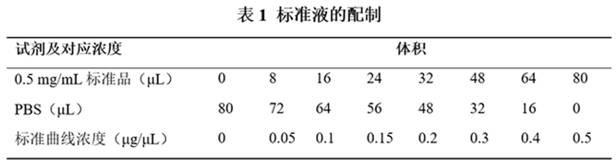
l的体积配制bca工作液(a液: b液=50:1),现配现用;(c)配制比例标准液,如表1;(d)将之前收集的蛋白样本按每孔20
µ
l的体积用pbs稀释30倍,每个样本设置3个复孔;(e)将配制好的标准品和样本稀释液分别按20
µ
l/孔加入96孔板中,然后再每孔加
入200
µ
l bca工作液,37℃烘箱孵育30min,酶标仪上562nm处测量吸光度od值;(f)拟合出标准曲线,并根据标准曲线计算样本浓度;3)变性:用pbs将蛋白浓度统一稀释到最大浓度,一般为30
ꢀµ
g/10ul,加5
×
蛋白上样缓冲液混匀,100℃高温变性10min,-20℃保存备用;4)配胶:根据目的蛋白分子量的不同,配制不同浓度的分离胶;具体配胶方案如表2:5)电泳:蛋白样品充分混匀,上样体积为marker:1.5
µ
l,样本:10
µ
l;6)电转:甲醇活化pvdf膜,1
×
快转液泡滤纸。电转仪最下层铺上一层滤纸,然后铺pvdf膜,小心放上电泳后的凝胶,凝胶上面再铺一层滤纸,即可进行电转。电转完成后,弃去凝胶,取出pvdf膜,于tbst中洗5min
×
1次;7)封闭:以5%脱脂牛奶摇床振荡室温封闭2.5h,tbst洗10min
×
3次;8)切膜:依据marker所提示不同蛋白分子量的位置,分别切下目的蛋白以及内参的条带;9)一抗敷育:4℃孵育17h;一抗稀释比例:atp6v1a 抗体(1:2000),atp6v0a1 抗体(1:2000),tbst洗10 min
×
3次;10)二抗敷育:4℃孵育40min,二抗稀释比例:1:5000,tbst洗10 min
×
3次;11)曝光:等体积的ecl工作液a与b混合,化学发光成像系统分析目标条带及其内参;12)数据统计:采用image lab对条带进行定量分析。
18.(7)数据分析所有实验数据均采用spss22.0统计分析软件,数据以均数
±
标准差(
±
sd)表示,水迷宫实验数据采用重复测量方差分析方法,如p》0.05,则采用球型检验分析;如p《0.05,则使用greenhouse-geisser法进行校正分析。各组间不同时间点的分析采用多元方差分析,事后原则同单因素方差分析;单因素方差分析用于其他各指标间的两两比较,方差齐用lsd检验,方差不齐用dunnett’s t3检验,p《0.05有统计学意义。
19.(二)结果(1)水迷宫实验为了检测app/ps1小鼠早期是否开始出现学习记忆障碍,采用morris水迷宫实验
检测其空间学习记忆能力。结果表明两组小鼠随着每日训练,平均逃避潜伏期均日渐缩短,定向航行实验数据重复测量,mauchly’s球形检验p》0.05,说明服从球形假设。分组主效应无统计学差异,说明app/ps1对照组小鼠的平均潜伏期与wt对照组小鼠无明显差异,且时间和分组的相互作用没有统计学差异,如图1中a所示。同时在第五天的空间探索实验中,两组小鼠的运动轨迹和穿越平台次数并无明显差异,如图1中b所示。说明4月龄app/ps1小鼠并未出现学习记忆障碍。
20.(2)硫磺素-s染色采用硫磺素-s染色观察早期app/ps1小鼠脑内达淀粉样斑块变化情况,如图2所示。结果显示,4月龄app/ps1小鼠与wt组相同,并未出现aβ斑块。
21.(3)elisa检测尿液中v-atpase含量通过elisa检测4月龄app/ps1小鼠尿液中v-atpase含量,结果显示,与wt型小鼠相比,app/ps1小鼠尿液中v-atpase的含量显著增加,如图3所示。
22.(4)蛋白免疫印迹(western blot, wb)实验采用western blot检测了4月龄app/ps1小鼠海马v-atp酶相关亚基的蛋白表达,结果显示,与同月龄野生型小鼠相比,4月龄app/ps1小鼠海马部位的atp6v1a、atp6v0a1表达水平降低,如图4所示。
23.参考文献[1]洪萍,王培昌,刘辰庚,张跃其.阿尔茨海默病患者生物标志物的研究进展[j].临床检验杂志,2014,32(07):522-524.doi:10.13602/j.cnki.jcls.2014.07.12.[2]blennow k, zetterberg h. the past and the future of alzheimer's disease fluid biomarkers. j alzheimers dis. 2018;62(3):1125-1140. doi:10.3233/jad-170773.[3]thorsell a, bjerke m, gobom j, et al. neurogranin in cerebrospinal fluid as a marker of synaptic degeneration in alzheimer's disease. brain res. 2010;1362:13-22. doi:10.1016/j.brainres.2010.09.073.[4]denk j, boelmans k, siegismund c, lassner d, arlt s, jahn h. microrna profiling of csf reveals potential biomarkers to detect alzheimer`s disease. plos one. 2015;10(5):e0126423. published 2015 may 20. doi:10.1371/journal.pone.0126423.[5] abbas ym, wu d, bueler sa, robinson cv, rubinstein jl. structure of v-atpase from the mammalian brain. science. 2020;367(6483):1240-1246. doi:10.1126/science.aaz2924.[6] fassio a, esposito a, kato m, et al. de novo mutations of the atp6v1a gene cause developmental encephalopathy with epilepsy. brain. 2018;141(6):1703-1718. doi:10.1093/brain/awy092.[7] aoto k, kato m, akita t, et al. atp6v0a1 encoding the a1-subunit of the v0 domain of vacuolar h+-atpases is essential for brain development in humans and mice. nat commun. 2021;12(1):2107. published 2021 apr 8。
[0024]
[8]宗园媛,王晓映,王海林,刘亚莉,黄澜,马春梅,张连峰,秦川.app/ps双转基因
阿尔茨海默病小鼠模型的老年斑及行为学动态分析[j].中国比较医学杂志,2008(09):8-12+87-88。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1