一种基于AIEE+ESIPT联合荧光机制的细胞成像方法
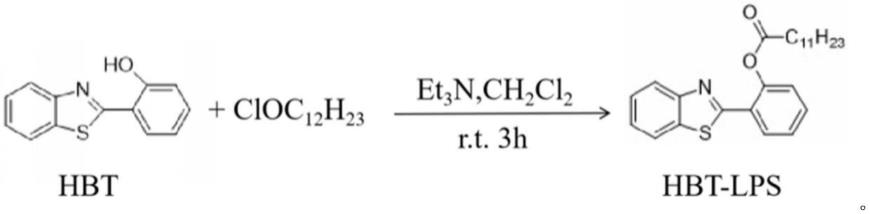
一种基于aiee+esipt联合荧光机制的细胞成像方法
技术领域
1.本发明属于分析化学领域,具体涉及一种基于激发态分子内质子转移(esipt)和聚集诱导增强发射(aiee)现象联合的荧光机制实现细胞成像的方法。
背景技术:
2.脂肪酶(三酰基甘油水解酶,e.c.3.1.1.3)是一类催化甘油三酯水解为甘油和游离脂肪酸的水解酶。胰脂肪酶是一种来自胰腺的重要外分泌酶,是早期诊断和监测急性胰腺炎(ap) 进展的重要生物标志,在脂肪消化或急性胰腺炎的诊断和监测中发挥着关键作用。由于酶(亲水)和底物(亲脂)的极性相反,脂肪酶反应发生在水相和油相的界面上。因此,开发一种方便、灵敏的脂肪酶响应荧光探针实现细胞成像对新型药物和医疗诊断设备的开发具有重要意义。
3.在各种酶活性分析技术中,由于脂肪酶具有复杂的多相催化特性,目前建立的在活细胞中分析脂肪酶活性的方法很少。以人胰脂肪酶为例,其活性位点被盖住,而盖是底物无法接触到的,仅在界面活性时,盖才能被打开。为了克服传统方法在细胞中繁琐、耗时和有创检测等障碍,荧光探针以其实时、无创、现场目测等固有优势受到广泛关注。在过去的几年里,shi课题组和zhen课题组开发了基于聚集诱导发射(aie)和形成自组装胶束的脂肪酶活探针(chem. sci.,2017,8,6188
–
6195;sensors andactuatorsb 238(2017)765
–
771;iscience 23,101294,july24,2020)。上述技术的缺点是在分离有机层的两相体系(正己烷/pbs)中进行荧光测量,处理过程繁琐,两相体系也限制了这些探针在细胞和组织中的应用,以及胶束切割过程也未在细胞中得到证实。
4.近年来,通过控制非辐射过程,聚集有机分子的排放得到了增强。这种现象被称为聚集诱导增强发射(aiee)。由于其有趣的特性和广泛的应用领域,越来越多的新型发射颜色覆盖整个可见光谱区域的aiee系统被开发出来。在某些具有激发态分子内质子转移(esipt)荧光团中也观察到aiee,这是由于分子内质子转移和一个烯醇形式新的结构的形成,其中限制分子内运动发挥了重要作用。
技术实现要素:
5.本发明的目的是提供一种简单实用的基于“aiee+esipt”联合荧光机制的细胞成像的方法。该方法基于具有激发态分子内质子转移(esipt)荧光团2-(2-羟基苯基)苯并噻唑(hbt)的脂肪酶响应荧光探针(hbt-lps)构建一个具有良好的生物相容性和低细胞毒性的染色系统,有望在活体应用中用于生物医学传感器。
6.为实现上述发明目的,本发明采用如下的技术方案:
7.一种基于“aiee+esipt”联合荧光机制的细胞成像方法,包括如下步骤:
8.(1)构建荧光探针(hbt-lps),所述荧光探针具有如下式所示的结构式:
[0009][0010]
(2)将待成像细胞、脂肪酶和所述荧光探针孵育后进行荧光成像。
[0011]
优选的,步骤(1)包括:将hbt、et3n和ch2cl2与十二烷基酰氯在无水条件下反应即得。
[0012]
优选的,所述的反应是在n2保护下进行的。
[0013]
优选的,所述反应的温度为室温。
[0014]
优选的,所述反应的时间为3h。
[0015]
优选的,所述的制备方法还包括后处理的步骤。
[0016]
优选的,所述的后处理包括:用水洗涤反应混合物,萃取,有机层结合,干燥,并在减压下浓缩得到粗产品,最后粗产品经重结晶纯化即得。
[0017]
优选的,步骤(1)中2-(2-羟基苯基)苯并噻唑和十二烷基酰氯的摩尔比为1:1。
[0018]
优选的,步骤(2)所述的待成像细胞为hela细胞。更优选的,所述hela细胞是在含牛血清和抗生素的dmem培养基中培养获得的。优选的,所述的培养的温度为37℃,培养的湿度为5%co2。
[0019]
优选的,步骤(2)所述的脂肪酶为外源性胰脂肪酶。
[0020]
优选的,步骤(2)包括:将待成像细胞和脂肪酶孵育2h后,再加入所述荧光探针的溶液孵育30min。
[0021]
优选的,所述荧光探针的溶液的浓度为10μm。
[0022]
优选的,所述荧光探针的溶液的溶剂为dmso。
[0023]
本发明的有益效果在于:
[0024]
本发明所述的方法涉及一种基于具有激发态分子内质子转移(esipt)荧光团2-(2-羟基苯基)苯并噻唑(hbt)的脂肪酶响应荧光探针(hbt-lps),该荧光探针中可观察到聚集诱导增强发射(aiee)。与其他可用探针相比,这种聚集使探针(hbt-lps)成为一个有效的细胞染色系统。整个系统是在水中,使探针(hbt-lps)不像其他有机染料是在非水溶液中。处理后的细胞亮视野图像显示良好的细胞活力和形态,表明探针(hbt-lps)的生物相容性,可在活体应用中用于生物医学传感器。
附图说明
[0025]
图1为mtt法测定不同浓度(0.1μm、10μm、20μm、30μm、50μm、75μm、100μm)的探针hbt-lps孵育24h后对hela细胞的细胞毒性结果图。
[0026]
图2为a:hela细胞在37℃条件下无探针hbt-lps孵育30min的成像效果;b:hela细胞在 37℃条件下有探针hbt-lps孵育30分钟的成像效果;c:hela细胞经外源性胰脂肪酶预处理 2h后,在37℃下与探针hbt-lps孵育30min的成像效果;d:hela细胞经抑制剂槲皮素
(50μm) 预处理2h,再经外源性胰脂肪酶处理2h,然后与探针hbt-lps在37℃下孵育30min的成像效果。
具体实施方式
[0027]
实施例1
[0028]
(1)探针hbt-lps的制备:
[0029]
制备反应方程式为:
[0030][0031]
将2-(2-羟基苯基)苯并噻唑(hbt)(100mg,0.44mmol)、et3n(1.5eq)和ch2cl2(5ml) 的混合物加入装有搅拌棒的100ml烧瓶中。然后在室温下缓慢加入月桂酰氯(106mg,0.48 mmol)反应3h。然后,用水洗涤反应混合物,用ch2cl2萃取。将有机层结合,用无水na2so4干燥,减压浓缩得到产物。产物经重结晶(ch2cl2:己烷=1:2)纯化得到荧光探针hbt-lps。
[0032]
(2)细胞培养:
[0033]
将hela细胞放入含10%胎牛血清和抗生素(100u/ml青霉素和100μg/ml链霉素)的 dmem培养基中,在5%co2湿度37℃的培养箱中培养。
[0034]
(3)细胞毒性验证:
[0035]
采用mtt法检测探针hbt-lps对细胞hela的细胞毒性。首先,将hela细胞装入96 孔培养板,培养24h后,用不同浓度(0.1~100μm)的探针培养细胞,再培养24h。然后在每孔中加入10μl mtt,与细胞充分反应。对照组在相同条件下,dmem+10%胎牛血清培养,不添加探针。如图1所示,随着探针浓度的增加细胞存活率有所下降,但整体细胞存活率在 80%以上,说明探针具有低细胞毒性,可用于细胞成像。
[0036]
(4)共聚焦细胞成像:
[0037]
首先将探针溶解在5mm的dmso中,再将hela细胞置于玻璃盖上,使其粘附12h。成像对照组,hela细胞不加或加10μm探针hbt-lps溶液在37℃条件下孵育30min;外源性胰脂肪酶成像时,hela细胞先加脂肪酶孵育2h,再加10μm探针hbt-lps溶液在37℃条件下孵育30min;抑制组成像时,hela细胞与槲皮素(50μm)孵育2h,外源性脂肪酶孵育2h,再与探针hbt-lps孵育30min,孵育温度均为37℃。然后在共聚焦显微镜下进行荧光成像,如图2所示,探针在细胞中无荧光,当加入外源性胰脂肪酶后出现明显的蓝色荧光,表示胰脂肪酶响应探针hbt-lps后释放esipt荧光团hbt,在细胞中产生聚集荧光,并展现出良好的细胞活力和形态;在加入脂肪酶抑制剂懈皮素后,细胞荧光明显减弱,更一步证明了是外源性胰脂肪酶对探针起催化作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1