一种肾损伤分子(KIM-1)测定试剂盒及其检测方法与流程
一种肾损伤分子(kim-1)测定试剂盒及其检测方法
技术领域
1.本发明涉及免疫分析领域,具体涉及一种肾损伤分子(kim-1)测定试剂盒。
背景技术:
2.kim-1是一种1型跨膜蛋白,分子量为104kd,分为胞外区,跨膜区和胞内区。其胞外部分由一个含6个胱氨酸的类免疫球蛋白结构域,2个n糖基化位点和1个富含苏氨酸/ 丝氨酸和脯氨酸的结构域组成,具有典型的粘蛋白样o-糖基化蛋白特征。其胞内区很短,但至少含有1个酪氨酸磷酸化位点,可通过磷酸化酪氨酸残基进行信号转导。当发生肾损伤时,肾损伤分子l的细胞外域在金属基质蛋白酶的作用下可在跨膜区附近裂解为可溶性片段 (90kd)释放人细胞外,并排人尿中。
3.kim-1最初被发现是一种上皮细胞粘附因子,含有一个新的免疫球蛋白结构域,在正常情况下不表达,但在损伤后近端小管顶膜细胞中明显升高。由于肾损伤分子1(kim-1)只在损伤的肾小管上皮细胞中表达,很多研究结果都认为其可以成为一个敏感的肾损伤标记物。在小鼠实验中结果发现,无论是缺血性肾损伤还是药物毒性肾损伤,血清、尿中肾损伤分子 l(kim-1)的水平测定可作为早期肾脏损害的重要指标之一。而当肾损伤程度减轻或经干预治疗后,尿中肾损伤分子l水平则会下降。与此同时,肾损伤分子1(kim-1)还能对肾损伤的预后提供预测价值。
4.越来越多的研究已经在各种缺血、肾毒性和肾移植等所致急性肾损伤(acutekidneyinjury, aki)的动物模型中证实kim-1可以作为早期、无创和特异的aki诊断标志物。kim-1作为新的候选aki早期诊断标志物,有其优势:
①
敏感性高,其在正常组织不表达,aki发生时,其在近端小管上皮细胞的表达才显著上调,并一直持续到细胞完全康复;
②
特异性很高,特别是对缺血性或肾毒性aki特异性更高,在其他器官很少表达;
③
其胞外部分脱落进入尿液后性质比较稳定,容易检测;
④
极少受到慢性肾脏疾病和尿路感染的影响。
5.国内已申请专利的检测技术包括胶体金免疫层析法(公开号cn206772984u)、酶联免疫吸附(elisa)法(公开号cn104730250a)和化学发光免疫分析法(cn107942072a)。胶体金免疫层析法,操作简单,检测方面,但灵敏度、线性、重复性和定量准确性较差,目前更多运用于疾病初步筛查。elisa法技术成熟,检测费用较低,但灵敏度和线性范围较差,操作复杂,重复性较差;即便采用全自动酶免分析仪,检测速度仍然较慢,无法满足临床快速定量检测需求。化学发光免疫分析法灵敏度较高、特异性强、测定范围宽、操作简单,易于自动化,但需要专门的设备,成本较高。且现有的胶乳免疫透射比浊法(petia)对于kim-1 的检测来说其线性范围和灵敏度不能同时满足要求,需要进一步改进。
6.目前,虽然检测kim-1的方法多种,但还没有一种既能够降低操作难度、减少检测时间、控制检测成本,又能够提高检测灵敏度、线性、准确度和重复性,且适合生化分析仪的检测方法,如能建立该种方法,能够简便、快速、大批量且定量的进行样本检测,对于疾病的防治意义重大。
技术实现要素:
7.本发明的目的在于克服现有方法及技术的缺陷,提供灵敏度高、线型范围宽、重复性好的一种肾损伤分子(kim-1)测定试剂盒及其检测方法,线性可达80-5000pg/ml,可进行血尿同检,该试剂盒适用于各类型生化分析仪。本发明采用的是在胶乳微球上标记抗体,来检测抗原。
8.本发明的技术方案如下:
9.一种肾损伤分子(kim-1)测定试剂盒,包括试剂1、试剂2和校准品,所述试剂1由以下质量浓度的组分组成:
[0010][0011]
所述试剂2由以下质量浓度的组分组成:
[0012][0013]
所述校准品由以下质量浓度的组分组成:
[0014][0015]
所述试剂1、试剂2和校准品中的所述缓冲液各自独立的选自:磷酸盐缓冲液、3-[n-n
‑ꢀ
双(2-羟乙基)氨基]-2-羟基丙磺酸缓冲液、甘氨酸缓冲液、4-羟乙基哌嗪乙磺酸缓冲液、巴比妥缓冲液;
[0016]
所述试剂1中的所述表面活性剂选自:聚乙二醇8000、乙基苯基聚乙二醇、曲拉通x-100 中的任意一种或多种;
[0017]
所述试剂1、试剂2和校准品中的所述稳定剂各自独立的选自:牛血清白蛋白、蔗糖、海藻糖、卵清蛋白中的任意一种或多种;
[0018]
所述试剂1、试剂2和校准品中的所述防腐剂各自独立的选自:proclin300、叠氮钠、苯酚、庆大霉素、硫柳汞中的任意一种或多种。
[0019]
试剂1和校准品中的所述无机盐各自独立的选自:氯化镁、氯化钠、氯化钾、氯化钙、氯化铝中的任意一种或多种。
[0020]
优选地,试剂2中的肾损伤分子(kim-1)单抗胶乳微球可以按照以下方法制备得到:
[0021]
(1)取1ml粒径为0.06-0.10μm的cml胶乳微球,用4ml 25mm的mes缓冲液稀释,
[0022]
(2)将混合物离心至颗粒沉淀:12000rpm离心40分钟;
[0023]
(3)弃上清,用4ml 25mm的mes缓冲液重新分散微球;
[0024]
(4)再次离心,弃上清;
[0025]
(5)将微球重新悬浮在4ml 25mm的mes缓冲液中,确保微球完全悬浮,获得胶乳悬浮液;
[0026]
上述mes缓冲液的ph值为6.0;
[0027]
(6)在上述制备的胶乳悬浮液中加入1mg edc混匀活化20分钟;
[0028]
(7)12000rpm离心40min弃去上清,使用30mm 4-羟乙基哌嗪乙磺酸缓冲液重悬胶乳微球,获得的胶乳微球液体;4-羟乙基哌嗪乙磺酸缓冲液的ph值为7.4;
[0029]
(8)加入2g鼠抗人肾损伤分子单克隆抗体于步骤(7)获得的胶乳微球液体中,37℃孵育3小时;
[0030]
(9)加入1ml封闭剂将胶乳微球重悬,37℃混匀1小时;所述试剂2中的封闭剂选自牛血清白蛋白和fab抗体的液体混合物;
[0031]
(10)12000rpm离心50min,沉淀重悬于分散液,混匀,包被肾损伤分子(kim-1)抗体的胶乳微球4℃备用,即获得了kim-1单抗胶乳微球。
[0032]
优选地,试剂2中分散液为含有缓冲液、稳定剂、防腐剂的溶液。
[0033]
优选地,校准品中的kim-1抗原为重组人kim-1蛋白。
[0034]
本发明还提供一种使用本发明肾损伤分子(kim-1)测定试剂盒的检测方法,测定参数和方法如下表1所示:
[0035]
表1:试剂1和试剂2的测定参数和方法
[0036][0037]
以校准品浓度为横坐标,相应的吸光度变化
△
a为纵坐标,采用非线性拟合(spline)绘制出标准曲线。将未知肾损伤分子(kim-1)含量的待测样本测得的吸光度变化
△
a代入标准曲线,即可获得样品中肾损伤分子(kim-1)的含量。
[0038]
优选地,所述加入试剂1与试剂2的体积比为3:1。所述试剂2中分散液为含缓冲液、稳定剂、防腐剂的溶液。
[0039]
与现有技术相比,本发明的有益效果为:
[0040]
本发明试剂盒基于胶乳免疫透射比浊法(petia),其原理是采用化学偶联法将特
异性抗体结合于一定粒径的胶乳微球表面,当交联有抗体的微球与抗原结合后,短时间内迅速聚集在一起,从而改变反应液的吸光度。根据吸光度增加量,即可在波长600nm处测定免疫复合物浊度,定量检测血清中的肾损伤分子(kim-1)含量。petia检测方法是在均相反应体系中进行抗原、抗体反应及结果的测定。抗原、抗体反应后,直接测定反应液的吸光度值,省却了elisa法反复孵育和洗板等繁琐操作步骤,几分钟就能获得结果,省时省力。在本发明给定的配方范围内能够获得血尿同检的kim-1试剂盒。
[0041]
本发明试剂盒应用petia基础原理,使用小粒径的羧酸盐改性(cml)胶乳颗粒偶联抗体,cml胶乳颗粒由含聚合物的羧酸共聚物生成,具有一个高度荷电、相对亲水或有些“毛茸茸”的表面层,且具有电空间稳定性,解决了小粒径的乳胶粒子灵敏度差问题,保证试剂重复性和线性,利于血尿高精度和高准确性的检测kim-1。其中偶联过程使用混合封闭剂,使其牢固结合在反应基团上,减少非特异性结合,提高偶联效率。试剂盒可在具备有400-800nm 波长的全自动生化分析仪上检测血液中肾损伤分子(kim-1)的含量,无需复溶配制,开瓶即可直接上机使用,快速精准,自动化程度高,大大提高工作效率,能实现快速10min左右检测。且检测样本量少(20μl),可进行少量样本和急诊样本的测定。所述试剂盒及其检测方法,重复性cv<5%、检测限不大于80pg/ml,空白限不超过50pg/ml,线性相关系数 r=0.9999。
附图说明
[0042]
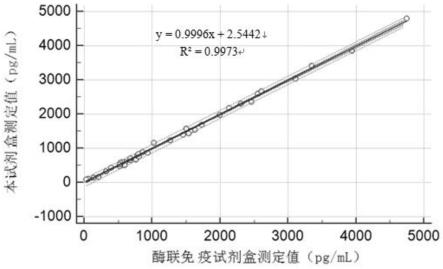
图1为本发明的试剂盒与酶联免疫吸附法测定试剂盒的相关性结果图。
具体实施方式
[0043]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,详细说明本发明的技术方案。
[0044]
实施例:
[0045]
实施例1:肾损伤分子(kim-1)测定试剂盒1的制备
[0046]
1.试剂1(r1)为:
[0047]
缓冲液:磷酸盐缓冲液50mmol/l(ph值7.40)
[0048][0049]
2.试剂2(r2)为:
[0050][0051]
3.校准品为:
[0052]
缓冲液:磷酸盐缓冲液 50mmol/l(ph值7.40)
[0053]
无机盐:氯化钠20g/l
[0054]
稳定剂:牛血清白蛋白20g/l
[0055]
kim-1抗原:重组人kim-1蛋白1g/l,4g/l,12g/l,40g/l,100g/l
[0056]
防腐剂:proclin300、叠氮钠、苯酚、庆大霉素、硫柳汞中的至少一种1g/l;
[0057]
kim-1单抗胶乳微球的制备方法如下:
[0058]
(1)取1ml粒径0.06μmcml胶乳微球,用4ml25mm的mes缓冲液(ph6.0)稀释。
[0059]
(2)将混合物离心至胶乳微球沉淀:12000rpm离心40分钟。
[0060]
(3)弃上清,用4ml25mm的mes缓冲液(ph6.0)重新分散微球。
[0061]
(4)再次离心,弃上清。
[0062]
(5)将微球重新悬浮在4ml25mm的mes缓冲液(ph6.0)中,确保微球完全悬浮。
[0063]
(6)在上述制备的胶乳悬浮液中加入1mgedc混匀活化20分钟。
[0064]
(7)12000rpm离心40min弃去上清,使用30mm4-羟乙基哌嗪乙磺酸缓冲液(ph7.4)重悬胶乳微球。
[0065]
(8)加入2g鼠抗人肾损伤分子(kim-1)单克隆抗体于胶乳微球液体中,37℃孵育3小时。
[0066]
(9)加入1ml封闭剂将胶乳微球重悬,37℃混匀1小时。封闭剂为150g/l牛血清白蛋白和5g/lfab抗体混合物。
[0067]
(10)12000rpm离心50min,沉淀重悬于分散液,混匀,包被肾损伤分子(kim-1)抗体的胶乳微球4℃备用。
[0068]
试剂1和试剂2的配制方法为常规方法,即按照上述配方比例,分别将试剂r1和试剂2所述的各组分加入纯化水后各自混合搅匀即可。
[0069]
实施例2:肾损伤分子(kim-1)测定试剂盒的制备
[0070]
1.试剂1(r1)的制备与实施例1相同。
[0071]
2.试剂2(r2)为:
[0072][0073]
3.校准品的制备与实施例1相同。
[0074]
kim-1单抗胶乳微球的制备方法如下:
[0075]
(1)取1ml粒径0.07μm胶乳微球,用4ml25mm的mes缓冲液(ph6.0)稀释。
[0076]
(2)将混合物离心至胶乳微球沉淀:12000rpm离心40分钟。
[0077]
(3)弃上清,用4ml25mm的mes缓冲液(ph6.0)重新分散微球。
[0078]
(4)再次离心,弃上清。
[0079]
(5)将微球重新悬浮在4ml25mm的mes缓冲液(ph6.0)中,确保微球完全悬浮。
[0080]
(6)在上述制备的胶乳悬浮液中加入1mgedc混匀活化20分钟。
[0081]
(7)12000rpm离心40min弃去上清,使用30mm4-羟乙基哌嗪乙磺酸缓冲液(ph7.4)重悬胶乳微球。
[0082]
(8)加入2g鼠抗人肾损伤分子(kim-1)单克隆抗体于胶乳微球液体中,37℃孵育3 小时。
[0083]
(9)加入1ml封闭剂将胶乳微球重悬,37℃混匀1小时。封闭剂为150g/l牛血清白蛋白和5g/l fab抗体混合物。
[0084]
(10)12000rpm离心50min,沉淀重悬于分散液,混匀,包被肾损伤分子(kim-1)抗体的胶乳微球4℃备用。
[0085]
试剂1和试剂2的配制方法为常规方法,即按照上述配方比例,分别将试剂r1和试剂2 所述的各组分加入纯化水后各自混合搅匀即可。
[0086]
实施例2与实施例1的区别是,胶乳微球不同。
[0087]
实施例3:肾损伤分子(kim-1)测定试剂盒3的制备
[0088]
1.试剂1(r1)的制备与实施例1相同。
[0089]
2.试剂2(r2)为:
[0090][0091]
3.校准品的制备与实施例1相同。
[0092]
kim-1单抗胶乳微球的制备方法如下:
[0093]
(1)取1ml粒径0.06μm cml胶乳微球,用4ml 25mm的mes缓冲液(ph6.0) 稀释。
[0094]
(2)将混合物离心至胶乳微球沉淀:12000rpm离心40分钟。
[0095]
(3)弃上清,用4ml 25mm的mes缓冲液(ph6.0)重新分散微球。
[0096]
(4)再次离心,弃上清。
[0097]
(5)将微球重新悬浮在4ml 25mm的mes缓冲液(ph6.0)中,确保微球完全悬浮。
[0098]
(6)在上述制备的胶乳悬浮液中加入1mg edc混匀活化20分钟。
[0099]
(7)12000rpm离心40min弃去上清,使用30mm 4-羟乙基哌嗪乙磺酸缓冲液(ph7.4) 重悬胶乳微球。
[0100]
(8)加入2g鼠抗人肾损伤分子(kim-1)单克隆抗体于胶乳微球液体中,37℃孵育3 小时。
[0101]
(9)加入1ml封闭剂将胶乳微球重悬,37℃混匀1小时。封闭剂为150g/l牛血清白蛋白。
[0102]
(10)12000rpm离心50min,沉淀重悬于分散液,混匀,包被肾损伤分子(kim-1)抗体的胶乳微球4℃备用。
[0103]
试剂1和试剂2的配制方法为常规方法,即按照上述配方比例,分别将试剂r1和试剂2 所述的各组分加入纯化水后各自混合搅匀即可。
[0104]
实施例3与实施例1的区别是,胶乳微球偶联抗体过程中封闭剂不同。
[0105]
测试例:
[0106]
测试例1.检测试剂盒的用法
[0107]
以日立7180生化仪为例:校准样本(s)的制备过程是:首先加入试剂1180μl,随后
加入校准品20μl,混匀,孵育5分钟后,加入试剂260μl,混匀孵育30秒后,于600nm波长下检测各校准点的吸光度值a1,5min后,于600nm波长下检测各校准点吸光度值a2,计算吸光度差值
△
a=a2-a1,每管重复测定2次,将各校准品管2次测得的吸光值
△
a为纵坐标,对应的浓度为横坐标,制作“浓度-吸光度差值”校准曲线。空白样本(b)为加入试剂1180μl, 随后加入去离子水20μl,混匀,37℃恒温孵育5分钟后,加入试剂260μl,混匀,37℃恒温孵育30s后,于600nm波长下检测各校准点的吸光度值a1,5min后,于600nm波长下检测各校准点吸光度值a2,计算吸光度差值
△
a=a2-a1。待测样本(t)具体过程同校准样本的制备过程,此时不加校准品,加入待测样品,同法测定待测样本的吸光度差值,代入校准曲线,即可计算出待测样品中肾损伤分子(kim-1)的含量。
[0108]
测试例2.
[0109]
以实施例1制备的试剂盒为例,用日立7180全自动生化仪测试本发明的试剂盒的检测性能。
[0110]
(1)空白限
[0111]
以纯化水为空白样品,用试剂盒重复测试20次,计算20次测试结果的平均值(x)和标准差(sd),即为空白限。结果如下表2所示,可见空白限不超过50pg/ml,表明测试的灵敏度良好。
[0112]
表2:实施例1制备的试剂盒的检测空白限测试结果
[0113][0114]
(2)线性
[0115]
用稀释液等比稀释5000pg/mlkim-1样品,用实施例1制备的试剂盒测定稀释后的各样品,每个样品重复测定3次,求平均值,与理论浓度相比较,计算其相对偏差。结果如下表 3所示,可见试剂盒线性可达80-5000pg/ml,线性相关系数r=0.9999,表明线性宽,线性关系良好。
[0116]
表3:实施例1制备的试剂盒的检测线性测试结果
[0117][0118]
(3)重复性
[0119]
检测浓度为200pg/ml和1500pg/ml的kim-1样品用实施例1制备的试剂盒分别重复测试10次,计算平均值、标准差(sd)和变异系数(cv)。结果如下表4所示,可见重复性 cv<5%,重复性良好。
[0120]
表4:实施例1制备的试剂盒的检测重复性测试结果
[0121][0122]
(4)回收率
[0123]
将浓度为4500pg/ml左右的高浓度kim-1样品a加入到血清或其他相应基质的样品b 中,a(高值)与b(低值)的体积比为1:9,每个样品均重复检测3次,计算平均值。回算回收率r。结果如下表5,可见回收率为95.08%,回收率较好。
[0124]
表5:实施例1制备的试剂盒的检测回收率测试结果
[0125][0126]
(5)本发明的试剂盒与酶联免疫吸附法测定试剂盒的方法学对比
[0127]
检测样本:40例kim-1浓度较高的无溶血、黄疸、浑浊现象的血清样品。
[0128]
用实施例1试剂盒的试剂和校准品在日立7180全自动生化分析仪上建立标准曲线,测定 kim-1样本。用对照试剂处理kim-1样品后在酶标仪上检测浓度。以本发明的试剂盒的测定值为纵坐标,以酶联免疫吸附法测定试剂盒的测定值为横坐标,绘制曲线,如图1所示。可见,本发明的试剂盒与酶联免疫吸附法测定试剂盒具有良好的相关性。
[0129]
测试例3.
[0130]
用实施例1、实施例2、实施例3的试剂,使用相同校准品定标,检测灵敏度和重复性,计算出最低检测限的浓度,检测限浓度低则灵敏度高。
[0131]
检测限检测:
[0132]
a、60次低浓度样本测定(浓度值在lob~4*lob之间,4个不同浓度,每天检测5次,检测在3天内完成);
[0133]
b、如检测结果符合正态分布按公式(1)计算检测限;
[0134]
公式(1):lod=lob+cβ*sds,cβ=1.645/(1-1/(4*f))
[0135]
lod
‑‑‑‑‑
检测限,sd
‑‑‑‑‑
标准差,f
‑‑‑‑‑
自由度
[0136]
c、若检测结果非正态分布,按照百分位法计算lod=lob+percentile(5%)
[0137]
percentile为百分位数,
[0138]
表6为实施例1、实施例2、实施例3试剂检测结果(单位:pg/ml)
[0139][0140]
结果显示,本发明实施例1的检测限为49.29pg/ml,实施例2的检测限为75.74pg/ml,实施例3的检测限为52.28pg/ml,说明本发明实施例1的检测试剂具有较高的灵敏度。本发明实施例1检测低值样本cv较低,重复性较好。
[0141]
以上所述具体实例仅对发明进行了阐述,用于帮助理解本发明,并不用以限制本发明。本发明所属技术领域的技术人员依据本发明的构思,还可以做出若干变形和改进,这些都属于本发明的保护范围。
[0142]
本发明未述及之处适用于现有技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1