自身抗体标志物IFIT5和PAH在前列腺癌诊断中的应用
自身抗体标志物ifit5和pah在前列腺癌诊断中的应用
技术领域
1.本发明涉及生物医学检测技术领域,具体涉及检测血浆中ifit5和/或pah自身抗体在诊断和/或治疗前列腺疾病中的应用。
背景技术:
2.前列腺疾病是成年男性的常见疾病,通常指前列腺炎、前列腺增生及前列腺癌等,其中,前列腺癌是男性最常见的恶性肿瘤之一。目前,前列腺癌筛查主要通过psa指标,但单纯依靠psa进行筛查时出现假阳性情况较多,通过穿刺活检确诊时便造成了医疗资源的浪费,同时也给筛查阳性者带来损伤。因此,寻找特异性更高的诊断标志物具有重要意义。
3.自身抗体是机体针对肿瘤抗原发生免疫反应而产生的特异性抗体,在肿瘤的早期诊断中具有较大的应用潜力。作为早期诊断的一类指标,自身抗体具有以下特点。
①
伴随肿瘤的发生过程产生,先于临床症状,适用于早期诊断。liu等在肝癌病人血浆中发现抗原mdm2的自身抗体,并基于一系列不同时间点的样本检测发现,在确诊之前6~9个月,该自身抗体水平已有显著提高。
②
自身抗体的产生是免疫反应的结果,经过免疫系统的放大,抗体更容易被检测。
③
具有特定类型肿瘤特异性。研究发现一些抗原是肿瘤特有的,但不同肿瘤间无特异性(如p53);也有一些抗原是某种肿瘤特异性的(如前列腺癌的与氧化应激相关的蛋白)。
④
对于一个特定的taa,其自身抗体仅出现在10%-30%的病人中,作为诊断工具,其灵敏度偏低。可通过联合多个指标,建立一个标志物组合,在维持较高特异性的前提下,提高检测灵敏度,从而可应用于临床诊断。
技术实现要素:
4.本发明提供了一种特异性高、灵敏度高的诊断前列腺疾病的标志物,即ifit5和/或pah自身抗体。具体的,本发明研究了前列腺良性疾病、前列腺癌患者、健康人外周血中自身抗体的表达,从中筛选出特异性高表达的ifit5和/或pah自身抗体,并且验证其单独或组合或联合其他方法进行诊断前列腺疾病,获得了极高的特异性和敏感性。而且,将pah自身抗体检测与psa诊断结合进行诊断,可以大幅提高单独使用psa诊断的特异性和敏感性。
5.本发明的第一方面,提供了自身抗体、检测自身抗体的试剂或自身抗体作为标志物在制备诊断和/或治疗前列腺疾病的产品中的应用,所述的自身抗体包括ifit5和/或pah。
6.优选的,所述的自身抗体为外周血(优选为血浆或全血)中的自身抗体。
7.优选的,所述的诊断前列腺疾病包括检测自身抗体,优选为检测自身抗体的表达量。
8.将ifit5和/或pah自身抗体的表达量与对照组比较,若表达量明显高,则患有前列腺疾病。其中,对照组可以为前列腺良性疾病或健康对照组。若为健康对照组,则诊断个体是否患有前列腺癌和/或前列腺良性疾病,若为前列腺良性疾病对照组则诊断具体为某种前列腺良性疾病或者是否患有前列腺癌。
9.优选的,所述的诊断前列腺疾病包括采用检测自身抗体的试剂检测自身抗体的表达量。
10.更优选的,所述的诊断前列腺疾病包括采用蛋白芯片或elisa检测自身抗体的表达量。
11.优选的,所述的ifit5和/或pah自身抗体可以单独或组合或联合其他标志物或联合其他方法进行前列腺疾病的诊断和治疗。
12.其中,所述的其他方法例如直肠指诊、超声、x线检查、组织检查、下尿路尿活动力学检查、前列腺液镜检或ct与mri检查等等。其中,其他标志物优选为psa。在本发明的一个具体实施方式中,所述的诊断前列腺疾病包括检测自身抗体,且检测psa。
13.优选的,所述的治疗前列腺疾病包括调节自身抗体的表达量,优选为下调自身抗体的表达量。
14.优选的,所述的前列腺疾病选自前列腺炎、前列腺增生或前列腺癌。
15.本发明的第二方面,提供了一种前列腺疾病的诊断和/或治疗的标志物,所述的标志物为ifit5和/或pah自身抗体。
16.本发明的第三方面,提供了自身抗体、检测自身抗体的试剂或自身抗体作为标志物在制备区分前列腺癌与前列腺良性疾病的产品中的应用。
17.优选的,所述的自身抗体包括ifit5和/或pah。
18.优选的,所述的自身抗体为外周血(优选为血清、血浆或全血)中的自身抗体。
19.优选的,所述的区分前列腺癌与前列腺良性疾病包括检测自身抗体,优选为检测自身抗体的表达量。
20.根据前列腺癌与前列腺良性疾病中ifit5和/或pah自身抗体的表达量差异,设定一个阈值,高于阈值为前列腺癌,低于阈值为前列腺良性疾病。
21.优选的,所述的区分前列腺癌与前列腺良性疾病包括采用检测自身抗体的试剂检测自身抗体的表达量。
22.更优选的,所述的区分前列腺癌与前列腺良性疾病包括采用蛋白芯片或elisa检测自身抗体的表达量。
23.优选的,所述的ifit5和/或pah自身抗体可以单独或组合或联合其他标志物或联合其他方法进行前列腺癌与前列腺良性疾病的区分。
24.其中,所述的其他方法例如直肠指诊、超声、x线检查、组织检查、下尿路尿活动力学检查、前列腺液镜检或ct与mri检查等等。其中,其他标志物优选为psa。在本发明的一个具体实施方式中,所述的区分前列腺癌与前列腺良性疾病包括检测自身抗体,且检测psa。
25.优选的,所述的前列腺良性疾病选自前列腺炎或前列腺增生。
26.本发明的第四方面,提供了一种诊断试剂盒,所述的诊断试剂盒包含检测自身抗体的试剂,所述的自身抗体包括ifit5和/或pah。
27.优选的,所述的检测自身抗体的试剂包括引物、探针、蛋白芯片或elisa所需试剂。
28.本发明的第五方面,提供了一种诊断前列腺疾病的方法,所述的方法包括检测自身抗体。优选包括检测自身抗体的表达量。进一步优选包括采用检测自身抗体的试剂检测自身抗体的表达量。
29.优选的,所述的方法还包括检测psa的表达量。
30.优选的,所述的方法还包括结合其他步骤例如直肠指诊、超声、x线检查、组织检查、下尿路尿活动力学检查、前列腺液镜检或ct与mri检查等等诊断前列腺疾病。
31.本发明的第六方面,提供了一种治疗前列腺疾病的方法,所述的方法包括调节自身抗体的表达量。优选的,使用调节自身抗体的试剂调节自身抗体的表达量。
32.优选的,所述的方法还可以结合其他例如放化疗、药物等进行治疗。
33.本发明的第七方面,提供了一种治疗前列腺疾病的药物的筛选方法,所述的筛选方法包括向个体施加候选药物,然后检测自身抗体。所述的自身抗体包括ifit5和/或pah。若施加的候选药物使得个体血浆中自身抗体的表达量下调,代表候选药物具有治疗作用。可以根据下调的程度确定治疗的效果。
34.本发明所述的“前列腺疾病”包括但不限于急性或慢性前列腺炎、前列腺增生或前列腺癌。
35.本发明所述的“前列腺良性疾病”为除前列腺癌外的其他前列腺疾病。
36.本发明所述的“前列腺癌”包括但不限于腺癌(腺泡腺癌)、导管腺癌、尿路上皮癌、鳞状细胞癌或腺鳞癌等等。
37.本发明所述的“诊断”是指以查明患者过去、诊断时或将来是否患有疾病或病症,或者是查明疾病的进展或将来可能的进展。
38.本发明所述的“治疗”表示在疾病已开始发展后减缓、中断、阻止、控制、停止、减轻、或逆转一种体征、症状、失调、病症、或疾病的进展或严重性,但不一定涉及所有疾病相关体征、症状、病症、或失调的完全消除。
39.本发明所述的“产品”包含检测自身抗体的试剂和/或调节自身抗体的试剂,包括但不限于检测自身抗体的试剂、调节自身抗体的试剂、设备、试剂盒、药物等等。
40.本发明所述的“检测自身抗体的试剂”根据检测方法的不同包含着不同的内容,例如可以采用pcr、测序、液相、质谱、southern blot或western blot等等的方法检测,相应的,检测自身抗体的试剂至少包含pcr所需试剂、测序所需试剂、液相所需试剂、质谱所需试剂、southern blott所需试剂或western blot所需试剂等等。优选包括但不限于引物、探针、蛋白结合配体、染色剂等等。
41.本发明所述的“调节自身抗体的试剂”根据反应原理不同包含着不同的内容,例如抗原抗体结合、敲入、敲除、敲低等等,相应的,调节自身抗体的试剂至少包含相应的蛋白、敲除所需试剂、敲入所需试剂、敲低所需试剂等等,优选包括但不限于自小分子、sirna、mirna、编码sirna的dna、编码mirna的dna以及微抗体、fab或片段、骆驼抗体或纳米抗体等等。
42.本发明所述的“包含”或“包括”是开放式的描述,含有所描述的指定成分或步骤,以及不会实质上影响的其他指定成分或步骤。
43.本发明所述的“个体”可以为人或非人动物,所述的非人动物可以为鼠、牛、羊、兔、猪、猴等非人哺乳动物。
44.本发明所述的“和/或”包含该术语所连接的项目的所有组合,应视为各个组合已经单独地在本问列出。例如,“a和/或b”包含了“a”、“a和b”以及“b”。又例如,“a、b和/或c”包含了“a”、“b”、“c”、“a和b”、“a和c”、“b和c”以及“a和b和c”。
45.本发明所述的表达量可以为绝对表达量或相对表达量。所谓相对表达量可以为目
的基因相对于内参的表达量变化。
46.本技术简写与全程对照:
47.ifit5:interferon-induced protein with tetratricopeptide repeats 5,干扰素诱导蛋白5。
48.pah:phenylalanine hydroxylase,苯丙氨酸羟化酶。
49.psa:prostate specific antigen,前列腺特异性抗原。
50.auc,area under curve,被定义为roc曲线下的面积。
51.roc:receiver operating characteristic curve,接收者操作特征曲线。
52.bsa:牛血清白蛋白。
53.pbst或pbs-t:为pbs溶液加上tween-20,其中,pbs为磷酸盐缓冲液(phosphate buffered saline)。
54.hrp:辣根过氧化物酶。
55.tmb显色液:主要成分为3,3’,5,5
’–
四甲基联苯胺。
56.pe:聚乙烯材料。
附图说明
57.以下,结合附图来详细说明本发明的实施例,其中:
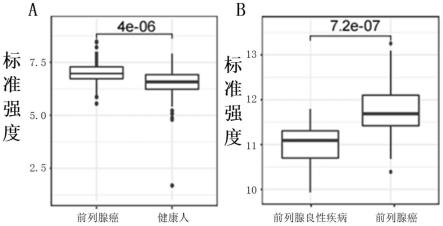
58.图1:各组样品中ifit5自身抗体和pah自身抗体的标准强度,其中,图a为前列腺癌与健康人中ifit5自身抗体的表达水平,图b为前列腺良性疾病与前列腺癌中pah自身抗体的表达水平。
59.图2:ifit5自身抗体和pah自身抗体诊断前列腺疾病的roc曲线,其中,左图代表ifit5自身抗体区分前列腺癌和健康人,右图代表pah自身抗体区分前列腺良性疾病与前列腺癌。
60.图3:pah自身抗体与tpsa区分前列腺良性疾病与前列腺癌的roc曲线,其中,左图代表tpsa诊断前列腺癌和前列腺良性疾病,右图代表pah自身抗体诊断前列腺癌和前列腺良性疾病。
61.图4:ifit5自身抗体和pah自身抗体诊断前列腺疾病,其中,图a为ifit5自身抗体在前列腺癌和健康人中的表达水平,图b为ifit5自身抗体区分前列腺癌和健康人的roc曲线,图c为pah自身抗体在前列腺癌与前列腺良性疾病中的表达水平,图d为pah自身抗体联合tpsa区分前列腺癌和前列腺良性疾病的roc曲线。
具体实施方式
62.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
63.实施例中使用的试剂来源:
64.huprot芯片购买自cdi labs,货号为cdihp-003。
65.小芯片购买自cdi labs,货号为cdihp-005.pc。
66.elisa试剂盒为抗肿瘤分子靶向药物临床研究北京市重点实验室自制试剂盒,非商品化试剂盒。
67.实施例中标准强度的计算方法:使用genepix 6.0调用网格对齐点并记录每个蛋白质点的前景和背景强度。每个蛋白质点的原始结合强度(rij)定义为fij/bij,其中fij和bij分别是芯片上位点(i,j)处探针的前景和背景信号的中值。n定义为背景噪声,和std(n)分别为背景噪声的均值和标准差。公式定义如下:
[0068][0069]
相同蛋白质两个重复点的z分数值取均值即为该蛋白自身抗体的标准强度。
[0070]
实施例1-3中前列腺癌患者及前列腺良性疾病患者临床特征介绍见表1:
[0071]
表1
[0072]
[0073][0074]
实施例1筛选自身抗体
[0075]
提取28例前列腺癌患者,14例前列腺良性疾病患者和15例健康人对照的外周血,采用huprot芯片检测血液自身抗体。
[0076]
1、样品制备步骤
[0077]
收集入组人群的静脉血标本,经过3500r/min,4℃离心10分钟后,将上清液分离到干净的1.5ml ep管中,每个样本分装成3份,做好标记信息后放入-80℃冰箱保存,待实验时取用,避免反复冻融。
[0078]
2、筛选步骤
[0079]
1)芯片准备:从-80℃冰箱取出huprot芯片,放入芯片盒中,保鲜膜包裹后,室温放置20min复温。
[0080]
2)封闭:蒸馏水浸湿孵育槽,芯片蛋白面朝上放入其中,加入5ml的封闭液轻晃并没过芯片蛋白面,盖上槽盖;置于摇床缓慢的水平摇晃,室温孵育1.5h。
[0081]
3)样品准备:提前从-80℃取出样品,室温溶解,振荡混匀后高速(12000rpm)离心10min;取上清5μl与5ml封闭液1:1000涡旋混匀,即为配制好的样品。
[0082]
4)加样:倒掉孵育槽封闭液,直接加入第3)步配制好的样品,轻晃没过芯片;盖上槽盖,室温孵育1h。
[0083]
5)漂洗:用pbst缓冲液洗6次,后3次漂洗过程需置于摇床,快速的左右摇晃10min/次。
[0084]
6)二抗准备:关灯,提前10min从冰箱取出封闭液和二抗igg。取5ml冻存管,用锡箔纸包住冻存管,加入10μl二抗igg和5ml封闭液,涡旋混匀,获得配置好的二抗溶液。
[0085]
7)加二抗:漂洗后,孵育槽中加入5ml第6)步配制好的二抗溶液,轻轻摇晃保证全部没过;盖上槽盖,包上锡箔纸以避光。置于摇床缓慢的水平摇晃,室温孵育1h。
[0086]
8)漂洗:先用pbst缓冲液洗6次,后3次漂洗过程需置于摇床,快速的左右摇晃10min/次。再用10x的pbst缓冲液洗3次,置于摇床,快速的左右摇晃10min/次。
[0087]
9)晾干芯片:漂洗后,从孵育槽中取出芯片,竖直于吸水纸上沥干,放入芯片盒。
[0088]
10)扫描和读片:
[0089]
第一、提前20min开机预热:打开电脑电源键,主机开关,扫描仪开关;打开软件genepix pro-device。
[0090]
第二、放入芯片,有条形码蛋白面朝下,设置激发光波长为635,光电被增管(pmt)设置为700,激光能量(power)设置为10%,像素大小(pixel size)设置为10m,点击绿三角开始按钮,扫描开始。扫描完点击白色信封,第三条,保存,tif格式;
[0091]
第三、数据提取/圈点:打开genepix软件——将tif文件和gal文件一起拉到小窗口——设置(左上image和右下蓝色设置pmt-gan——整理数据:选中区,根据固定阳性点(2个挨着的都有强信号算阳性)调整区的位置,没必要拉掉假阳性点到黑色背景区,只操作保证准阳性点(强度约在背景10倍)恰好圈住(上下左右移动,ctrl加上下调大小)——保存为gps格式,名字与tif格式命名相同。
[0092]
3、试验结果
[0093]
利用卡方检验筛选差异自身抗体,其中前列腺癌病人与健康对照相比有3857差异蛋白,前列腺癌与前列腺良性疾病相比有3804差异蛋白,结果筛选出差异最为显著的ifit5自身抗体和pah自身抗体。
[0094]
实施例2小芯片验证自身抗体诊断前列腺疾病的特异性及敏感性
[0095]
对88例前列腺癌患者,20例前列腺良性疾病患者和70例健康人对照的外周血,采用小芯片检测实施例1筛选的差异自身抗体,其数据利用经验贝叶斯进行差异检验。
[0096]
1、小芯片步骤
[0097]
1)蛋白质芯片的保存:将装有前列腺癌靶向蛋白质芯片的塑料芯片盒存储于-80
°
冰箱。芯片盒取出后放入pe手套中室温放置20min。
[0098]
2)安装围栏;将芯片正面朝上,按照芯片上每个block的位置将配套的芯片围栏粘贴在芯片上,卡好,保证围栏与芯片完全贴合,然后放入孵育盒中。
[0099]
3)封闭:在芯片的每个block中加入60μl封闭液(3%bsa(w/v),pbs-t),室温孵育1h,在摇床上轻轻摇动(60rpm)。
[0100]
4)样品准备:将血浆提前取出(步骤同实施例1),溶解后12000rpm离心10min,将血浆用封闭液(3%bsa(w/v),pbs-t)按照1:2000的比例稀释,混匀,建议梯度稀释。
[0101]
5)杂交:将芯片block中的封闭液倒掉,每个block小心地加入准备好的血浆样品(60μl),避免产生气泡。室温孵育1h。
[0102]
6)洗片:孵育结束后,将芯片block中的液体倒掉,拆掉围栏,将芯片放入孵育盒。每格中加入10.0ml pbs-t,室温中摇动洗涤10min(40rpm),重复三次。
[0103]
7)干片:用平头镊子将芯片从孵育盒中取出,竖直放在50ml离心管中,1000rpm离
心2min。吸水纸铺在台面上,将芯片从离心管中取出竖直接触吸水纸,从芯片边缘吸取残留的水分。
[0104]
8)安装围栏并加入荧光标记的二抗孵育:按照芯片每个block的位置安装围栏,保证贴合。二抗(alexa 647标记的山羊抗人igg抗体)用封闭液3%bsa 1:2000稀释,振荡混匀,每个block加入60μl稀释好的二抗,室温孵育1小时,避光。
[0105]
9)洗片:孵育结束后,将芯片block中的液体倒掉,拆掉围栏,将芯片放入孵育盒。每格加入10.0ml pbs-t,室温缓慢摇动10min(40rpm),重复三次,避光。用10ml ddh2o避光漂洗蛋白芯片每次10min,重复3次。
[0106]
10)干片:用平头镊子将芯片从孵育盒中取出,竖直放在50ml离心管中,1000rpm离心2min。吸水纸铺台面上,将芯片从离心管中取出竖直接触吸水纸,从芯片边缘吸取残留的水分。把干燥的芯片转移到新的干净的载玻片盒中。
[0107]
11)扫描和保存数据同实施例1。
[0108]
2、试验结果
[0109]
结果显示,与健康人相比,ifit5自身抗体在前列腺癌患者中显著升高(图1a)。与前列腺良性疾病患者相比,pah自身抗体在前列腺癌患者中显著升高(图1b)。
[0110]
同时,ifit5自身抗体区分前列腺癌和健康人对照的auc为0.714,其中,特异性0.557,敏感性0.841(图2a,最佳界值点为6.607),pah自身抗体区分前列腺癌和前列腺良性疾病的auc为0.856,其中,特异性0.850,敏感性0.807(图2b,最佳界值点为11.321)。
[0111]
pah自身抗体与浅灰区tpsa相比具有更好的诊断性能。浅灰区tpsa诊断前列腺癌和前列腺良性疾病的auc为0.47,其中,特异性0.583,敏感性0.615(图3左,最佳界值点为6.923),而pah自身抗体为0.856,其中,特异性0.917,敏感性0.731(图3右,最佳界值点为11.354)。
[0112]
实施例3 elisa验证自身抗体诊断前列腺疾病的特异性及敏感性
[0113]
对61例前列腺癌患者,63例前列腺良性疾病患者和72例健康人对照的外周血,采用elisa试剂盒检测实施例1筛选的差异自身抗体。
[0114]
1、elisa步骤
[0115]
1)蛋白包被:
[0116]
(1)配制包被液:称取na2co
3 1.59g,nahco
3 2.93g,溶解在900ml的去离子水,调ph至9.6,继续加水至1l,贮存在4℃。
[0117]
(2)取出目的蛋白(ifit5、pah或psa蛋白),冰上融化,利用包被液稀释至1μg/ml。
[0118]
(3)每孔加入50μl稀释后的目的蛋白,封板,4℃过夜。
[0119]
2)封闭
[0120]
(1)提前利用pbst准备好至少30ml的5%的牛奶置于4℃,500ml的pbst室温放置。
[0121]
(2)取出包被的板子,弃掉包被液,pbst洗涤5次,每次3min。
[0122]
(3)每孔加入50μl的5%的牛奶,封板,室温封闭2h。
[0123]
3)血浆稀释
[0124]
(1)在封闭结束前半小时,取出血浆样本,冰上融化20min,开盖前瞬离一下血浆。
[0125]
(2)以5%的牛奶稀释血浆至1:100,1:300,1:600,混匀后放4℃备用。(依据预实验结果将一抗浓度定为1:300)。
[0126]
4)孵一抗(加血浆)
[0127]
(1)弃掉板子内的牛奶,pbst洗涤5次,每次5min,最后一次洗涤完在纸上拍干板子内的液体。
[0128]
(2)实验孔中加入50μl稀释后的血浆,阴性对照孔加入50μl的5%的牛奶,阳性对照孔加入抗蛋白标签的抗体。封板,室温摇床上孵育1h。
[0129]
5)加二抗
[0130]
(1)稀释二抗(igg):取出二抗,以5%的牛奶稀释二抗,拟定1:8000稀释浓度。
[0131]
(2)一抗孵育结束后,弃掉板子内一抗液体,pbst洗涤5次,每次5min,最后一次洗涤完在纸上拍干板子内的液体。
[0132]
(3)向每孔加入50μl hrp标记的稀释后的二抗,封板,室温摇床上孵育1h。
[0133]
6)显色
[0134]
(1)二抗开始孵育后,取出适当量的tmb置于室温避光处。
[0135]
(2)二抗孵育结束后,弃掉板子内的二抗液体,pbst洗涤5次,每次5min,最后一次洗涤完在纸上拍干板子内的液体。
[0136]
(3)每孔内加入100μl tmb,tmb加完时即开始计时。
[0137]
(4)室温放置25-30min,具体时间看阳性孔变蓝时。
[0138]
(5)每孔加入50μl的0.5m的硫酸,终止显色反应。
[0139]
7)检测
[0140]
加入硫酸终止后立即检测,简单摇晃后于450nm波长下检测。
[0141]
2、试验结果
[0142]
结果如图4所示,ifit5自身抗体依然在前列腺癌中远高于健康人对照(图4a),其诊断auc为0.713,其中,特异性0.653,敏感性0.754(图4b,最佳界值点为1.332)。pah自身抗体在前列腺癌中显著高于前列腺良性疾病患者(图4c),其联合tpsa区分前列腺癌和前列腺良性疾病患者的auc为0.784,其中,特异性0.650,敏感性0.833(图4d,最佳界值点为0.345)。
[0143]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0144]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1