一种在酵母中建立基于红色荧光蛋白的双分子荧光互补系统的方法
1.本发明涉及生物技术领域,具体涉及一种在酵母中建立基于红色荧光蛋白的双分子荧光互补系统的方法。
背景技术:
2.蛋白质间的互作构成生命活动的基础,在后基因组时代,科研人员已经建立了包括细菌、酵母、拟南芥、线虫和人类在内等的多个物种的蛋白质互作网络,并在此基础上鉴定了许多蛋白质的新功能及其在蛋白质互作网络中的作用,为揭示蛋白质在生命活动过程中的作用奠定了基础。然而现有网络中含有的相互作用蛋白数目距离理论估算的数目仍有较大差距,这其中很大一部分原因是由于实验技术本身的缺陷所导致的。例如酵母双杂交技术只能用于入核蛋白的相互作用研究,其技术本身还存在着自激活和假阳性等问题,且实验周期较长,工作量较大。而亲和纯化串联质谱技术主要是针对蛋白质复合体的相互作用进行研究,在蛋白质纯化的过程中会丢失一些较弱的相互作用,其后续的蛋白质分析和检测费用较高且需要较为专业的生物信息学知识对质谱结果进行分析。因此,开发快速、简便、可信性好的蛋白质相互作用新技术将会在规模化蛋白质相互作用研究中发挥重要作用。
3.hu等于2002年开发出了在哺乳细胞中表达的基于黄色荧光蛋白(venus)的双分子荧光互补系统(bimolecular fluorescent complementation,bifc),该系统将venus在154个氨基酸处分别vn154和vc154两个无荧光片段,这两个片段在细胞内共表达或体外混合时,不能自发地组装成荧光蛋白。但是当这两个荧光片段分别连接到一对有相互作用的蛋白上并在细胞内共表达或体外混合时,由于目标蛋白质之间的相互作用,荧光蛋白的两个片段在空间上互相靠近,重新构建成完整的具有活性的荧光蛋白分子而发出荧光。bifc技术具有试验周期耗时短、操作简单和无需添加发光物质等优点。然而现有的适合于哺乳动物细胞中表达的bifc系统在酵母和植物中表达时存在着荧光信号弱,背景值高等问题,因此需要在酵母中建立一种经济、方便且具有高荧光值、低背景的bifc系统用于蛋白质相互作用研究。
技术实现要素:
4.本发明的目的是提供一种在酵母中建立基于红色荧光蛋白的双分子荧光互补系统的方法。
5.第一方面,本发明要求保护一种检测目的蛋白a与目的蛋白b是否为互作蛋白的方法。
6.本发明要求保护的检测目的蛋白a与目的蛋白b是否为互作蛋白的方法,可包括如下步骤:
7.(1)将红色荧光蛋白分成n端部分和c端部分;在所述n端部分的编码基因的5’末端
或3’末端通过连接序列(linker)连接目的蛋白a的编码基因,形成融合基因片段a;在所述c端部分的编码基因的5’末端或3’末端通过所述连接序列(linker)连接目的蛋白b的编码基因,形成融合基因片段b。
8.所述红色荧光蛋白的氨基酸序列如seq id no.1所示;所述n端部分的氨基酸序列如seq id no.1的第1-159位所示;所述c端部分的氨基酸序列如seq id no.1的第160-236位所示;所述连接序列(linker)编码seq id no.2所示连接肽。
9.其中,所述连接肽的加入是为了使目的蛋白能够充分折叠。
10.(2)将所述融合基因片段a和所述融合基因片段b导入同一受体酵母细胞,得到转基因酵母细胞;培养所述转基因酵母细胞,然后检测所述转基因酵母细胞是否产生红色荧光,根据检测结果按照如下确定所述目的蛋白a与所述目的蛋白b是否互作:若所述转基因酵母细胞产生红色荧光,则所述目的蛋白a与所述目的蛋白b为或候选为互作蛋白;若所述转基因酵母细胞不产生红色荧光,则所述目的蛋白a与所述目的蛋白b不为或候选不为互作蛋白。
11.如果所述目的蛋白a与所述目的蛋白b存在相互作用,则所述红色荧光蛋白的n端部分和c端部分靠近,重新组装成完整的红色荧光蛋白产生荧光;如果所述目的蛋白a与所述目的蛋白b不存在相互作用,则由于所述红色荧光蛋白的n端部分和c端部分分离,因而检测不到红色荧光。
12.在步骤(2)中,将所述融合基因片段a和所述融合基因片段b均导入同一受体酵母细胞具体可为:先将所述融合基因片段a和所述融合基因片段b中的任一个导入所述受体酵母细胞,然后再导入另一个;或者为将所述融合基因片段a和所述融合基因片段b同时导入所述受体酵母细胞。
13.在步骤(2)中,检测所述转基因酵母细胞是否产生红色荧光可通过采用荧光显微镜进行观察或者采用流式细胞仪进行分析。
14.进一步地,所述融合基因片段a可通过酵母重组表达载体a导入所述受体酵母细胞中;所述融合基因片段b可通过酵母重组表达载体b导入所述受体酵母细胞中。
15.进一步地,所述酵母重组表达载体a中启动所述融合基因片段a转录的启动子可为padh启动子;所述酵母重组表达载体b中启动所述融合基因片段b转录的启动子可为padh启动子。
16.在本发明中,所述padh启动子的序列具体为seq id no.4的第99-1552位(对应seq id no.5的第4283-5736位)。
17.更进一步地,所述酵母重组表达载体a可为将所述n端部分的编码基因和所述目的蛋白a的编码基因,两者中的一个插入到酵母表达载体a的酶切位点sali和bglii之间,另一个插入到所述酵母表达载体a的酶切位点spei和noti之间后得到的重组质粒;所述酵母表达载体a的序列如seq id no.4所示。
18.更进一步地,所述酵母重组表达载体b可为将所述c端部分的编码基因和所述目的蛋白b的编码基因,两者中的一个插入到酵母表达载体b的酶切位点sali和ncoi之间,另一个插入到所述酵母表达载体b的xbai和noti两个之间后得到的重组质粒;所述到酵母表达载体b的序列如seq id no.5所示。
19.进一步地,所述红色荧光蛋白的编码基因可如seq id no.3所示。相应的,所述n端
部分的编码基因可如seq id no.3的第1-477位所示;所述c端部分的编码基因可如seq id no.3的第478-708位所示。
20.进一步地,所述连接序列可如seq id no.4的第1586-1630位所示。
21.在本发明的一个实施例中,所述目的蛋白a和所述目的蛋白b分别为bjun蛋白和bfos蛋白(或
△
bfos蛋白)。其中,所述bjun蛋白为由seq id no.6所示dna片段编码的蛋白质;所述bfos蛋白为由seq id no.7所示dna片段编码的蛋白质;所述
△
bfos蛋白为由seq id no.8所示dna片段编码的蛋白质。
22.在本发明的实施例中,所述受体酵母细胞具体为酵母细胞ah109。
23.在上述方法中,所述培养的时间具体可为48
±
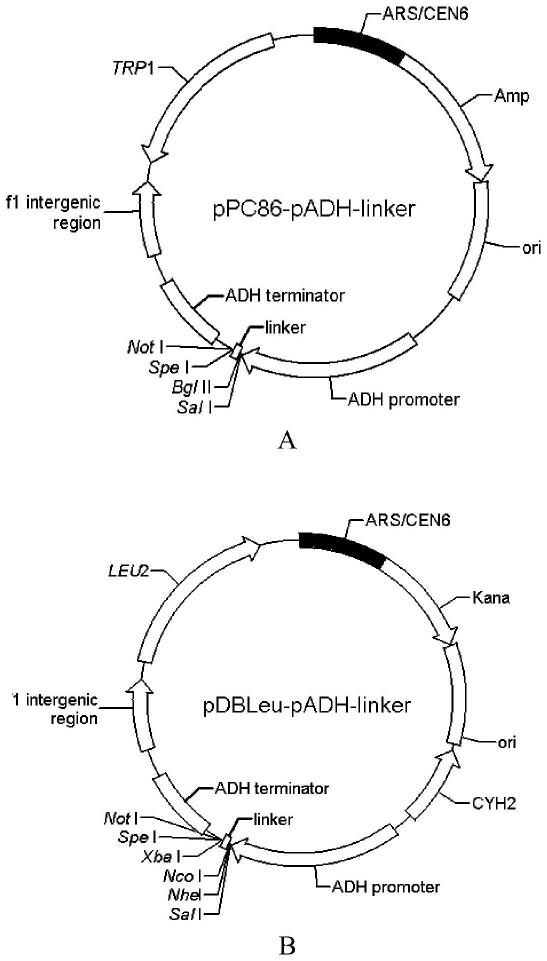
4小时(如48小时)。
24.具体的,所述培养为将所述转基因酵母细胞在缺陷型液体培养基sd-2中30℃振荡培养24小时,然后转入4℃振荡培养24
±
4小时(如24小时)。
25.所述缺陷型液体培养基sd-2的溶剂为水,溶质及其浓度如下:ynb 6.7g/l,葡萄糖20g/l,缺少亮氨酸和色氨酸的氨基酸混合物(sd-leu/-trp,clontech,目录号:630417)0.64g/l,ph 5.9。
26.第二方面,本发明还要求保护如下(a)或(b)所示的产品:
27.(a)酵母表达载体组,由酵母表达载体a和酵母表达载体b组成;
28.所述酵母表达载体a的seq id no.4所示;所述酵母表达载体b的序列如seq id no.5所示。
29.(b)由所述酵母表达载体组和受体酵母细胞组成的产品。
30.其中,所述受体酵母细胞可为酵母细胞ah109。
31.第三方面,本发明还要求保护前文第二方面所述产品在检测目的蛋白a与目的蛋白b是否为互作蛋白中的应用。
32.本发明建立了适合在酵母表达的基于yemrfp的bifc技术,具有较高的敏感性和特异性,适合于在酵母中开展蛋白质相互作用研究。
附图说明
33.图1为ppc86-padh-linker载体和pdbleu-padh-linker载体的质粒图谱。其中,a为ppc86-padh-linker载体的质粒图谱;b为pdbleu-padh-linker载体的质粒图谱。
34.图2为ppc86-rn159-bjun、ppc86-bjun-rn159和pdbleu-rc160-bfos、pdbleu-bfos-rc160载体两两组合转化ah109酵母,培养48h后进行荧光显微镜观察和流式检测的结果。其中,a为荧光显微镜观察结果(merge为rfp和dapi的叠加;dic为differential interference contrast微分干涉差(也就是在明场视野下观察);b为流式检测结果。
具体实施方式
35.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
36.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊
说明,均可从商业途径得到。
37.酵母表达载体ppc86:invitrogen公司产品,是目录号为10835031的试剂盒中的产品。酵母表达载体pdbleu:invitrogen公司产品,是目录号10835031的试剂盒中的产品。酵母表达载体ppc86和pdbleu均记载于“wang,j.,et al.,toward an understanding of the protein interaction network of the human liver.mol syst biol,2011.7:p.536.”一文,公众可从申请人处获得,仅用于重复本发明试验使用,不得他用。
38.酵母细胞ah109:clontech公司产品,是目录号pt3247-1的试剂盒中的产品。
39.实施例1、基于yemrfp的bifc系统的建立
40.一、改造酵母表达载体ppc86和pdbleu
41.1、改造酵母表达载体ppc86,构建ppc86-padh-linker
42.(1)采用限制性内切酶kpni和spei双酶切酵母表达载体ppc86,将adh promoter-nls-gal4 ad序列去除,保留大小约为5209bp的载体骨架片段。
43.(2)以ppc86为模板,采用引物ppc86-padh-f和ppc86-linker-r进行pcr扩增,扩增得到adh promoter-linker序列,将其采用kpni和spei双酶切处理后连入步骤(1)经kpni和spei双酶切处理的ppc86载体骨架片段,形成ppc86-padh-linker载体。
44.上游引物ppc86-padh-f:5
’‑
aaaggtaccatccgggatcgaagaaatg-3’;
45.下游引物ppc86-linker-r:5
’‑
ctagactagtagaaccaccaccaccagaaccaccaccaccagaaccaccaccaccagatctgaattcccggggtcgacggcataagcttggagttgatt-3’。
46.ppc86-padh-linker载体的全序列如seq id no.4所示,其中第99-1552位为padh启动子序列,第1586-1630位为linker序列。
47.ppc86-padh-linker载体的质粒图谱如图1中a所示。
48.2、改造酵母表达载体pdbleu,构建pdbleu-padh-linker载体
49.(1)采用限制性内切酶bgl ii和spe i双酶切酵母表达载体pdbleu,切除部分cyh2和adh promoter-gal4 db序列,保留大小约为7131bp的载体骨架片段。
50.(2)以pdbleu为模板,采用引物pdbleu-cyh2-padh-f和pdbleu-linker-r进行pcr扩增,扩增得到部分的cyh2-adh promoter-linker序列,经bgl ii和spe i双酶切处理后,将其连入步骤(1)经bgl ii和spe i双酶切处理的pdbleu载体骨架片段,形成pdbleu-padh-linker载体。
51.上游引物pdbleu-cyh2-padh-f:5
’‑
ggaagatcttaccgtaaccggctg-3’;
52.下游引物pdbleu-linker-r:5
’‑
ctagactagtctagaagaaccaccaccaccagaaccaccaccaccagaaccaccaccaccccatgggctagcacccggggtcgacattgcttcaagcttggagttgatt-3’。
53.pdbleu-padh-linker载体的全序列如seq id no.5所示,其中第4283-5736位为padh启动子序列,第5775-5819位为linker序列。
54.pdbleu-padh-linker载体的质粒图谱如图1中b所示。
55.二、建立适合于酵母中表达的bifc系统
56.1、将适合于酵母中表达的红色荧光蛋白(yeast-enhanced mrfp,yemrfp)分成n端部分和c端部分;在所述n端部分的编码基因的5’末端或3’末端通过连接序列(linker)连接目的蛋白a的编码基因,形成融合基因片段a;在所述c端部分的编码基因的5’末端或3’末端通过所述连接序列(linker)连接目的蛋白b的编码基因,形成融合基因片段b;
57.所述红色荧光蛋白的氨基酸序列如seq id no.1所示;所述n端部分的氨基酸序列如seq id no.1的第1-159位所示;所述c端部分的氨基酸序列如seq id no.1的第160-236位所示;所述连接序列编码seq id no.2所示连接肽。
58.所述红色荧光蛋白的编码基因如seq id no.3所示;所述n端部分的编码基因如seq id no.3的第1-477位所示;所述c端部分的编码基因如seq id no.3的第478-708位所示;所述连接序列如seq id no.4的的第1586-1630位(对应seq id no.5的第5775-5819位)所示。
59.2、将含有所述融合基因片段a的酵母重组表达载体a和含有所述融合基因片段b的酵母重组表达载体b均导入同一受体酵母细胞ah109,得到转基因酵母细胞;培养所述转基因酵母细胞48小时,具体为将所述转基因酵母细胞在缺陷型液体培养基sd-2(配制方法如下:ynb 6.7g,葡萄糖20g,缺少亮氨酸和色氨酸的氨基酸混合物(sd-leu/-trp,clontech,目录号:630417)0.64g,调节ph值为5.9,定容到1l,120℃高压灭菌15min)中30℃振荡培养24小时,然后转入4℃振荡培养24小时,然后采用荧光显微镜或者基于流式细胞术分析检测所述转基因酵母细胞是否产生红色荧光,根据检测结果按照如下确定所述目的蛋白a与所述目的蛋白b是否互作:如果目的蛋白a与目的蛋白b存在相互作用,则yemrfp的n端和c端靠近,重新组装成完整的yemrfp蛋白产生红色荧光;如果a与b不存在相互作用,则由于所述红色荧光蛋白的n端部分和c端部分分离,因而检测不到红色荧光。
60.其中,所述酵母重组表达载体a为将所述n端部分的编码基因(seq id no.3的第1-477位)和所述目的蛋白a的编码基因,两者中的一个插入到步骤一构建的ppc86-padh-linker载体的酶切位点sali和bglii之间,另一个插入到ppc86-padh-linker载体的酶切位点spei和noti之间后得到的重组质粒。所述酵母重组表达载体b为将所述c端部分的编码基因(seq id no.3的第478-708位)和所述目的蛋白b的编码基因,两者中的一个插入到步骤一构建的pdbleu-padh-linker载体的酶切位点sali和ncoi之间,另一个插入到pdbleu-padh-linker载体的xbai和noti之间后得到的重组质粒。
61.实施例2、采用实施例1建立的bifc系统验证bjun蛋白和bfos蛋白的互作
62.已知bjun蛋白和bfos蛋白为一对存在相互作用的蛋白(参见“hu,c.d.,chinenov,y.&kerppola,t.k.visualization of interactions among bzip and rel family proteins in living cells using bimolecular fluorescence complementation.molecular cell 9,789-798(2002).”一文,本实施例选取存在相互作用的“bjun蛋白和bfos蛋白”为阳性试验组,“bjun蛋白和缺失了与bjun蛋白相互作用结构域的δbfos蛋白”(公开“bfos蛋白中与bjun蛋白相互作用结构域”的参考文献为“hu,c.d.,chinenov,y.&kerppola,t.k.visualization of interactions among bzip and rel family proteins in living cells using bimolecular fluorescence complementation.molecular cell 9,789-798(2002).”)作为阴性实验组,验证实施例1建立的bifc系统。
63.一、构建ppc86-rn159-bjun、ppc86-bjun-rn159和pdbleu-rc160-bfos、pdbleu-bfos-rc160载体
64.1、构建ppc86-rn159-bjun载体
65.以seq id no.3所示的yemrfp蛋白的编码基因为模板,采用引物对rn159-f1和
rn159-r1进行pcr扩增,获得两端分别带有酶切位点sali和bglii的扩增产物。
66.rn159-f1:5
’‑
acgcgtcgaccatggtttcaaaaggtgaag-3’;
67.rn159-r1:5
’‑
ggaagatctatcttctggatacattcttt-3’。
68.采用限制性内切酶sali和bglii双酶切扩增产物,胶回收后与经过同样双酶切的实施例1步骤一构建的ppc86-padh-linker载体相连,得到重组质粒。将经测序表明为在ppc86-padh-linker载体的酶切位点sali和bglii之间插入了“c+seq id no.3的第1-477所示的dna片段(即yemrfp蛋白的n端部分的编码基因)”的重组质粒命名为ppc86-rn159。
69.以seq id no.6所示的bjun蛋白的编码基因为模板,采用引物对bjun-f1和bjun-r1进行pcr扩增,获得两端带有酶切位点spei和noti的扩增产物。
70.bjun-f1:5
’‑
attactagtaaggcggagaggaagcgcatgag-3’;
71.bjun-r1:5
’‑
attgcggccgcgtggttcatgactttctgttt-3’。
72.采用限制性内切酶spei和noti双酶切扩增产物,胶回收后与经过同样双酶切的ppc86-rn159载体相连,得到重组质粒。将经测序表明为在ppc86-padh-linker载体的酶切位点sali和bglii之间插入了“c+seq id no.3的第1-477所示的dna片段(即yemrfp蛋白的n端部分的编码基因)”,同时在酶切位点spei和noti之间插入了seq id no.6所示dna片段(即bjun蛋白的编码基因)的重组质粒命名为ppc86-rn159-bjun。将酵母重组表达载体ppc86-rn159-bjun表达的融合蛋白命名为rn159-bjun。
73.2、构建ppc86-bjun-rn159载体
74.以seq id no.6所示的bjun蛋白的编码基因为模板,采用引物对bjun-f2和bjun-r2进行pcr扩增,获得两端带有酶切位点sali和bglii的扩增产物。
75.bjun-f2:5
’‑
attgtcgactaaggcggagaggaagcgcatgag-3’;
76.bjun-r2:5
’‑
gccagatctgtggttcatgactttctgttt-3’。
77.采用限制性内切酶sali和bglii双酶切扩增产物,胶回收后与经过同样双酶切的实施例1步骤一构建的ppc86-padh-linker载体相连,得到重组质粒。将经测序表明为在ppc86-padh-linker载体的酶切位点sali和bglii之间插入了“t+seq id no.6所示dna片段(即bjun蛋白的编码基因)”的重组质粒命名为ppc86-bjun。
78.以seq id no.3所示的yemrfp蛋白的编码基因为模板,采用引物对rn159-f2和rn159-r2进行pcr扩增,获得两端分别带有酶切位点spei和noti的扩增产物。
79.rn159-f2:5
’‑
cggactagtatggtttcaaaaggtgaag-3’;
80.rn159-r2:5
’‑
taaagcggccgcatcttctggatacattcttt-3’。
81.采用限制性内切酶spei和noti双酶切扩增产物,胶回收后与经过同样双酶切的ppc86-bjun载体相连,得到重组质粒。将经测序表明为在ppc86-padh-linker载体的酶切位点sali和bglii之间插入了“t+seq id no.6所示dna片段(即bjun蛋白的编码基因)”,同时在酶切位点spei和noti之间插入了seq id no.3的第1-477所示的dna片段(即yemrfp蛋白的n端部分的编码基因)的重组质粒命名为ppc86-bjun-rn159。将酵母重组表达载体ppc86-bjun-rn159表达的融合蛋白命名为bjun-rn159。
82.3、构建pdbleu-rc160-bfos载体
83.以seq id no.3所示的yemrfp蛋白的编码基因为模板,采用引物对rc160-f1和rc160-r1进行pcr扩增,获得两端分别带有酶切位点sali和ncoi的扩增产物。
84.rc160-f1:5
’‑
acgcgtcgaccatgggtgctttaaaaggtgaaa-3’;
85.rc160-r1:5
’‑
ccgccatggtttatataattcatccatacc-3’。
86.采用限制性内切酶sali和ncoi双酶切扩增产物,胶回收后与经过同样双酶切的实施例1步骤一构建的pdbleu-padh-linker载体相连,得到重组质粒。将经测序表明为在pdbleu-padh-linker载体的酶切位点sali和ncoi之间插入了“catg+seq id no.3的第478-708所示的dna片段(即yemrfp蛋白的c端部分的编码基因)”的重组质粒命名为pdbleu-rc160。
87.以seq id no.7所示的bfos蛋白的编码基因为模板,采用引物对bfos-f1和bfos-r1进行pcr扩增,获得两端带有酶切位点xbai和noti的扩增产物。
88.bfos-f1:5
’‑
taatctagaggtcgtgcgcagtccatcggtc-3’;
89.bfos-r1:5
’‑
attgcggccgcacccaggtcgttcgggattttgc-3’。
90.采用限制性内切酶xbai和noti双酶切扩增产物,胶回收后与经过同样双酶切的pdbleu-rc160载体相连,得到重组质粒。将经测序表明为在pdbleu-padh-linker载体的酶切位点sali和ncoi之间插入了“catg+seq id no.3的第478-708所示的dna片段(即yemrfp蛋白的c端部分的编码基因)”,同时在酶切位点xbai和noti之间插入了seq id no.7所示dna片段(即bfos蛋白的编码基因)的重组质粒命名为pdbleu-rc160-bfos。将酵母重组表达载体pdbleu-rc160-bfos表达的融合蛋白命名为rc160-bfos。
91.4、构建pdbleu-bfos-rc160载体
92.以seq id no.7所示的bfos蛋白的编码基因为模板,采用引物对bfos-f2和bfos-r2进行pcr扩增,获得两端带有酶切位点sali和ncoi的扩增产物。
93.bfos-f2:5
’‑
taagtcgactggtcgtgcgcagtccatcggt-3’;
94.bfos-r2:5
’‑
attccatggacccaggtcgttcgggatttt-3’。
95.采用限制性内切酶sali和ncoi双酶切扩增产物,胶回收后与经过同样双酶切的实施例1步骤一构建的pdbleu-padh-linker载体相连,得到重组质粒。将经测序表明为在pdbleu-padh-linker载体的酶切位点sali和ncoi之间插入了“t+seq id no.7所示的dna片段(即bfos蛋白的编码基因)”的重组质粒命名为pdbleu-bfos。
96.以seq id no.3所示的yemrfp蛋白的编码基因为模板,采用引物对rc160-f2和rc160-r2进行pcr扩增,获得两端分别带有酶切位点xbai和noti的扩增产物。
97.rc160-f2:5
’‑
tgctctagaatgggtgctttaaaaggtgaa-3’;
98.rc160-r2:5
’‑
tttgcggccgctttatataattcatccataccacc-3’。
99.采用限制性内切酶xbai和noti双酶切扩增产物,胶回收后与经过同样双酶切的pdbleu-bfos载体相连,得到重组质粒。将经测序表明为在pdbleu-padh-linker载体的酶切位点sali和ncoi之间插入了seq id no.7所示的dna片段(即bfos蛋白的编码基因),同时在酶切位点xbai和noti之间插入了“atg+seq id no.3的第478-708所示的dna片段(即yemrfp蛋白的c端部分的编码基因)”的重组质粒命名为pdbleu-bfos-rc160。将酵母重组表达载体pdbleu-bfos-rc160表达的融合蛋白命名为bfos-rc160。
100.5、构建pdbleu-rc160
‑△
bfos载体
101.以seq id no.8所示的
△
bfos蛋白的编码基因为模板,采用引物对
△
bfos-f1和
△
bfos-r1进行pcr扩增,获得两端带有酶切位点xbai和noti的扩增产物。
102.△
bfos-f1:5
’‑
taatctagaggtcgtgcgcagtccatcggtc-3’;
103.△
bfos-r1:5
’‑
attgcggccgcacccaggtcgttcgggattttgc-3’。
104.采用限制性内切酶xbai和noti双酶切扩增产物,胶回收后与经过同样双酶切的pdbleu-rc160载体相连,得到重组质粒。将经测序表明为在pdbleu-padh-linker载体的酶切位点sali和ncoi之间插入了“catg+seq id no.3的第478-708所示的dna片段(即yemrfp蛋白的c端部分的编码基因)”,同时在酶切位点xbai和noti之间插入了seq id no.8所示dna片段(即
△
bfos蛋白的编码基因)的重组质粒命名为pdbleu-rc160
‑△
bfos。将酵母重组表达载体pdbleu-rc160
‑△
bfos表达的融合蛋白命名为rc160
‑△
bfos。
105.二、转化受体酵母细胞
106.将步骤一构建的ppc86-rn159-bjun、ppc86-bjun-rn159和pdbleu-rc160-bfos、pdbleu-bfos-rc160载体两两配对组合转化受体酵母细胞ah109。转化时,具体是先采用以pdbleu-padh-linker为骨架载体的b载体(pdbleu-rc160-bfos或pdbleu-bfos-rc160)转化ah109酵母后,制备含有b载体的ah109酵母感受态,再转入以ppc86-padh-linker为骨架载体的a载体(ppc86-rn159-bjun或ppc86-bjun-rn159),当然可以调整a载体和b载体的导入顺序。
107.实验同时设置向受体酵母细胞ah109中转入ppc86-rn159-bjun和pdbleu-rc160
‑△
bfos的阴性对照。
108.三、荧光检测
109.将步骤二转化后所得的各转基因酵母细胞在缺陷型液体培养基sd-2(配方见上文)中30℃振荡培养24小时,然后转入4℃振荡培养24小时。收集各转基因酵母细胞,进行荧光检测。
110.1、荧光显微镜观察
111.取培养后收集的各转基因酵母细胞,采用dapi进行细胞核染色,然后进行荧光观察。
112.结果如图2中的a所示,由图可见,阳性试验组“ppc86-rn159-bjun+pdbleu-rc160-bfos”和“ppc86-bjun-rn159+pdbleu-bfos-rc160”的组合产生了很强的红色荧光。阴性实验组“ppc86-rn159-bjun+pdbleu-rc160
‑△
bfos”没有产生红色荧光。
113.2、流式细胞分析法
114.取培养后收集的各转基因酵母细胞,采用流式细胞仪分析产生红色荧光的酵母细胞。
115.结果如图2中的b所示,流式检测结果显示阳性试验组“ppc86-rn159-bjun+pdbleu-rc160-bfos”和“ppc86-bjun-rn159+pdbleu-bfos-rc160”的组合其荧光细胞比例分别达到了23.0%和25.2%。而阴性实验组荧光细胞的比例仅为本底的0.37%。
116.由以上结果,可见本发明实施例1建立的bifc系统可用于检测两个目的蛋白是否存在相互作用。
117.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本申
请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1