3-甲氧基酪胺的检测试剂及检测方法与流程
1.本发明涉及生化检测技术领域,尤其涉及3-甲氧基酪胺的检测试剂及检测方法。
背景技术:
2.嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,ppgl)是继发性高血压的病因之一,近年来其患病率呈上升趋势。3-甲氧酪胺(3-methoxytyramine,3-mt)能够作为ppgl的检测标志物,为ppgl的诊断和鉴别良、恶性提供一定的帮助。并且,3-mt被认为是识别嗜铬细胞瘤有无转移的重要标志。
3.目前3-mt的市场主流检测方法主要包括高效液相色谱法(hplc)、高效液相电化学联用(hplc-edc)、酶联免疫吸附测定(elisa)等,但hplc检测时间长、成本高,不同实验室条件差别大较难实现批量测定,酶联免疫测定法准确性和再现性较差,且自动化程度低、易受环境影响,灵敏度较低。
4.磁性微球是一类球形复合材料,直径为纳米或微米级。具有大的比表面积、高分散稳定性、超顺磁性、功能基团、生物相容等特性,被广泛应用于细胞分离和提纯、免疫检测、核酸分析和免疫工程、作靶向释药的载体等领域。化学发光免疫分析是免疫反应的酶作用于发光底物,使之发生化学反应并释放出大量的能量,产生激发态的中间体。这种激发态中间体回到稳定的基态时,可同时发射出光子。利用发光信号检测仪器即可测量出光量子产额,该光量子产额与样品中的待测物质的量成正比,由此可以建立标准曲线并计算样品中待测物质的含量。磁性微球可以作为固相支持物被广泛应用于化学发光免疫分析法中。
5.磁微粒化学发光免疫分析法具有准确性高、灵敏度高的特点,但该方法对于检测样品要求较高,血液或尿液样品无法直接以磁微粒化学发光免疫分析法检测其中的3-mt,而前处理的酰化过程过长无疑加大了检测的时间成本。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供3-甲氧基酪胺的检测试剂及检测方法。
7.本发明提供的样品前处理试剂组合,其包括:酸化液、衍生化试剂和酰化缓冲液,其中:
8.所述酸化液为盐酸溶液或硫酸溶液;
9.所述衍生化试剂中包括酸酐或甲基-peg4-nhs酯;
10.所述衍生化缓冲液选自tris缓冲液、pbs缓冲液、碳酸缓冲液中任一种。
11.本发明所述酸化液为浓度为0.1mol/l~0.5mol/l的盐酸溶液,ph值<1。
12.一些实施例中,所述盐酸溶液的浓度为0.2mol/l的盐酸溶液,ph值<1。
13.或者本发明所述酸化液为浓度为0.1mol/l~0.5mol/l的硫酸溶液,ph值<1。
14.一些实施例中,所述硫酸溶液的浓度为0.2mol/l的盐酸溶液,ph值<1。
15.本发明尝试以柠檬酸、硝酸、硫酸和盐酸对样品进行酸化处理,结果表明柠檬酸、
硝酸的酸化效果不及硫酸和盐酸。其中效果最好的是盐酸,特别是0.2mol/l的盐酸溶液。
16.本发明所述衍生化试剂为液态的酸酐。一些实施例中,所述酸酐为己酸酐或辛酸酐。
17.或者本发明所述的衍生化试剂为浓度为40mg/ml~200mg/ml的甲基-peg4-nhs酯。
18.本发明对多种衍生化试剂进行尝试,结果表明酸酐的衍生化效果优于甲基-peg4-nhs酯。酸酐中的己酸酐或辛酸酐的衍生化效果较好,其中己酸酐的效果优于辛酸酐。
19.本发明中,所述衍生化缓冲液的ph值为8~9。
20.本发明中,所述衍生化缓冲液中还包括质量分数为1%防腐剂。
21.一些实施例中,所述防腐剂选自proclin300、bronidox、nan3中至少一种。
22.本发明中,所述酸化液、衍生化试剂和酰化缓冲液的体积比为250∶250∶25。
23.本发明还提供了一种尿液的前处理方法,其以本发明所述样品前处理液对尿液进行处理。
24.本发明所述前处理方法包括将尿液与酸化液混合,85~95℃酸化20~40min,加入衍生化缓冲液和衍生化试剂振荡反应1~10min。
25.一些实施例中,所述前处理方法包括将尿液以酸化液混合,90℃酸化30min,加入衍生化缓冲液和衍生化试剂振荡反应5min。
26.本发明中,所述尿液与酸化液的体积比为50∶(200~300)。一些实施例中,所述尿液与酸化液的体积比为50∶250。
27.本发明中,所述酸化后溶液与衍生化缓冲液和衍生化试剂的体积比为(250~350)∶(200~300)∶(20~30)。一些实施例中,所述酸化后溶液与衍生化缓冲液和衍生化试剂的体积比为300∶250∶25。
28.本发明还提供了一种3-甲氧基酪胺的检测试剂,其包括本发明所述的前处理试剂组合、表面包被3-甲氧基酪胺衍生化抗原的磁微粒混悬液、辣根过氧化物酶标记的衍生化3-甲氧基酪胺抗体。
29.本发明还提供了一种3-甲氧基酪胺的检测方法,其包括:将经所述前处理方法处理后的尿液与磁微粒混悬液和酶标抗体混合后,分离磁珠进行检测;
30.所述磁微粒混悬液表面包被3-甲氧基酪胺衍生化抗原;
31.所述酶标抗体为辣根过氧化物酶标记的衍生化3-甲氧基酪胺抗体。
32.本发明提供的前处理试剂能够快速对前处理样品进行处理,首个结果检测仅需要30min,之后每测试间隔18秒出结果,大幅提高检测效率。并且该试剂对样品的前处理质量较高,从而使检测结果具有更高的灵敏度和特异性以及重复性,大大提高临床符合率。
附图说明
33.图1示本发明试剂盒与lc-ms/ms相关性。
具体实施方式
34.本发明提供了3-甲氧基酪胺的检测试剂及检测方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳
实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
35.本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
36.实施例1
37.前处理试剂配制:
38.酸化液:所述强酸包括0.2mol/l盐酸溶液,ph<1;
39.酰化缓冲液:含有0.1wt%的防腐剂的tris缓冲液(浓度为0.05m~0.5m),ph值为8~9。防腐剂为proclin300、bronidox或nan3对结果不产生影响;
40.衍生化试剂:25μl的己酸酐。
41.实施例2
42.前处理试剂配制:
43.酸化液:所述强酸包括0.2mol/l盐酸溶液,ph<1;
44.酰化缓冲液:含有0.1wt%的防腐剂的pbs缓冲液(浓度为0.05m~0.5m),ph值为8~9。防腐剂为proclin300、bronidox或nan3对结果不产生影响;
45.衍生化试剂:25μl的辛酸酐。
46.实施例3
47.前处理试剂配制:
48.酸化液:所述强酸包括0.2mol/l硫酸溶液,ph<1;
49.酰化缓冲液:含有0.1wt%的防腐剂的碳酸缓冲液(浓度为0.05m~0.5m),ph值为8~9。防腐剂为proclin300、bronidox或nan3对结果不产生影响;
50.衍生化试剂:浓度为40mg/ml的甲基-peg4-nhs酯。
51.对比例1
52.前处理试剂配制:
53.酸化液:所述强酸包括0.2mol/l硝酸溶液,ph<1;
54.酰化缓冲液:含有0.1wt%的防腐剂的tris缓冲液(浓度为0.05m~0.5m),ph值为8~9。防腐剂为proclin300、bronidox或nan3对结果不产生影响;
55.衍生化试剂:25μl的己酸酐。
56.对比例2
57.前处理试剂配制:
58.酸化液:所述强酸包括0.2mol/l柠檬酸溶液,ph<1;
59.酰化缓冲液:含有0.1wt%的防腐剂的tris缓冲液(浓度为0.05m~0.5m),ph值为8~9。防腐剂为proclin300、bronidox或nan3对结果不产生影响;
60.衍生化试剂:25μl的己酸酐。
61.实施例4
62.3-mt检测试剂盒包括实施例1~3任一项所述的前处理试剂组合。
63.并且包含:校准品、磁微粒混悬液(包被3-mt衍生化抗原)、辣根过氧化物酶标记的特异性识别衍生化的3-甲氧基酪胺抗体。
64.制备方法包括:
65.1、制备校准品
66.配制好的柠檬酸缓冲液(ph2-4)缓冲液,所述稀释液中的防腐剂为proclin300、mit(2-甲基-4-异噻唑啉-3-酮盐酸盐)、nan3(叠氮化钠)的任意一种或两种组合,为校准品稀释液,用校准品稀释液将3-mt抗原稀释成6个梯度,0ng/ml、30ng/ml、90ng/ml、270ng/ml、810ng/ml、2430ng/ml,分装成1ml/瓶,2~8℃保存。
67.2、制备磁微粒混悬液
68.固相化抗原的制备:本发明中所用的固相化的竞争3-mt抗原包括但不限于使用琥珀酸酐、甲基-peg2-nhs酯、甲基-peg8-nhs酯进行衍生化(衍生化竞争抗原与检测抗原应搭配使用,该检测试剂所选抗体对己酸酐、辛酸酐、甲基-peg4-nhs酯衍生化的3-mt亲和力较强,对琥珀酸酐、甲基-peg2-nhs酯、甲基-peg8-nhs酯衍生化的3-mt亲和力相对较弱,因此使用琥珀酸酐、甲基-peg2-nhs酯或甲基-peg8-nhs酯衍生化的固相竞争抗原,搭配所选择的抗体,实现对衍生化的3-mt的检测)。其中,所用的稀释缓冲液为bis-tris(双(2-羟甲基)氨基-三(羟甲基)甲烷)、tris-nacl(三羟甲基氨基甲烷-氯化钠)、pbs(磷酸盐缓冲液)中的任一种,其ph=6.0~8.0;所述稀释液中添加牛血清白蛋白、牛血清、酪蛋白中的一种或两种作为本试剂的保护蛋白。所述稀释液中的防腐剂为proclin300、mit(2-甲基-4-异噻唑啉-3-酮盐酸盐)、nan3(叠氮化钠)的任意一种或两种组合。
69.固相化竞争抗原的制备:采用磁微粒包被,将磁微粒原液充分混匀后,按照每人份0.1-0.3μl每人份取磁珠原液,以100人份进行包被,加入200-400μl的磷酸盐缓冲液清洗3-5次,然后使用磁铁将磁微粒吸附固定弃去上清;洗涤后,加入20mg/ml的edc(碳化亚二胺)、nhs(琥珀酰亚胺酯)活化剂,在加入20μl 5mg/ml的bsa,混匀震荡活化1-3h;活化后使用ph=4.5醋酸钠缓冲液进行洗涤2次,每次洗涤5min,然后按照0.02-0.2μg/t添加衍生化的3-mt抗原进行包被,混匀震荡包被2h,然后使用磁铁将磁微粒吸附固定弃去上清,加入200-400μl含有2%保护蛋白的磷酸盐缓冲液封闭4次,最后使用含有2%保护蛋白的磷酸盐缓冲液定容至2ml,2~8℃保存备用。
70.3、制备酶标记抗体溶液:向配制好的tris-nacl缓冲液、pbs、bis-tris中的一种加入2%牛血清白蛋白,混合后即为辣根过氧化物酶标记的特异性识别衍生化的3-甲氧基酪胺抗体溶液稀释液,将3-mt分子的特异性抗体按照0.05~1μg/ml的浓度混匀,2~8℃保存。
71.实施例5
72.以实施例1~3和对比例1~2所述试剂对尿液样品进行前处理:具体前处理方法如下:
73.取尿液标本50μl于带盖容器中(体积2~10ml),加入250μl酸化液,90℃水浴酸化30min,取出,自然冷却,再加入250μ1的酰化缓冲液、25μ1衍生化试剂,震荡反应5min,得到衍生化的待检抗原。对处理后的抗原进行检测。
74.检测方法包括:
75.衍生化的待检抗原50μl+磁微粒混悬液(包被3-mt衍生化抗原)20μl+辣根过氧化物酶标记的特异性识别衍生化的3-甲氧基酪胺抗体震荡反应30min,使用磁铁固定磁微粒,去上清,清洗5次,加入底物,酶催化底物发光,配套化学发光仪,检测信号值,首个结果检测仅需要30min,之后每测试间隔18秒出结果。通过校准品,利用四参数,回算尿液标本浓度。
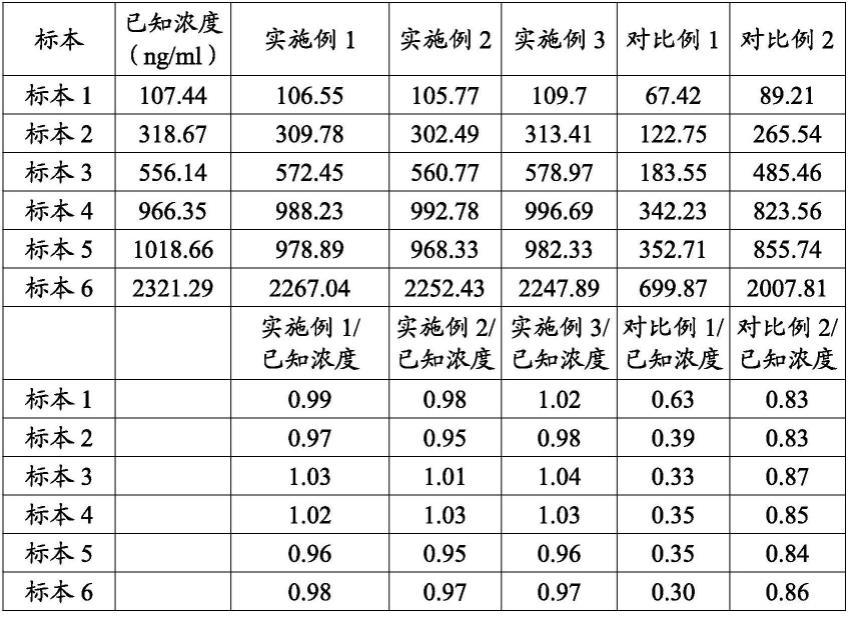
76.表1检测结果
[0077][0078]
结果表明:使用实施例1~3得到的检测结果与已知浓度基本一致,偏差均小于或等于5%,对比例1~2检测结果较已知浓度偏低,不能对标本进行完全处理。
[0079]
效果验证
[0080]
1、分析灵敏度检测
[0081]
采用实施例1提供的前处理试剂,参照实施例5所述的方法,根据《ep17a-确定检出限制和定量限值的协议》进行分析灵敏度考核,准备5份接近0值的临床尿液样本,每个样本重复3次,总共做4天,得到60个结果非负数的数据,若不足60个,需要按要求实验并补足60个,记录数据,计算分析灵敏度。
[0082]
[0083][0084]
按照i型错误为5%的容忍度,依据ep17方法,使用excel数据模板计算出其分析灵敏度2.425ng/ml。
[0085]
2、精密度检测
[0086]
根据《ep05-a3》进行精密度评估,取3-mt试剂,使用配套高/中/低值质控品,重复检测20次,记录数据,计算结果如表2所示。
[0087]
表2本发明试剂盒精密性检测
[0088]
[0089][0090]
由表2可知,所建立的检测方法,三浓度水平变异均小于3%,具有较好的精密性。
[0091]
3、临床比对
[0092]
用本发明试剂盒检测已知浓度(lc-ms/ms定值)的45例临床尿液样本,其相关性见图1:y=0.8925x+33.45,r2=0.9961,说明本试剂盒可以准确检测人尿液中的3-mt。
[0093]
4、稳定性评估
[0094]
考核检测试剂稳定性,取试剂,放置于37℃温箱内加速10d,取出,另取2-8℃保存试剂,同时检测相同临床尿液标本,检测结果如表3所示。
[0095]
表4本发明试剂盒稳定性检测
[0096][0097][0098]
由表4可知,所建立的检测方法,37℃保存10d较2-8℃降幅小于10%,具有较好的稳定性。
[0099]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来
说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1