一种新的基于NanoSPR技术的生物传感芯片的检测方法及应用与流程
一种新的基于nanospr技术的生物传感芯片的检测方法及应用
技术领域
1.本发明属于人/动物体内抗体定性定量检测技术领域,特别是基于纯nanospr技术的快速检测人/动物体内抗体的方法。
背景技术:
2.非洲猪瘟(asf)是一种传染性极强的病毒性疾病,影响家猪和野猪,死亡率高,传播迅速,造成巨大的社会经济损失。其病原是一种大而有包膜的dna病毒,即asf病毒(asfv)。目前,还没有批准的疫苗或针对asfv的有效治疗方法。因此,疾病控制主要依靠早期诊断,及时扑杀感染猪,提高生猪行业的生物安全控制。感染asfv,尤其是亚急性感染后,存活的猪可能会检测到asfv抗体水平。因此,它是在受asf影响的地方性流行地区检测asfv抗体的良好标志物。抗体检测经济,与自动化设备兼容,适用于高通量筛选。由于目前还没有商业疫苗可用,因此在这种情况下,抗体仍然是asfv感染的明确指标。因此,开发一种用于asfv监测的快速抗体检测方法在该领域具有重要意义。
3.纳米等离子芯片技术(nanospr)不同于等离子芯片技术(spr)和局部表面等离子体共振技术(lspr)两种技术模式,由于其独特的三维结构,不同于平面模型的spr效应,也不同于金属纳米颗粒的lspr效应,可以同时支持spr与lspr两种模式。
4.纳米孔阵列生物传感器的等离子共振效应可以直接入射到纳米孔金属结构,表面光场立即激发,因此不需要复杂的光路和大型光学仪器的支持。nanospr技术既保留了传统spr传感器的实时、无需标记、无背景干扰、高分辨率等诸多优点,又保留了lspr传感器在性能改造上的优势;通过对纳米孔阵列的孔径、深度、形状、周期以及表面金属的类型、厚度等参数的调节,选择出可以捕捉到存在lspr最强信号的高品质芯片,无需大型光谱仪也可以得到更强的信号。
5.目前,基于金纳米颗粒、乳胶微球或荧光染料微球的侧向流动免疫层析条被设计用于现场检测血清中的asfv抗体。而其灵敏度和稳定性定量仍有待进一步提高,而且无法准确量化asfv的抗体含量。基于taqman的实时定量pcr(rt-pcr)和elisa是欧盟参考实验室和oie中使用最广泛的基于实验室免疫学的诊断方法,因为它们具有高灵敏度。遗憾的是,上述方法不能广泛应用于养猪场的快速检测领域。近年来,一些先进的技术,如等温扩增、侧流色谱和微流控芯片,已被用于检测asfv。但诊断技术产品都不能满足早期、灵敏、定量现场诊断的需求。
6.所以我们开发了一种新的基于nanospr技术的生物传感芯片检测asfv非洲猪瘟抗体。
技术实现要素:
7.为了满足上述非洲猪瘟asfv抗体诊断技术的要求,本发明提供了一种基于纯nanospr技术的生物传感芯片,用于超灵敏定量检测血清中的asfv抗体。具有较高的检测灵
敏度,采用该生物传感芯片检测非洲猪瘟抗体等其他抗体具有高通量、耗时短,检测结果准确,即时检测(poct)的潜力等优点,无需标记,通过二抗夹心法直接放大待测物抗体,可用于高通量定量或筛选质控。具体通过以下技术实现。
8.基于nanospr技术的生物传感芯片,包括基片和修饰在所述基片上的蛋白、抗体或功能基团;所述基片从下至上依次包括基底、钛膜、银膜和/或金膜,所述基底表面压印矩阵排列的纳米孔;所述纳米孔直径为50-800nm,高度为100-800nm,相邻两个所述纳米孔的间距为200-1000nm;所述钛膜的厚度为2-20nm,所述银膜的厚度为8-80nm,所述金膜的厚度为5-50nm;所述蛋白、抗体或功能基团具体是指与病毒抗体特异性结合的蛋白、抗体、适配体或功能基团。例如可以结合非洲猪瘟病毒抗体的p30蛋白、p54蛋白;可以结合非洲猪瘟病毒抗体的羊抗猪-igg(北京博奥龙)、protein a(义翘神舟)、羊抗猪-igg(安提)、兔抗猪-igg(博尔西)。
9.优选地,所述钛膜的厚度为10nm,所述银膜的厚度为80nm,所述金膜的厚度为15nm。
10.本发明还提供了上述基于nanospr技术的生物传感芯片的修饰制备方法,包括以下步骤:
11.s1、清洗所述基片,滴加5-50μg/ml p30蛋白和/或p54蛋白溶液1-50μl;4-37℃孵育1.5-24h,再用pbst溶液多次清洗已包被p30蛋白和/或p54蛋白的基片;
12.s2、在步骤s1所得基片表面滴加封闭液,25-37℃孵育1-4h,去除多余封闭液;
13.s3、在步骤s2所得基片表面滴加保护液,25-37℃孵育0.5-1h,去除多余保护液,干燥后制得生物传感芯片。
14.所述封闭液是将牛血清白蛋白溶解于cbs溶液中配制而成的浓度10μg/ml的复合液;所述cbs溶液中含有碳酸钾4-6g/l、碳酸氢钠7.5-10g/l、防腐剂proclin300 2.5-5ml/l;
15.所述保护液是将糖类溶解于pbst溶液中配制而成的浓度10-200μg/ml的复合液;所述糖类为葡聚糖、葡萄糖、蔗糖、海藻糖中的一种;
16.优选地,所述pbst溶液中含有十二水磷酸氢二钠2-3g/l、磷酸二氢钠0.2-0.5g/l、氯化钾0.1-0.3g/l、氯化钠6-8g/l、tween-20 0.5-1ml/l、防腐剂proclin300 0.5-1ml/l。
17.本发明还提供了一种芯片微孔板,该芯片微孔板集成了上述生物传感芯片。该芯片微孔板可以选用1孔
…
48孔、96孔等各种不同种类的微孔板。
18.本发明还提供了一种基因递送载体的检测试剂盒,该试剂盒包括上述生物传感芯片,或者包括上述芯片微孔板。该试剂盒可以基于不同的检测方法(无标记检测、夹心法),配备其他不同的试剂。
19.优选地,上述检测试剂盒还包括洗涤液、抗体纯化参考品、非洲猪瘟血清样品。羊抗猪igg抗体、p30蛋白和/或p54蛋白分别能在非洲猪瘟抗体的不同表位与之结合。
20.利用上述芯片微孔板或检测试剂盒检测待测样品中的基因递送载体浓度的一种使用方法,该方法不需要使用胶体金等发光试剂,而是直接将芯片微孔板插入全光谱酶标仪中进行检测,对抗体检测具有非常好的灵敏度和特异性,具体方法为:
21.p1、将含有非洲猪瘟抗体的猪血清或者抗凝剂(肝素/edta/柠檬酸钠)制备的血浆样本10~1000倍稀释,在芯片微孔板的每孔中加入30~50μl,振板反应10~60min;
22.p2、弃去孔内液体,分别加入30~150μl pbst洗涤液,洗板、拍板、甩干,重复2次;
23.p3、在孔中加入30~50μl pbst稀释液,放入酶标仪中,记录初始值;
24.p4、弃去步骤p3孔内液体,加入5~40ug/ml的二抗稀释液30~50μl,振板反应10min后放入酶标仪中,记录终点值,获得定性定量分析;待测物抗体与芯片上孵育的蛋白在结合反应前后同一波长段的全光谱会产生位移变化,对位移前后光谱值做差值,出现波峰波谷的波形图。无需使用辣根过氧化物酶(hrp)标记抗体,仅通过nano spr芯片产生的光谱变化就可以检测出是否有抗体结合在芯片表面。
25.二抗稀释液包括10mm、ph6-9的tris/nacl、0.01-1wt.%tw20、0.05-5%wt.bsa/血清+0.1-10wt.%海藻糖/葡萄糖/蔗糖+0.01-1wt.%peg2w/peg6k;本稀释液可以抑制血清中的杂蛋白带来的非特异性反应,同时,保护样品中非洲猪瘟抗体的稳定性,并通过peg6000或peg20000等促聚剂促进抗体与芯片表面的抗体结合。
26.p5、另取按照步骤p1操作后的新的芯片微孔板,重复按照步骤p2-p4的操作方法在芯片微孔板的每孔中分别加入30~200μl稀释后的待测样本,再次记录终点值,根据阴参、阳参规定的cutoff值,即可得到待测样本的定性定量分析。
27.上述这种检测方法,所用的待测样本可以从人或动物的血清中采集,用以检测病毒抗体浓度。因此不论是以诊断、治疗为目的,还是以非诊断、治疗为目的,都可以采用上述方法对病毒进行定性定量和定量检测,并具有非常好的灵敏度和特异性。
28.样品稀释液包括10mm、ph6-9的tris/nacl、0.01-0.1wt.%tw20、0.05-5%wt.bsa/血清+0.01-1wt.%peg2w/peg6k。
29.与现有技术相比,本发明的有益之处在于:本发明基于nanospr技术,提供了一种能够用于检测基因递送载体的生物传感芯片,还提供了一种集成了上述生物传感芯片的芯片微孔板,还提供了相应的检测试剂盒。采用本发明提供的生物传感芯片、芯片微孔板和检测试剂盒,只需要一步即可完成抗体的检测,检测灵敏度高,检测限低,检测速度快且高通量,可用于基因递送领域的高通量定量或筛选质控。
附图说明
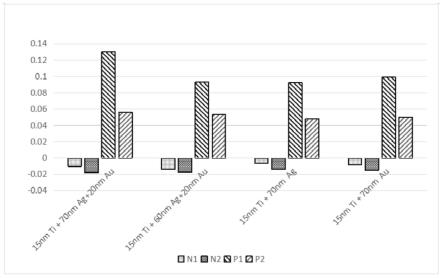
30.图1实施例1使用四种参数的芯片检测4种样本;
31.图2实施例2的11例样本在560-640nm的全光谱图;
32.图3实施例2的11例样本在590nm的吸光度减去570nm的吸光度;
33.图4实施例3的11例样本在560-640nm的全光谱图;
34.图5实施例3的11例样本在590nm的吸光度减去570nm的吸光度;
35.图6实施例4的五种二抗的三例样本在560-640nm的全光谱图;
36.图7实施例4的五种二抗的三例样本在590nm的吸光度减去570nm的吸光度;
37.图8实施例5的在在560-640nm不同稀释梯度的全光谱图;
38.图9实施例5稀释梯度:横坐标代表阴参、阳参和不同梯度稀释的776阳性非洲猪瘟样本,纵坐标代表od值(吸光度);
39.图10实施例5标准曲线:横坐标代表不同浓度样品,纵坐标代表od值(吸光度);
40.图11实施例6roc曲线;
41.图12对比例1的11例样本在560-640nm的全光谱图;
42.图13对比例1的11例样本在590nm的吸光度减去570nm的吸光度;
43.其中:图2、4、6、8、12:横坐标代表560-640nm的波长,纵坐标代表od值(吸光度);图3、5、7、13:横坐标为阴参、阳参、样本,纵坐标代表od值(吸光度)。
具体实施方式
44.下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
45.以下实施例和对比例中,所用的双qdm重组病毒蛋白30和54(p30和p54)采购自科前公司,protein a蛋白、羊抗猪igg抗体、鼠抗猪igg抗体采购自北京义翘神舟公司;牛血清白蛋白采购自武汉千泽穗生物科技有限公司;保护液是将蔗糖溶解在pbst溶液中配制而成,浓度为100μg/ml。所用的p30蛋白、p54蛋白溶液是将上述p30蛋白、p54蛋白用cbs溶液稀释至相应的浓度后制备而成。
46.pbst溶液的原料和配制方法为:十二水磷酸氢二钠2.5g/l、磷酸二氢钠0.3g/l、氯化钾0.2g/l、氯化钠7.5g/l、tween-20 0.8ml/l、防腐剂proclin3000.8ml/l,加双蒸水混合搅拌均匀即可。
47.cbs溶液由碳酸钾5.5g/l、碳酸氢钠8.5g/l、防腐剂proclin300 4ml/l,加纯化水混合搅拌配制而成。
48.洗涤液选用pbst溶液;非洲猪瘟抗体样本采购自科前生物科技有限公司。
49.实施例1:
50.使用四种参数的芯片检测4种样本(两个阴性样本+两个阳性样本),如图1所示,横坐标代表四种不同厚度的芯片:
51.15nm ti+70nm ag+20nm au;15nm ti+60nm ag+20nm au;15nm ti+70nm ag;15nm ti+70nm au;
52.纵坐标代表od值(吸光度)。
53.本发明芯片一定要有ti层或tio2层连接,否则芯片上的金属会因没有黏合(连接)层导致金属的脱落。
54.实施例2:使用p30蛋白包被芯片微孔板进行一步式无标记法检测非洲猪瘟抗体
55.本实施例中,纳米等离子共振生物芯片的芯片微孔板(96孔)的制备方法为:(1)在氧化硅片上进行光刻即可制作出纳米孔模具;(2)通过纳米压印方法将12寸硅晶圆纳米模具上的纳米结构转印到高分子柔性材料基底(pet薄板基底)上形成反相的晶圆级纳米器件结构;(3)在其表面依次镀上钛膜层(厚度为10nm)、银膜层(厚度为80nm)、金膜层(厚度为15nm),即变为集成了等离子体传感芯片基片的96孔芯片微孔板;
56.1、修饰制备生物传感芯片
57.(1)清洗所述基片,滴加8μg/ml p30蛋白溶液50μl,37℃孵育2h,再用pbst溶液多次清洗已包被p30蛋白的基片;
58.(2)以150μl/孔的用量在基片表面滴加封闭液,37℃烘箱中孵育1h,用pbst溶液清洗去除多余封闭液;
59.(3)以150μl/孔的用量向步骤(2)的基片表面滴加保护液,37℃烘箱中孵育30min,
用pbst溶液清洗去除多余保护液,继续在37℃烘箱中放置10min,保证芯片表面干燥后,制得生物传感芯片。
60.2、无标记法检测血清样本定性样本抗体强弱
61.(1)使用移液器将含有非洲猪瘟猪血清50倍稀释,加入芯片微孔板的每孔50μl,振板反应20min;
62.稀释液配方为10mm的tris/nacl溶液、0.1wt.%tween20、5wt.%胎牛血清、1wt.%peg6k,ph值=7;
63.(2)弃去孔内液体,分别加入150μl pbst洗涤液,洗板、拍板、甩干,重复2次;
64.(3)在孔中加入50μl pbst稀释液,放入酶标仪中,记录初始值;
65.(4)弃去步骤(3)孔内液体,加入5ug/ml的二抗稀释液50μl,振板反应10min后放入酶标仪中,记录终点值,根据阴参、阳参规定的cutoff值,即可得到待测样本的定性定量分析。
66.二抗稀释液:10mmtris/nacl(ph7.3)+0.1wt.%tw20+0.1wt.%bsa+0.2wt.%蔗糖+0.05%peg2w
67.样本包含11例样本:6例阴性(包含3例特异性)+3例弱阳性+2例阳性如图2-3所示,检测结果11例样本:6例阴性+5例阳性,强阳弱阳样本统一检测为阳性样本,本次检测结果符合率高达约100%。
68.实施例3:使用p54蛋白包被芯片微孔板进行一步式无标记法检测非洲猪瘟抗体
69.本实施例与实施例2不同的是:(1)8μg/ml p54蛋白(科前公司);(2)芯片厚度15+70+20。
70.样本包含11例样本:6例阴性(包含3例特异性)+3例弱阳性+2例阳性
71.如图4-5所示,检测结果11例样本:7例阴性(1例弱阳性样本未检测准确)+4例阳性,本次检测结果符合率达约91%。
72.实施例4:使用5种不同检测抗体进行一步式无标记法检测非洲猪瘟抗体
73.与实施例1的
74.使用不同的猪二抗或蛋白:
75.(1)北京博奥龙羊抗猪-igg,10ug/ml用;
76.(2)义翘神舟公司proteina,10ug/ml用;
77.(3)安提鼠抗猪-igg,10ug/ml用;
78.(4)安提羊抗猪-igg,10ug/ml用;
79.(5)博尔西兔抗猪-igg,10ug/ml用;
80.如图6-7所示,选取三个样本(阴性+阳性+特异性)进行非洲猪瘟抗体的检测,编号为(1、2、4、5)的抗体或蛋白检测结果与实际结果相符合。其中,猪二抗(4),即安提的羊抗猪-igg有最好的检测结果。
81.实施例5:使用p30蛋白包被芯片,羊抗猪igg抗体作为二抗进行一步式无标记法检测非洲猪瘟抗体定量实验
82.在最佳实验条件下,使用p30蛋白(科前公司)包被芯片,羊抗猪igg抗体(北京博奥龙),通过nanospr传感器对1:256到1:16384不同稀释度的标准阳性血清进行测量。图9的od值为图8中每个释浓度的曲线波峰与波谷的差值;图10为检测非洲猪瘟抗体所获得的标准
曲线方程,标准曲线方程为,y=(a-d)/[1+(x/c)b]+d;a=0.15545,b=-0.68142,c=2.46710,d=-0.04771,r2=0.9977。
[0083]
实施例6:使用p30蛋白包被芯片,羊抗猪igg抗体作为二抗进行一步式无标记法检测非洲猪瘟抗体定量实验利用164个样本(146个阴性或特异性样本+18个阳性样本)做roc曲线,如图11所示。roc曲线图是反映敏感性与特异性之间关系的曲线。横坐标x轴为1
–
特异性,也称为假阳性率(误报率),x轴越接近零准确率越高;纵坐标y轴称为敏感度,也称为真阳性率(敏感度),y轴越大代表准确率越好。
[0084]
对比例1:
[0085]
与实施例3不同的是,本对比例更换样本稀释液与二抗稀释液配方均使用10mm的nacl溶液、0.1wt.%tween20、3wt.%胎牛血清、2wt.%peg2w,ph值=7;测试对比例1的11例样本在560-640nm的的全光谱图以及在590nm的吸光度减去570nm的吸光度。
[0086]
如图12-13所示,更换使用不同配方的样品稀释液以及二抗稀释液,降低了反应应有的灵敏度。即使强阳样本、特异性样本以及阴性样本均符合实验结果,但三例弱阳样本均没有被检测出,没有达到预期的检测效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1