一种缓冲液在胶质纤维酸性蛋白检测试剂盒中的应用的制作方法
1.本发明涉及检测技术领域,具体涉及一种缓冲液在胶质纤维酸性蛋白检测试剂盒中的应用。
背景技术:
2.创伤性脑损伤(tbi)是由外力引起的大脑损伤,会破坏大脑正常功能,导致人的认知能力或身体机能受损。在所有类型tbi中,最常见的后遗症为头痛(47.9%)和记忆异常(42%)(《英国神经外科杂志》,2018),约三成患者需要心理辅导或神经病学治疗。疑似tbi的医疗护理流程分为三步。首先是使用15分格拉斯哥昏迷量表(gcs)(美国外科医师学会创伤委员会,1997)对神经进行评估,以评定脑损伤严重度,然后进行结构性神经影像学检查,最常见的是通过头部ct扫描来可视化骨折和颅内病变。最后根据ct结果制定治疗方案、留院观察或出院。目前,ct扫描是广泛用于帮助临床医师评估tbi的唯一客观、简单且可靠的选择。然而,ct结果的正确性与ct设备的准确性及医师的阅片水平直接相关,和其他检测方法相比,是一种相对主观的判断方法。约90%轻度tbi(有时被称为“脑震荡”)的ct扫描结果呈阴性(toth,2015)。这些患者中只有不到1%的人需进行神经外科干预(papa l,2012)。鉴于这些患者的ct扫描阳性百分比非常低且不必要影像学检测可能会增加辐射诱发癌变的风险,寻找开发其他的脑损伤诊断方法来准确判断颅脑损伤程度和评估预后,具有巨大的临床意义和战略意义。
3.胶质纤维酸性蛋白(gfap)是一种ⅲ型中间纤丝蛋白。人的gfap由432个氨基酸组成,主要分布于中枢神经系统的星形胶质细胞,参与细胞骨架的构成并维持其张力强度。gfap是一种神经系统特异性蛋白。其在脑损伤中对神经系统功能的恢复有重要影响(梁彦涛,胶质纤维酸性蛋白基础与临床研究进展,2009)。在tbi中,gfap在1小时内会通过血脑屏障进入血液,导致血清gfap显著升高。对tbi的早期诊断,鉴别诊断和判断预后有重要的意义(刘霞,胶质纤维酸性蛋白的生物学特性及临床研究进展,2015),临床上主要用于脑外伤的辅助诊断。
4.现有技术中,关于胶质纤维酸性蛋白的检测方法具体如专利cn202011545701.5公开了一种用于胶质纤维酸性蛋白检测的磁微球电化学发光免疫检测试剂盒及其制备方法,该发明主要,采用吡啶钌作为化学发光标记物具有明显优势,主要表现在:稳定性更好,钌是金属离子,分子量小,不影响抗体的空间位阻。生产过程短,重复性好,检测范围宽。电化学发光反应可控,降低信号采集难度。专利cn201811391978.x公开了一种用于检测胶质纤维酸性蛋白(gfap)的磁微粒分离化学发光免疫测定法,该试剂盒组成包括:校准品、质控品试剂a、试剂b、清洗液浓缩液、发光底物液,其中,试剂a为含一定浓度磁微粒标记的胶质纤维酸性蛋白(gfap)抗体溶液;试剂b为含一定浓度碱性磷酸酶标记的胶质纤维酸性蛋白(gfap)抗体溶液;该发明能够极大地提高免疫反应的信号强度和灵敏度,使低含量物质在进行免疫结合时也能产生很强的化学发光信号,为人体胶质纤维酸性蛋白(gfap)的检测提供一种更准确、精确、方便、快捷和简单的方法。
5.本发明的目的是为了能够快速、简便地检测人外周血中胶质纤维酸性蛋白的含量,通过对缓冲液的优化,进而提供一种操作简便、能为创伤性脑损伤提供辅助诊断的体外诊断试剂盒及其制备方法和使用。
技术实现要素:
6.本发明针对现有技术存在的问题,提供了一种缓冲液在胶质纤维酸性蛋白检测试剂盒中的应用,通过对缓冲液的优化,进而将其应用至胶质纤维酸性蛋白检测试剂盒中,从而快速、简便地检测人外周血中胶质纤维酸性蛋白的含量。
7.为实现上述目的,本发明采用的技术方案如下:
8.本发明提供了一种缓冲液,包括:4-羟乙基哌嗪乙磺酸、氯化钠、牛igg、缓冲液3、缓冲液4、酶水解明胶、蛋白稳定剂、月桂醇聚氧乙烯醚、生物防腐剂;所述缓冲液3包括六水合氯化镁;所述缓冲液4包括氯化锌。
9.进一步地,所述的缓冲液,包括4-羟乙基哌嗪乙磺酸5.6-9g/l、氯化钠9g/l、牛igg5-30g/l、缓冲液31-10ml/l、缓冲液41-10ml/l、酶水解明胶1-20g/l、蛋白稳定剂30-120ml/l、月桂醇聚氧乙烯醚0.2-5g/l、生物防腐剂1ml/l。
10.优选地,所述的缓冲液,包括4-羟乙基哌嗪乙磺酸5.7g/l、氯化钠9g/l、牛igg15g/l、缓冲液33ml/l、缓冲液43ml/l、酶水解明胶15g/l、蛋白稳定剂50ml/l、月桂醇聚氧乙烯醚3g/l、生物防腐剂1ml/l。
11.进一步地,所述牛igg、酶水解明胶、月桂醇聚氧乙烯醚的重量比为5-30:1-20:0.2-5。
12.优选地,所述牛igg、酶水解明胶、月桂醇聚氧乙烯醚的重量比为5:5:1。
13.本发明还提供了一种试剂盒,包括包被板、试剂a、校准品、质控品、清洗浓缩液、显色液、终止液;
14.所述试剂a具体使用权利要求上述的缓冲液与酶标记gfap抗体偶联物混匀配制而成。
15.进一步地,所述清洗浓缩液为缓冲液13,所述缓冲液13包括:三羟甲基氨基甲烷、氯化钠、非离子型表面活性剂。
16.进一步地,所述校准品和质控品的制备方法均为:使用缓冲液11将gfap重组蛋白溶解,充分混合后,配制。
17.进一步地,所述缓冲液11包括三羟甲基氨基甲烷、牛血清白蛋白、甘氨酸。
18.进一步地,所述酶标记gfap抗体偶联物的制备方法包括以下步骤:
19.(1)抗体1活化:将缓冲液6加入至gfap抗体1溶液中进行活化,混匀;
20.(2)hrp活化:将hrp溶解后加入缓冲液2,混匀;再加入缓冲液5,离心,弃去上清液,收集浓缩液,即得hrp溶液;
21.(3)抗体1与hrp连接:向步骤(1)得到的活化后的gfap抗体1溶液中加入步骤(2)得到的hrp溶液,混匀后加入缓冲液6,得到酶标记gfap抗体偶联物溶液;
22.(4)抗体偶联物的终止和纯化:将酶标记gfap抗体偶联物溶液和缓冲液7混合后,混匀反应,再加入缓冲液8,离心,弃去上清后,收集浓缩液,即得gfap抗体偶联物,向抗体偶联物中加入甘油、牛血清白蛋白,充分混匀后,保存。
23.进一步地,所述缓冲液6包括碳酸钠、碳酸氢钠,所述缓冲液2包括高碘酸钠,所述缓冲液5包括乙酸,所述缓冲液7包括硼氢化钠;所述缓冲液8包括十二水合磷酸氢二钠、磷酸二氢钠、氯化钠、氯化钾。
24.进一步地,所述包被板包括抗体2,所述抗体2包被以及封闭包括以下步骤:
25.s1:抗体2前处理:向抗体2溶液中加入缓冲液8,离心弃去上清后,收集浓缩液;
26.s2:抗体2的包被和封闭:将步骤s1处理后的抗体2使用缓冲液8稀释,加入至微孔板,反应后弃去各孔反应液,加入缓冲液9,反应;
27.s3:抗体2包被板的清洗和保存:步骤s2的反应结束后,弃去各孔反应液,加入缓冲液10,均匀震荡,弃去反应液,反应后保存。
28.进一步地,所述缓冲液9包括三羟甲基氨基甲烷、牛血清白蛋白、甘氨酸、蔗糖、非离子型表面活性剂、生物防腐剂;所述缓冲液10包括:三羟甲基氨基甲烷、氯化钠、非离子型表面活性剂。
29.本发明中涉及的缓冲液的配方以及制备方法具体如下所示:
30.①
缓冲液1
31.称取2.0-3.8g的na2hpo4·
12h2o、0.01-0.8g的nah2po4加入到一定量的纯化水中搅拌至完全溶解,调试ph值在6.5~7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
32.表1缓冲液1配方
33.原料名称称取量十二水合磷酸氢二钠2.0-3.8g磷酸二氢钠0.01-0.8gph值6.5-7.6纯化水定容至1000ml
34.②
缓冲液2
35.称取10-28g的naio加入到一定量的缓冲液1中搅拌至完全溶解,调试ph值在6.5~7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
36.表2缓冲液2配方
[0037][0038][0039]
③
缓冲液3
[0040]
称取203.3g的mgcl2·
6h2o加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0041]
表3缓冲液3配方
[0042]
原料名称称取量六水合氯化镁203.3g
纯化水定容至1000ml
[0043]
④
缓冲液4
[0044]
称取136.3g的zncl2加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0045]
表4缓冲液4配方
[0046]
原料名称称取量氯化锌136.3g纯化水定容至1000ml
[0047]
⑤
缓冲液5
[0048]
称取0.02-0.57g的ch cooh加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0049]
表5缓冲液5配方
[0050]
原料名称称取量乙酸0.02-0.57g纯化水定容至1000ml
[0051]
⑥
缓冲液6
[0052]
称取8.5-52g的na2co3、14-86g的nahco3加入到一定量的纯化水中搅拌至完全溶解,调试ph值在9.0~10.0之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0053]
表6缓冲液6配方
[0054][0055][0056]
⑦
缓冲液7
[0057]
称取1-5mg的nabh4加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0058]
表7缓冲液7配方
[0059]
原料名称称取量硼氢化钠1-5mg纯化水定容至1000ml
[0060]
⑧
缓冲液8
[0061]
称取2.0-3.8g的na2hpo4·
12h2o、0.01-0.8g的nah2po4、6-10g的nacl、0.1-0.6g的kcl加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.8之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0062]
表8缓冲液8配方
[0063]
原料名称称取量十二水合磷酸氢二钠2.0-3.8g磷酸二氢钠0.01-0.8g氯化钠6-10g氯化钾0.1-0.6gph值7.0-7.8纯化水定容至1000ml
[0064]
⑨
缓冲液9
[0065]
称取1.0-1.5g的tris、5.0-50g的牛血清白蛋白、5.0-40g的甘氨酸、2-15g的蔗糖、2ml的非离子型表面活性剂、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.5~8.5之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0066]
表9缓冲液9配方
[0067][0068][0069]
进一步地,所述非离子型表面活性剂包括吐温系列(吐温20/40/60/80)、曲拉通x100/114;生物防腐剂为proclin-300。也可替换为其他防腐剂,包括proclin-300、叠氮钠、庆大霉素、硫酸新霉素。除proclin-300外其余均为固体,添加量不超过0.5%(w/v)。
[0070]
⑩
缓冲液10
[0071]
称取1.0-1.5g的tris、9g的nacl、0.2-5ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.5之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0072]
表10缓冲液10配方
[0073]
原料名称称取量三羟甲基氨基甲烷1.0-1.5g氯化钠9g非离子型表面活性剂0.2-5mlph值7.0-7.5纯化水定容至1000ml
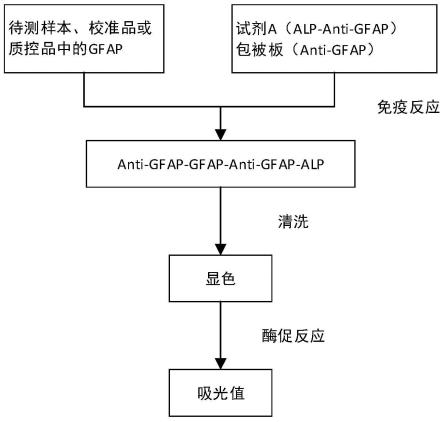
[0074]
缓冲液11
[0075]
称取12.0-15.0g的tris、5.0-50g的牛血清白蛋白、1.0-30g甘氨酸加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.6~8.8之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0076]
表11缓冲液11配方
[0077]
原料名称称取量三羟甲基氨基甲烷12.0-15.0g牛血清白蛋白5.0-50g甘氨酸1.0-30gph值7.6-8.8纯化水定容至1000ml
[0078]
缓冲液12
[0079]
称取2.3-23.8g的hepes、9.0g的nacl、5.0-30g的牛igg、1-10ml的缓冲液3、1-10ml的缓冲液4、1-20g的酶水解明胶、30-120ml的蛋白稳定剂、0.2-5g的月桂醇聚氧乙烯醚、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0080]
表12缓冲液12配方
[0081]
原料名称称取量4-羟乙基哌嗪乙磺酸5.6-5.9g氯化钠9.0g牛igg5.0-30g缓冲液31-10ml缓冲液41-10ml酶水解明胶1.0-20g蛋白稳定剂30-120ml月桂醇聚氧乙烯醚0.2-5g生物防腐剂1mlph值7.0-7.6纯化水定容至1000ml
[0082]
进一步地,上表中的蛋白稳定剂为商业化产品,厂商:surmodics,货号:sa01。
[0083]
缓冲液13
[0084]
称取10-15g的tris、90g的nacl、2-50ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.5之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0085]
表13缓冲液13配方
[0086]
原料名称称取量三羟甲基氨基甲烷10-15g氯化钠90g
非离子型表面活性剂2-50mlph值7.0-7.5纯化水定容至1000ml
[0087]
在一些具体的实施方式中,所述酶标记gfap抗体偶联物的制备方法包括以下步骤:
[0088]
(1)抗体1的活化
[0089]
按抗体1与缓冲液6体积比1:5~1:20的比例将缓冲液6加入抗体1溶液中进行活化,震荡混匀后,立即测试混合液的ph值,ph值应在9~10之间。
[0090]
(2)辣根过氧化物酶(hrp)的活化
[0091]
称取5mg hrp,溶于1.2ml纯化水中,加入0.3ml新鲜配制的缓冲液2,室温条件下混匀20min。将hrp溶液转入一支处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液5。离心机参数设置为:2-8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,2~8℃避光保存。
[0092]
(3)抗体1和hrp的连接
[0093]
按抗体1与hrp质量比1:2~1:1的比例在抗体1溶液中的加入hrp溶液(即:1.0mg抗体1加入1.0~2.0mg hrp)。震荡混匀后,立即测试混合液的ph值,ph值应在9-10之间,如不符合要求,使用缓冲液6进行调节。将混合物在20~40℃条件下中避光混匀反应1~3.5小时。
[0094]
(4)抗体1偶联物的终止和纯化
[0095]
按1mg抗体1加入100μl缓冲液7的比例加入该溶液,在2~8℃条件下混匀反应2小时。将反应液转入另一个处理好的超滤浓缩离心管内管中。在内管中加入500μl缓冲液8。离心机参数设置为:2~8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液。该浓缩液即抗体1偶联物,其浓度应在1~4mg/ml之间,如不在范围,应重新浓缩或使用缓冲液8进行稀释。
[0096]
按1ml抗体1偶联物加入1ml甘油(即体积比1:1)、1ml抗体1偶联物加入5-20μg牛血清白蛋白(即质量体积比200:1~200:4)。充分混匀后,在-20℃环境下保存。
[0097]
在抗体1的活化之前还包括以下步骤:
[0098]
辣根过氧化物酶(hrp)的检测:使用纯化水将超微量紫外分光光度计调零,检测hrp在275nm波长和403nm波长处的od值。计算rz值,rz=od403nm/od275nm,当rz≥3.0时,hrp可用。
[0099]
超滤浓缩离心管的前处理:取两支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:2~8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将两支处理好的超滤浓缩离心管排空液体,盖好盖子备用。
[0100]
进一步地,所述包被板包括抗体2。
[0101]
所述抗体2的包被及封闭包括以下步骤:
[0102]
s1:抗体2的前处理
[0103]
量取1mg抗体2溶液,将其转入处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液8。离心机参数设置为:2-8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加
液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,其浓度应在0.5~2mg/ml之间,如不在范围,应重新浓缩或使用缓冲液8进行稀释。2-8℃保存。
[0104]
s2:抗体2的包被和封闭
[0105]
将处理后的抗体2使用缓冲液8进行稀释,稀释浓度在0.1~4μg/ml。在96孔微孔板中加入稀释后的抗体2溶液,每孔的加入量为50~150μl,在2~8℃条件下避光反应12~16小时或在35~42℃条件下避光反应0.5~2小时。之后弃掉各孔反应液,并加入缓冲液9,每孔的加入量为200μl。在35~42℃条件下避光反应0.5~2小时。
[0106]
s3:抗体2包被板的清洗和保存
[0107]
反应结束后,弃掉各孔反应液。并在各孔中加入缓冲液10,每孔的加入量为200μl。水平均匀震荡微孔板2min。之后弃掉反应液,并重复该过程,一共重复3~5次。最后弃掉各孔反应液并排干液体,在35~42℃条件下避光反应0.5~2小时。使用避光铝膜袋对处理好的包被板进行抽真空封闭,在2~8℃条件下保存。
[0108]
在抗体2的前处理之前,还包括以下步骤:超滤浓缩离心管的前处理
[0109]
取一支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:2~8℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将处理好的超滤浓缩离心管排空液体,盖好盖子备用。
[0110]
本发明所取得的技术效果是:
[0111]
1、本专利使用免疫学检测手段对创伤性脑损伤进行血液检测,与影像学检测手段(主要为ct)相比,本专利更能客观的反映样本的真实情况,减少了因主观判断造成的误判和漏判。
[0112]
2、本专利使用的酶联免疫法(elisa)可以使检测灵敏度达到皮克级别(10-12
g/ml),而ct依赖像素达到更高的分辨率。由于本发明是对脑损伤特异性标志物进行检测,检测窗口比ct提前很多。在ct阴性的情况下,即可对正常人和轻度tbi患者进行有效区分。
[0113]
3、本发明使用全自动仪器进行检测,只需加入血清样本,1小时即可得到准确结果。而ct检测时间较长,一般需要等待4小时才可能取得检测结果。
[0114]
4、本发明使用浓度数值进行判断,取得结果即可得知患者是否患病,客观性较强。而ct检测需要医师进行阅片,依医师的业务水平,主观判断性较强,容易造成漏判、误判。
附图说明
[0115]
图1为本发明反应流程图;
[0116]
图2为本发明工艺流程图。
具体实施方式
[0117]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0118]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下
述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
[0119]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本文中使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同意义。
[0120]
值得说明的是,本发明中使用的原料均为普通市售产品,因此对其来源不做具体限定。
[0121]
1.检测原理
[0122]
本发明的试剂盒采用双抗体夹心法测定gfap的含量。样本中gfap和试剂a中的酶标抗体1及包被板中的抗体2结合,形成“三明治”夹心结构。经洗涤,加入显色液进行反应。显色液在过氧化物酶的催化下转化为蓝色,并在酸的作用下转化为最终的黄色。颜色的深浅与样本中gfap的浓度成正相关。在450nm波长下测定od值并计算样本浓度。
[0123]
2.组分
[0124]
试剂盒组分:gfap试剂盒由包被板、试剂a、校准品、质控品、清洗浓缩液(缓冲液13)、显色液、终止液组成。其中包被板为96孔微孔板。试剂a为含一定浓度辣根过氧化物酶标记的gfap抗体溶液;校准品由含有六个浓度的gfap抗原和缓冲液配制而成,用于校准标准曲线;质控品由含有两个浓度的gfap抗原和缓冲液配制而成;清洗浓缩液用于反应过程的清洗,工作液浓度为10倍稀释的浓缩液;显色液为tmb溶液;终止液为2m硫酸。
[0125]
表14试剂盒主要组分
[0126]
试剂盒主要组分装量包被板(96孔)1个试剂a30ml质控品1ml
×
1校准品1~61ml
×
1清洗浓缩液10ml显色液30ml终止液30ml
[0127]
3.生产工艺
[0128]
校准品、质控品的生产:
[0129]
将gfap重组蛋白作为校准品的原料。以缓冲液11将其溶解,充分混合后配制成6个校准品,浓度为0pg/ml、20pg/ml、40pg/ml、80pg/ml、160pg/ml、320pg/ml。
[0130]
将gfap重组蛋白作为质控品的原料。以缓冲液11将其溶解,充分混合配制成质控品。浓度为20pg/ml、80pg/ml。
[0131]
试剂a的生产:将酶标记gfap抗体偶联物作为试剂a的原料。以缓冲液12将其充分混匀配制成试剂a。
[0132]
4.应用实施例及对比例
[0133]
实施例1
[0134]
一种试剂盒,包括包被板、试剂a、校准品、质控品、缓冲液13、显色液、终止液;
[0135]
其中,试剂a具体使用权利要求上述的缓冲液与酶标记gfap抗体偶联物混匀配制
而成。
[0136]
酶标记gfap抗体偶联物的制备方法包括以下步骤:
[0137]
(1)抗体1的活化
[0138]
按抗体1与缓冲液6体积比1:15的比例将缓冲液6加入抗体1溶液中进行活化,震荡混匀后,立即测试混合液的ph值,ph值应在9~10之间。
[0139]
(2)辣根过氧化物酶(hrp)的活化
[0140]
称取5mg hrp,溶于1.2ml纯化水中,加入0.3ml新鲜配制的缓冲液2,室温条件下混匀20min。将hrp溶液转入一支处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液5。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,2~8℃避光保存。
[0141]
(3)抗体1和hrp的连接
[0142]
按抗体1与hrp质量比1:1.5的比例在抗体1溶液中的加入hrp溶液(即:1.0mg抗体1加入1.5mg hrp)。震荡混匀后,立即测试混合液的ph值,ph值应在9-10之间,如不符合要求,使用缓冲液6进行调节。将混合物在30℃条件下中避光混匀反应2小时。
[0143]
(4)抗体1偶联物的终止和纯化
[0144]
按1mg抗体1加入100μl缓冲液7的比例加入该溶液,在4℃条件下混匀反应2小时。将反应液转入另一个处理好的超滤浓缩离心管内管中。在内管中加入500μl缓冲液8。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液。该浓缩液即抗体1偶联物,其浓度应在2mg/ml之间,如不在范围,应重新浓缩或使用缓冲液8进行稀释。
[0145]
按1ml抗体1偶联物加入1ml甘油(即体积比1:1)、1ml抗体1偶联物加入10μg牛血清白蛋白。充分混匀后,在-20℃环境下保存。
[0146]
在抗体1的活化之前还包括以下步骤:
[0147]
辣根过氧化物酶(hrp)的检测:使用纯化水将超微量紫外分光光度计调零,检测hrp在275nm波长和403nm波长处的od值。计算rz值,rz=od403nm/od275nm,当rz≥3.0时,hrp可用。
[0148]
超滤浓缩离心管的前处理:取两支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将两支处理好的超滤浓缩离心管排空液体,盖好盖子备用。
[0149]
其中,包被板包括抗体2,抗体2的包被及封闭包括以下步骤:
[0150]
s1:抗体2的前处理
[0151]
量取1mg抗体2溶液,将其转入处理好的超滤浓缩离心管内管中,在内管中加入500μl缓冲液8。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。收集内管中的浓缩液,其浓度应在1mg/ml之间,如不在范围,应重新浓缩或使用缓冲液8进行稀释。4℃保存。
[0152]
s2:抗体2的包被和封闭
[0153]
将处理后的抗体2使用缓冲液8进行稀释,稀释浓度在2μg/ml。在96孔微孔板中加入稀释后的抗体2溶液,每孔的加入量为100μl,在4℃条件下避光反应14小时。之后弃掉各
孔反应液,并加入缓冲液9,每孔的加入量为200μl。在40℃条件下避光反应1小时。
[0154]
s3:抗体2包被板的清洗和保存
[0155]
反应结束后,弃掉各孔反应液。并在各孔中加入缓冲液10,每孔的加入量为200μl。水平均匀震荡微孔板2min。之后弃掉反应液,并重复该过程,一共重复3~5次。最后弃掉各孔反应液并排干液体,在40℃条件下避光反应1小时。使用避光铝膜袋对处理好的包被板进行抽真空封闭,在4℃条件下保存。
[0156]
在抗体2的前处理之前,还包括以下步骤:超滤浓缩离心管的前处理
[0157]
取一支超滤浓缩离心管,其分子截流量≥10kd。使用纯化水将内管、外管浸泡5min以上。在内管中加入500μl纯化水。离心机参数设置为:4℃、12000rpm、离心5min。弃掉外管上清后,重复以上加液-离心-弃上清步骤,一共重复5次。将处理好的超滤浓缩离心管排空液体,盖好盖子备用。
[0158]
缓冲液的配方以及制备方法具体如下所示:
[0159]
①
缓冲液1
[0160]
称取3.0g的na2hpo4·
12h2o、0.3g的nah2po4加入到一定量的纯化水中搅拌至完全溶解,调试ph值在6.5~7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0161]
表15缓冲液1配方
[0162]
原料名称称取量十二水合磷酸氢二钠3.0g磷酸二氢钠0.3gph值6.5-7.6纯化水定容至1000ml
[0163]
②
缓冲液2
[0164]
称取20g的naio加入到一定量的缓冲液1中搅拌至完全溶解,调试ph值在6.5~7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0165]
表16缓冲液2配方
[0166]
原料名称称取量高碘酸钠220gph值6.5-7.6缓冲液1定容至1000ml
[0167]
③
缓冲液3
[0168]
称取203.3g的mgcl2·
6h2o加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0169]
表17缓冲液3配方
[0170]
原料名称称取量六水合氯化镁203.3g纯化水定容至1000ml
[0171]
④
缓冲液4
[0172]
称取136.3g的zncl2加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用
0.22μm的滤膜进行过滤。
[0173]
表18缓冲液4配方
[0174]
原料名称称取量氯化锌136.3g纯化水定容至1000ml
[0175]
⑤
缓冲液5
[0176]
称取0.3g的ch cooh加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0177]
表19缓冲液5配方
[0178]
原料名称称取量乙酸0.3g纯化水定容至1000ml
[0179]
⑥
缓冲液6
[0180]
称取22.6g的na2co3、30.2g的nahco3加入到一定量的纯化水中搅拌至完全溶解,调试ph值在9.0~10.0之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0181]
表20缓冲液6配方
[0182]
原料名称称取量碳酸钠22.6g碳酸氢钠30.2gph值9.0-10.0纯化水定容至1000ml
[0183]
⑦
缓冲液7
[0184]
称取2.5mg的nabh4加入到一定量的纯化水中搅拌至完全溶解,定容至1000ml。用0.22μm的滤膜进行过滤。
[0185]
表21缓冲液7配方
[0186]
原料名称称取量硼氢化钠2.5mg纯化水定容至1000ml
[0187]
⑧
缓冲液8
[0188]
称取3.0g的na2hpo4·
12h2o、0.4g的nah2po4、8g的nacl、0.4g的kcl加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.8之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0189]
表22缓冲液8配方
[0190]
原料名称称取量十二水合磷酸氢二钠3.0g磷酸二氢钠0.4g氯化钠8g氯化钾0.4g
ph值7.0-7.8纯化水定容至1000ml
[0191]
⑨
缓冲液9
[0192]
称取1.2g的tris、16.6g的牛血清白蛋白、25.7g的甘氨酸、10g的蔗糖、2ml的非离子型表面活性剂、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.5~8.5之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0193]
表23缓冲液9配方
[0194]
原料名称称取量三羟甲基氨基甲烷1.2g牛血清白蛋白16.6g甘氨酸25.7g蔗糖10g非离子型表面活性剂2ml生物防腐剂1mlph值7.5-8.5纯化水定容至1000ml
[0195]
其中,非离子型表面活性剂为吐温20;生物防腐剂为proclin-300。
[0196]
⑩
缓冲液10
[0197]
称取1.2g的tris、9g的nacl、2.2ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.5之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0198]
表24缓冲液10配方
[0199]
原料名称称取量三羟甲基氨基甲烷1.2g氯化钠9g非离子型表面活性剂2.2mlph值7.0-7.5纯化水定容至1000ml
[0200]
缓冲液11
[0201]
称取13.6g的tris、35.8g的牛血清白蛋白、12.5g甘氨酸加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.6~8.8之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0202]
表25缓冲液11配方
[0203]
[0204][0205]
缓冲液12
[0206]
称取5.7g的hepes、9.0g的nacl、15.0g的牛igg、3ml的缓冲液3、3ml的缓冲液4、15.0g的酶水解明胶、50ml的蛋白稳定剂、3g的月桂醇聚氧乙烯醚、1ml的生物防腐剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.6之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0207]
表26缓冲液12配方
[0208]
原料名称称取量4-羟乙基哌嗪乙磺酸5.7g氯化钠9.0g牛igg15.0g缓冲液33ml缓冲液43ml酶水解明胶15.0g蛋白稳定剂50ml月桂醇聚氧乙烯醚3g生物防腐剂1mlph值7.0-7.6纯化水定容至1000ml
[0209]
上表中的蛋白稳定剂为商业化产品,厂商:surmodics,货号:sa01。
[0210]
缓冲液13
[0211]
称取12.6g的tris、90g的nacl、23.2ml的非离子型表面活性剂加入到一定量的纯化水中搅拌至完全溶解,调试ph值在7.0~7.5之间并定容至1000ml。用0.22μm的滤膜进行过滤。
[0212]
表27缓冲液13配方
[0213]
原料名称称取量三羟甲基氨基甲烷12.6g氯化钠90g非离子型表面活性剂23.2mlph值7.0-7.5纯化水定容至1000ml
[0214]
实施例2
[0215]
与实施例1的区别仅在于,缓冲液12具体为:4-羟乙基哌嗪乙磺酸5.6g/l、氯化钠9g/l、牛igg 30g/l、缓冲液3 1.2ml/l、缓冲液4 9.8ml/l、酶水解明胶1.5g/l、蛋白稳定剂110ml/l、月桂醇聚氧乙烯醚0.2g/l、生物防腐剂1ml/l。
[0216]
制备方法同实施例1。
[0217]
实施例3
[0218]
与实施例1的区别仅在于,缓冲液12具体为:4-羟乙基哌嗪乙磺酸9g/l、氯化钠9g/l、牛igg 5.5g/l、缓冲液3 10ml/l、缓冲液4 1ml/l、酶水解明胶20g/l、蛋白稳定剂35ml/l、月桂醇聚氧乙烯醚4.8g/l、生物防腐剂1ml/l。
[0219]
制备方法同实施例1。
[0220]
对比例1
[0221]
与实施例1的区别仅在于,缓冲液12中牛igg、酶水解明胶、月桂醇聚氧乙烯醚的重量比为3:24.4:0.1(三者的总重量与实施例1一致)。
[0222]
对比例2
[0223]
与实施例1的区别仅在于,将缓冲液中的牛igg、缓冲液3和酶水解明胶替换为等量牛血清白蛋白、1m mgso4(将120.37g硫酸镁溶于1l纯化水中,混匀、过滤,即得)和明胶。
[0224]
5.检测方法
[0225]
采用北京美联泰科生物技术有限公司自研的全自动酶联免疫分析仪进行检测。反应所需样本量为100μl,自动检验流程为:
[0226]
(1)免疫反应:将100ul样本、100μl试剂a依次加入微孔板孔位,在37℃条件下反应40min。
[0227]
(2)清洗:通过仪器的自动清洗流程对微孔板进行清洗。
[0228]
(3)读值:在各孔位加入100μl显色液,室温避光反应15min,再在各孔位加入50μl终止液。辣根过氧化物酶催化的显色液显色后在5min内用自研仪器检测450nm波长吸光度(od值)。
[0229]
(4)根据检测的校准品数值可获得一条gfap浓度-发光值标准曲线。该曲线使用四参数logistic方程拟合。
[0230]
(5)样本的检测值可以和这条曲线上获得唯一的浓度值对应,从而实现对未知样本的浓度检测。
[0231]
本发明的反应流程图和工艺流程图详见如1-2。
[0232]
5.检测指标
[0233]
5.1准确度
[0234]
将浓度约为800pg/ml(允许偏差
±
10%)的胶质纤维酸性蛋白(gfap)液(a)加入到浓度范围0pg/ml-10pg/ml的样本b中,所加入gfap抗原与样本b之间的体积比例为1:9,根据公式(1)计算回收率r,其回收率应在85%~115%范围内。
[0235][0236]
式中:
[0237]
r为回收率;
[0238]
v为样品a液的体积;
[0239]
v0为血清样品b液的体积;
[0240]
c为血清样品b液加入a液后的3次测量平均值;
[0241]
c0为血清样品b液的3次测量平均值;
[0242]
cs为样品a液的浓度。
[0243]
5.2空白限
[0244]
将不含任何分析物的样本重复测试20次,得到20次测试结果的浓度值,计算其平均值和标准差(sd)。平均值即为空白限,结果应≤5pg/ml。
[0245]
5.3线性区间
[0246]
将接近线性区间上限的高值样本与接近线性区间下限的低值样本或零浓度样本混合成不少于5个稀释浓度,其中低值浓度的样本须接近线性区间的下限。对每一浓度的样本各重复测试3次得到发光值,记录各样品的测量结果,并计算各样品3次测量值的平均值(yi)。以稀释浓度(xi)为自变量,以测定结果均值(yi)为因变量求出线性回归方程。按公式(2)计算线性回归的相关系数(r),在10~320pg/ml的线性区间内,相关系数r应≥0.990。
[0247][0248]
式中:
[0249]
r为相关系数;
[0250]
xi为稀释比例;
[0251]
yi为各个样本测定结果均值;
[0252]
为稀释比例的均值;
[0253]
为样本测定结果总均值。
[0254]
5.4重复性
[0255]
同批号试剂盒重复测试质控品10次,计算10次测试结果的平均值和标准差sd。按公式(3)计算变异系数(cv),结果cv≤10%。
[0256][0257]
式中:s为样本测试值的标准差;
[0258]
为样本测试值的平均值。
[0259]
5.5批间差
[0260]
用3个批号的试剂盒分别重复测试质控品10次,计算30次测试结果的平均值和标准差sd,根据公式(3)得出变异系数(cv),结果cv≤15%。
[0261]
5.6校准品和质控品瓶间差
[0262]
检测同一批号10瓶校准品(或质控品)各1次,按公式(5)计算,测定结果的均值与标准差(s1)。另取上述10瓶校准品(或质控品)中的1瓶连续测定10次,计算结果的均值和标准差(s2),按照公式(6)、(7)计算瓶间重复性cv%,测量结果cv应<10%。
[0263][0264]
[0265][0266]
(说明:当s1《s2时,令cv瓶间=0)
[0267]
式中:
[0268]
s为标准差。
[0269]
检测结果:
[0270]
(1)准确度
[0271]
表28
[0272]
实例回收率%实施例1102实施例293实施例389对比例175对比例268
[0273]
(2)空白限
[0274]
表29
[0275][0276][0277]
(3)线性区间
[0278]
表30
[0279]
实例相关系数r实施例10.9991实施例20.9984
实施例30.9979对比例10.9155对比例20.8663
[0280]
(4)重复性
[0281]
表31
[0282][0283][0284]
(5)批间差
[0285]
表36
[0286][0287]
(6)瓶间差
[0288]
表37
[0289][0290]
最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1