用于评估胆管癌进展的标志物及其应用
1.本发明属于生物医学和检测分析技术领域,具体涉及用于评估胆管癌进展的标志物及其应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.胆道恶性肿瘤(biliary tract cancer,btc)是肝胆系统中仅次于肝细胞癌的第二大常见恶性肿瘤,主要包括胆囊癌和胆管癌(cca),而胆管癌依据发生的位置又分为肝内胆管癌(intrahepatic cholangiocarcinoma,icca)、肝门部胆管癌(perihilarcholangiocarcinoma,pcca)和远端胆管癌(distal cholangiocarcinoma,dcca)。胆管癌早期临床特征常不明显,早期诊断困难,约65%以上的患者在确诊时已经失去了根治性手术切除的机会。总体而言,胆管癌患者的5年生存率不到10%。即使得到手术治疗,由于胆管癌易发生血管、淋巴组织和神经侵犯、远处转移且对放化疗等辅助治疗不敏感,导致其复发率高,患者即使行根治性切除,其5年生存率也不到10%。无法行手术的患者,1年生存率仅为10%-20%。
4.smad4(smad family member 4)基因编码信号转导蛋白smad4。smad蛋白被跨膜丝氨酸-苏氨酸受体激酶磷酸化并激活,以响应转化生长因子tgf-β信号传导。该基因的产物与其他活化的smad蛋白形成同聚复合物和异聚复合物,然后在细胞核中积累并调节靶基因的转录。这种蛋白质与dna结合并识别称为smad结合元件(sbe),为8bp回文序列(gtctagac)。该蛋白质作为肿瘤抑制因子并抑制上皮细胞增殖。它还可能通过减少血管生成和增加血管通透性而对肿瘤产生抑制作用。
5.人细胞转运蛋白slc22a3(solute carrier family 22member 3)是一种广泛表达于人体肝脏、胆道、肾脏、肠道和其他器官中的多特异性有机阳离子转运蛋白,其对于消除许多内源性小有机阳离子以及各种药物和环境毒素至关重要。编码该蛋白的基因是位于6号染色体簇中的三个相似的阳离子转运蛋白基因之一,其蛋白质包含12个假定的跨膜结构域,是一种质膜整合蛋白。
6.g蛋白偶联受体是人类基因组中最大的蛋白超家族,拥有700多个基因,在多种生物过程中发挥着重要作用。该蛋白超家族在许多不同的疾病中作为药物靶点,超过40%的fda(食品和药物管理局)批准的药物靶向gpcrs(g蛋白偶联受体)或gpcrs相关通路13。g-蛋白偶联受体,c类,第5组,成员a(gprc5a),又名rai3(维甲酸诱导蛋白3),位于染色体12p13-p12.3上,是一种孤儿受体,在多种细胞生物学过程中发挥重要作用。
技术实现要素:
7.针对上述现有技术中存在的问题,本发明目的在于提供用于评估胆管癌进展的标
志物及其应用。本发明通过研究发现,上述相关蛋白分子在胆管癌进展中具有明显的预后评估价值,从而可用于对胆管癌进展进行评估。
8.为了实现上述技术目的,本发明的技术方案为:
9.本发明的第一个方面,提供一种用于评估胆管癌进展的标志物,所述标志物选自如下任意一个或多个:
10.smad4、slc22a3和gprc5a。
11.所述标志物选自受试者胆管癌组织;
12.所述胆管癌包括肝内胆管癌、肝门部胆管癌和远端胆管癌。
13.本发明通过研究发现,在胆管癌肝内、肝门及远端胆管癌三种分型中,smad4和/ 或slc22a3高表达的者总体生存趋势高于smad4和/或slc22a3低表达患者,其1年及3年总体生存率也有较为明显差异;
14.而gprc5a的高表达与pcca预后不良显著相关并为独立预后风险因素。
15.本发明的第二个方面,提供用于检测上述标志物的物质在制备评估胆管癌进展试剂盒中的应用。
16.检测生物标志物的物质可以是采用诸如elisa、胶体金试纸条、蛋白芯片等现有检测待测样本中相关蛋白及多肽表达情况的物质。
17.所述待测样本可以为人源样本,更具体的,所述待测样本为胆管癌组织。
18.本发明的第三个方面,提供一种用于评估胆管癌进展的系统,所述系统包括:
19.i)分析单元,所述分析单元包含:用于确定受试者的待测样品中选自上述标志物表达水平的检测物质,以及;
20.ii)评估单元,所述评估单元包含:根据i)中确定的所述标志物表达水平判断所述受试者胆管癌进展情况;
21.所述受试者胆管癌进展情况包括但不限于受试者生存率和胆管癌临床病理特征进展情况。
22.所述生存率包括1年总体生存率和3年总体生存率。
23.所述胆管癌临床病理特征包括胆管癌的t分期、n分期、tnm分期、肿瘤分化、肿瘤最大径等。
24.本发明的第四个方面,提供一种用于评估胆管癌进展的方法,所述方法包括:
25.a)从受试者分离待测样本;
26.b)在所述受试者的待测样本中检测上述标志物表达水平判断所述受试者胆管癌进展情况。
27.本发明的第五个方面,提供上述标志物作为靶点在胆管癌治疗和/或筛选胆管癌药物中的应用。
28.所述胆管癌药物为预防和/或治疗胆管癌的药物。
29.本发明的又一具体实施方式中,所述筛选胆管癌药物的方法包括:
30.1)采用候选物质处理表达和/或含有所述标志物的体系;设置不采用候选物质处理的平行对照;
31.2)完成步骤1)后,检测体系中所述标志物的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述标志物的表达量显著升高或降低,所述候选物质可作为候选的
胆管癌药物。
32.上述一个或多个技术方案的有益技术效果:
33.上述技术方案通过对smad4、slc22a3和gprc5a等相关蛋白研究发现,其与胆管癌的预后密切相关,从而可以作为评估胆管癌进展的标志物使用,同时也为后续胆管癌治疗提供潜在的治疗靶点,因此具有良好的实际应用之价值。
附图说明
[0034][0035]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0036]
图1为本发明实施例1中smad4在胆管癌肝内、肝门及远端胆管癌三种分型中的表达情况及生存分析图。
[0037]
图2为本发明实施例1中smad4作为转录因子调控slc22a3的表达分析图。
[0038]
图3为本发明实施例1中slc22a3在胆管癌肝内、肝门及远端胆管癌三种分型中的表达情况及生存分析图。
[0039]
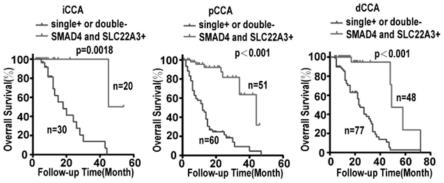
图4为本发明实施例1中smad4与slc22a3共表达对胆管癌患者预后影响及生存分析图。
[0040]
图5为本发明实施例2中利用临床新鲜肝门部胆管癌组织及癌旁组织标本证明gprc5a 在癌组织中显著高表达图。
[0041]
图6为本发明实施例2中利用在线数据库geo及tcga测序数据分析结果示gprc5a 在胆管癌组织的表达量明显高于正常胆管组织图。
[0042]
图7为本发明实施例2中利用临床新鲜肝门部胆管癌及癌旁组织样本表明肝门部胆管癌中gprc5a的表达在癌及癌旁组织中具有显著差距图。
[0043]
图8为本发明实施例2中gprc5a表达情况与胆管癌患者预后情况图。
具体实施方式
[0044]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0045]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0046]
本发明的一个典型具体实施方式中,提供一种用于评估胆管癌进展的标志物,所述标志物选自如下任意一个或多个:
[0047]
smad4、slc22a3和gprc5a。
[0048]
本发明的一个或多个具体实施方式中,所述标志物选自受试者胆管癌组织;
[0049]
本发明的一个或多个具体实施方式中,所述胆管癌包括肝内胆管癌、肝门部胆管癌和远端胆管癌。
[0050]
本发明通过研究发现,在胆管癌肝内、肝门及远端胆管癌三种分型中,smad4和/ 或slc22a3高表达的者总体生存趋势高于smad4和/或slc22a3低表达患者,其1年及3年总体生存率也有较为明显差异;
[0051]
而gprc5a的高表达与pcca预后不良显著相关并为独立预后风险因素;
[0052]
本发明的一个或多个具体实施方式中,提供用于检测上述标志物的物质在制备评估胆管癌进展试剂盒中的应用。
[0053]
检测生物标志物的物质可以是采用诸如elisa、胶体金试纸条、蛋白芯片等任何现有检测待测样本中相关蛋白及多肽表达情况的物质。
[0054]
所述待测样本可以为人源样本,更具体的,所述待测样本为胆管癌组织。
[0055]
本发明的一个或多个具体实施方式中,提供一种用于评估胆管癌进展的系统,所述系统包括:
[0056]
i)分析单元,所述分析单元包含:用于确定受试者的待测样品中选自上述标志物表达水平的检测物质,以及;
[0057]
ii)评估单元,所述评估单元包含:根据i)中确定的所述标志物表达水平判断所述受试者胆管癌进展情况;
[0058]
所述受试者胆管癌进展情况包括但不限于受试者生存率和胆管癌临床病理特征进展情况。
[0059]
所述生存率包括1年总体生存率和3年总体生存率。
[0060]
所述胆管癌临床病理特征包括胆管癌的t分期、n分期、tnm分期、肿瘤分化、肿瘤最大径等。
[0061]
本发明的一个或多个具体实施方式中,提供一种用于评估胆管癌进展的方法,所述方法包括:
[0062]
a)从受试者分离待测样本;
[0063]
b)在所述受试者的待测样本中检测上述标志物表达水平判断所述受试者胆管癌进展情况。
[0064]
本发明的一个或多个具体实施方式中,提供上述标志物作为靶点在胆管癌治疗和/ 或筛选胆管癌药物中的应用。
[0065]
所述胆管癌药物为预防和/或治疗胆管癌的药物。
[0066]
本发明的又一具体实施方式中,所述筛选胆管癌药物的方法包括:
[0067]
1)采用候选物质处理表达和/或含有所述标志物的体系;设置不采用候选物质处理的平行对照;
[0068]
2)完成步骤1)后,检测体系中所述标志物的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述标志物的表达量显著升高或降低,所述候选物质可作为候选的胆管癌药物。
[0069]
本发明的又一具体实施方式中,所述体系可为细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
[0070]
所述药物还可包括药学上可接受的载体。所述药学上可接受的载体可为缓冲剂、乳化剂、悬浮剂、稳定剂、防腐剂、赋形剂、填充剂、凝结剂与调和剂、界面活性剂、扩散剂或消泡剂。
[0071]
所述药物还可包括可药用载体。所述可药用载体可为病毒、微囊、脂质体、纳米颗粒或聚合物及其任意组合。所述可药用载体的递送载剂可为脂质体、生物相容性聚合物 (包括天然聚合物和合成聚合物)、脂蛋白、多肤、多糖、脂多糖、人工病毒包膜、无机 (包括金属)颗粒、以及细菌或病毒(例如杆状病毒、腺病毒和逆转录病毒)、噬菌体、黏粒或质粒载体。
[0072]
所述药物还可与其他预防和/或治疗复发性流产的药物联用,其他预防和/或治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。
[0073]
所述药物还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它预防和/或治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。在治疗过程中,可以根据症状的严重程度、复发的频率和治疗方案的生理应答,调整本发明药物的剂量。
[0074]
本发明的药物可通过已知的方式施用至体内。例如通过静脉全身递送或者局部注射递送到感兴趣组织中。可选地经由静脉内、经皮、鼻内、粘膜或其他递送方法进行施用。这样的施用可以经由单剂量或多剂量来进行。本领域技术人员理解的是,本发明中有待施用的实际剂量可以在很大程度上取决于多种因素而变化,如靶细胞、生物类型或其组织、待治疗受试者的一般状况、给药途径、给药方式等等。
[0075]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
[0076]
实施例1
[0077]
用于预测胆管癌预后的转录因子smad4及预后风险模型的建立
[0078]
使用重组anti-smad4抗体(ab40759),对胆管癌芯片行免疫组化染色后评分,ihc 评分=(低表达的细胞面积占比
×
1)+(中表达的细胞面积占比
×
2)+(高表达的细胞面积占比
×
3),进行生存分析(kaplan-meier),结果见附图1。
[0079]
如图1所示,在胆管癌肝内、肝门及远端胆管癌三种分型中,smad4高表达的者总体生存趋势高于smad4低表达患者,其1年及3年总体生存率(overall survival) 也有较为明显差异(见表1)。
[0080]
表1:smad4相关生存分析
[0081][0082]
用于预测胆管癌预后的细胞转运蛋白slc22a3及预后风险模型的建立
[0083]
1.smad4作为转录因子调控slc22a3的表达
[0084]
(1)用包装有smad4干扰及过表达病毒感染生长状态良好的胆管癌细胞qbc-939,嘌呤霉素筛选后建立稳转细胞系,每组3例单样本送行转录组高通量测序,分析下游基因表达情况,结果示下游slc22a3其表达与smad4正相关。
[0085]
表2:用于预测胆管癌预后的细胞转运蛋白slc22a3的筛选
[0086] 下游基因fcpadjsmad4-scramble vs lv3-smad4slc22a30.470.019374smad4-vector
ꢀꢀꢀ
vs lv5-smad4slc22a368.500.02579
[0087]
(2)先行jaspar结合位点预测smad4作为转录因子结合于slc22a3的位点序列(见表 3),取评分最高的一段启动子片段序列(cagtctgtccccc),构建luciferase报告基因质粒(enhance-segment);同时构建slc223启动子报告基因质粒(slc22a3-promoter) 及预测序列片段突变的slc22a3启动子报告基因质粒(slc22a3-promoter-mut)。用包装有smad4干扰及过表达病毒感染生长状态良好的293t细胞,嘌呤霉素筛选后建立稳转细胞系。海肾质粒均一质粒的转染效率后,行双荧光素酶实验以荧光强度为尺标定量检测slc22a3被smad4激活程度,结果见附图2。
[0088]
如图2所示,slc22a3的启动子序列中存在片段被smad4激活,当此段序列被突变后,smad4的激活作用明显减弱。
[0089]
表3:jaspar结合位点预测
[0090][0091]
2.slc22a3相关生存分析
[0092]
使用重组anti-slc22a3/oct3抗体(ab124826),对胆管癌芯片行免疫组化染色后评分,ihc评分=(低表达的细胞面积占比
×
1)+(中表达的细胞面积占比
×
2)+(高表达的细胞面积占比
×
3),进行生存分析(kaplan-meier),结果见附图3。
[0093]
如图3所示,在胆管癌肝内、肝门及远端胆管癌三种分型中,slc22a3高表达的患者总体生存趋势高于slc22a3低表达患者,其1年及3年总体生存率(overall survival) 也有较为明显差异(见表4)。
[0094]
表4:slc22a3相关生存分析
[0095][0096]
smad4与slc22a3共表达对胆管癌患者预后影响及生存分析
[0097]
如图4,综合分析smad4与slc22a3组化评分,在胆管癌肝内、肝门及远端胆管癌三
种分型中,smad4与slc22a3均高表达的患者总体生存趋势高于单smad4或 slc22a3高表达及均低表达患者,其1年及3年总体生存率(overall survival)也有较为明显差异(见表5)。
[0098]
表5:smad4与slc22a3共表达相关生存分析
[0099][0100][0101]
因此,能够直接有效的根据患者smad4与slc22a3表达情况预测胆管癌患者的预后情况。
[0102]
实施例2
[0103]
用于预测肝门部胆管癌预后的细胞膜蛋白gprc5a的筛选与鉴定
[0104]
(1)利用临床新鲜肝门部胆管癌组织及癌旁组织标本共8对进行转录组测序,测序结果示gprc5a在癌组织中显著高表达(图5)。
[0105]
(2)利用在线数据库geo及tcga测序数据分析结果示gprc5a在胆管癌组织的表达量明显高于正常胆管组织(图6)。
[0106]
(3)利用临床新鲜肝门部胆管癌及癌旁组织样本共6对行qrt-pcr再次检测 gprc5a的表达情况。结果示肝门部胆管癌中gprc5a的表达在癌及癌旁组织中具有显著的差距(图7)。
[0107]
gprc5a的高表达与pcca预后不良显著相关并为独立预后风险因素
[0108]
(1)使用重组anti-gpc5a抗体(cell signaling technology,#12968),对胆管癌芯片行免疫组化染色后评分,h-score评分=(低表达的细胞面积占比
×
1)+(中表达的细胞面积占比
×
2)+(高表达的细胞面积占比
×
3),以h-score评分中位数区分pcca患者为 gprc5a高表达组和gprc5a低表达组两组。结合随访结果利用kaplan-meier法进行生存分析,结果示gprc5a高表达组预后差(图8)。
[0109]
(2)为了进一步明确gprc5a与pcca各临床病理特征的关系,我们进行了相关性分析(表6)。结果发现gprc5a的表达情况与pcca的t分期、n分期、tnm分期、肿瘤分化、肿瘤最大径等具有显著相关性(p<0.05)。而与年龄、性别、m分期、神经侵犯等无明显相关性。(临床病理分期使用uicc/ajcc tnm分期系统(2017年第八版)。)
[0110]
表6.gprc5a的表达与pcca各临床病理特征的相关性
[0111]
[0112][0113]
(3)为了明确gprc5a是否为pcca的独立预后风险因素,我们对gprc5a表达情况及各临床病理特征进行了单因素多因素分析(表7)。结果示gprc5a显著影响预后并为pcca的独立预后风险因素。
[0114]
表7.gprc5a的表达及pcca各临床病理特征的预后意义
[0115]
[0116][0117]
本实施例证明可以直接有效的根据患者gprc5a表达情况预测患者的预后情况。
[0118]
应注意的是,以上实施例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实施例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1