一种半胱氨酸巯基化修饰的方法与流程
1.本技术涉及化学蛋白质组领域,具体涉及一种半胱氨酸巯基化修饰的方法,一种检测和/ 或鉴定半胱氨酸巯基化修饰的方法,或所述方法在鉴定gapdh上巯基化修饰的半胱氨酸的应用。
背景技术:
2.硫化氢(h2s)是细胞中目前发现最简单的巯基化合物,在很长一段时间里,它都被认为是一种有毒气体,直到1996年第一次报道它可能具有生理调控功能,成为继一氧化氮(no) 和一氧化碳(co)之后第三种信号分子,迅速吸引了众多研究者的兴趣。h2s已被报道调控或参与了许多生理活动,例如血管舒张,神经传递,血管再生,炎症等。在生物体中,h2s主要通过三类反应过程发挥作用,包括反应或者清除活性氧物质(reactive oxygen species,ros) 和活性氮物质(reactive nitrogen species,rns),与蛋白质金属中心结合或发生氧化还原反应以及对蛋白质进行共价修饰。其中对蛋白质的半胱氨酸残基进行共价修饰,即巯基化修饰(s-sulfhydration or persulfidation),作为一种新发现的可逆的翻译后修饰 (post-translational modifications,ptms)自2009年被约翰霍普金斯医学院的solomonh.snyder研究组首次报道以来倍受关注。根据他们获得的数据估算,肝脏中10%-25%的蛋白质被认为可能含有这种巯基化修饰。
3.由于过硫基的反应活性和半胱氨酸的巯基非常相似,因此对于它的检测方法很局限。目前已经报道的有四种方法,其中改进的生物素转换技术(modified biotin switch technique, mbst)是最早提出来的,也是鉴定到s-sulfhydrated蛋白质最多的一种方法。改进的生物素转换技术是基于甲硫代磺酸甲酯(methyl methanethiosulfonate,mmts)可以区分过硫基和巯基,选择性的封闭巯基,随后,自由的过硫基和探针biotin-hpdp反应而被标记。截止到目前,mbst是使用最多的也是鉴定到带有过硫基修饰蛋白质最多的方法,然而,该方法一直倍受质疑。实验表明在体外用mmts处理肽段或蛋白会造成一些分子间或分子内的二硫键产生,给数据的分析带来很多干扰。同时,斯克里普斯研究所的kate s.carroll研究组详细研究了过硫基和一系列亲核或亲电小分子之间的反应能力,证明了过硫基可以和mmts反应,从原理上质疑了mbst的可靠性。对于mbst得到的数据可能有两种解释:(1)mmts并没有完全将蛋白质组中半胱氨酸残基反应,剩余的残基就会和探针biotin-hpdp反应;(2)在恒量自由的巯基(rsh)催化作用下,探针biotin-hpdp可通过巯基-二硫键交换反应进行标记。
4.2011年,冷泉港实验室的nicholask.tonks研究组为了研究蛋白质酪氨酸磷酸酯酶1b (protein tyrosinephosphatase 1b,ptp1b)的巯基化,报道了另一种检测方法。首先用过量的碘乙酸进行封闭反应,此时巯基和过硫基都会反应,因为它们的化学反应活性很类似,随后用还原剂二硫苏糖醇(dtt)处理时,烷基化的过硫基可以被切断成自由的巯基从而被探针(iodoacetamide-linked biotin,iap)标记。然而,这种方法存在很明显的问题就是dtt 也可以还原二硫键,亚硝基化半胱氨酸,如何将过硫基和它们区分开来并不清楚。
5.2012年,solomon h.snyder研究组报道了另外一种检测过硫基的方法,马来酰胺标记方法(the maleimide assay)。巯基和过硫基都可以和n-乙基马来酰胺(n-ethyl maleimide) 反应,当用cy5连接的马来酰胺(cy5-conjugated maleimide)进行标记时,两者都会被标记而带有荧光信号,dtt还原过硫基信号丢失,而巯基上的信号仍然保留,通过信号丢失的方法对过硫基进行检测。这种方法虽然很简单(探针是商业化的),但因为它是基于信号丢失来判断是否有过硫基的存在,所以并不能通过富集或其他方式直接鉴定到过硫基位点,更不适合蛋白质组学的分析。而且在这个方法中还需要确保有足够的探针将所有的半胱氨酸和过硫基都进行了标记,否则会影响数据的分析。
6.2014年,华盛顿州立大学的ming xian研究组报道了一种基于正向策略的新方法,标签转换技术(tag-switch technique)。这种方法的中心思想是首先用一种巯基封闭试剂封闭所有的半胱氨酸和过硫基,然后选择合适的探针对过硫基形成的二硫键选择性反应,这样就可以与蛋白质组中正常的二硫键区分开来。因此探针的选择(探针的结构包括可以特异反应过硫基封闭产物的亲核基团和生物素或荧光分子报告基团)至关重要。在这个方法中,甲磺酰基苯并噻唑(methylsulfonyl benzothiazole,msbt)作为封闭试剂,再加入带有生物素的氰基乙酸酯类探针标记过硫基形成的产物。以bsa(牛血清白蛋白)作为例子,证明了该方法的特异性很高。然而事实上,次磺酸是能够和氰基乙酸酯类探针反应的,在后来改进的方法中,次磺酸特异性反应试剂双甲酮(dimedone)首先被加入细胞裂解液中,然后再进行后续过硫基的检测,这样就避免了可能的副反应。然而,截止到目前,这种方法并没有鉴定到过硫基的位点。因为转化的方法不能直接鉴定到带有过硫基的产物,蛋白质组是一个极其复杂的体系,很显然不能通过理论推测来判定没有可以发生副反应的物质存在,当然也就不能判定所标记的蛋白质是具有巯基化修饰的。
7.总体来说,目前报道的方法都存在很多的缺陷,尽管都试图在蛋白质组层次上寻找巯基化蛋白,但效果都不是很好。仅仅在单一蛋白质上实现了巯基化的检测,再结合分子、细胞生物学等手段,包括蛋白纯化,位点突变,免疫印迹等技术鉴定出可能的巯基化修饰位点。能否在蛋白质组上实现过硫基的直接选择性标记并将它们富集出来,是亟需解决的问题。
技术实现要素:
8.为了能够在蛋白质组上实现过硫基的直接选择性标记,本技术提供一种半胱氨酸巯基化修饰的方法,通过在偏酸性条件下,采用碘乙酰胺分子探针,对生物样本蛋白质组中半胱氨酸的过硫基进行化学选择性标记。后续使用质谱技术进行鉴定,可鉴定出生物样本蛋白质组中所有巯基化修饰。
9.如图1所示,为在不同ph条件下,溶液中rssh和rsh存在不同的质子平衡示意图。要对蛋白质组中的过硫基进行选择性标记,主要是将它和高丰度的巯基进行区分。溶液中过硫基(rssh)和巯基(rsh)存在类似的质子平衡过程,在酸性条件下以质子化形式为主,在碱性条件下以亲核性负离子形式为主。半胱氨酸上巯基的pka是8左右,过硫基的pka比巯基低1-2,因此当ph恰好处于两者的pka之间时,理论上rssh主要以负离子形式存在而rsh 主要以质子化形式存在。由于α效应(当一个亲核中心和含有孤对电子的原子相连时,其本身的亲核性会被提高,这被称作α效应),rssh的亲核反应能力要强于rsh,在去质子化形式下它
们的反应活性进一步增强,因此可以得出以下结论:亲核反应活性:r-s-s-》r-s-~r-s-sh》r-sh。因此申请人想到,通过调节合适的ph,在反应活性上对rssh 和rsh进行选择性标记。
10.申请人首先用简单的小分子模型验证是否可以通过调节ph实现对rssh的选择性标记。根据kate s.carroll研究组在2013年对过硫基反应性研究的方法(参考文献:pan,j.& carroll,k.s.persulfide reactivity in the detection of protein s-sulfhydration. acs chem biol8,1110-1116,(2013).),以gssg为原料,在nahs的诱导下,产生等量的 gssh和gsh,然后加入iaa(碘乙酰胺)反应形成稳定的产物,通过液相-质谱(lc-ms)的方法对产物进行定量分析。
11.本技术一方面提供一种半胱氨酸巯基化修饰的方法,包括:
12.在偏酸性条件下,采用碘乙酰胺分子探针(iaa),对生物样本蛋白质组中半胱氨酸的过硫基进行化学选择性标记。
13.本技术另一方面提供一种检测和/或鉴定半胱氨酸巯基化修饰的方法,包括:
14.在偏酸性条件下,采用碘乙酰胺分子探针,对生物样本蛋白质组中半胱氨酸的过硫基进行化学选择性标记;
15.对化学选择性标记后的生物样本蛋白质组酸切、酶切,采用质谱鉴定巯基化修饰的位点。
16.在一些实施方案中,所述偏酸性条件为ph2-ph6。优选的,所述偏酸性条件为ph4-ph6,更优选的,所述偏酸性条件为ph4.1、ph4.2、ph4.3、ph4.4、ph4.5、ph4.6、ph4.7、ph4.8、 ph4.9、ph5、ph5.1、ph5.2、ph5.3、ph5.4、ph5.5、ph5.6、ph5.7、ph5.8、ph5.9、ph6。
17.在一些实施方案中,所述生物样本包括:牛血清白蛋白、大肠杆菌、酵母细胞、人源细胞系、人组织样本、人体器官、小鼠细胞系、小鼠组织样本、小鼠器官、果蝇细胞系、斑马鱼细胞系或线虫细胞系。更优选的所述生物样本为人源细胞系。所述人源细胞系为通过选择的永生细胞株,在本文中为市场上购买得到的细胞系,该细胞系已被现有技术所公开。所述人源细胞系包括:hela(人宫颈癌细胞系)、ovcar-3(人卵巢癌细胞系)和lncap(人前列腺癌细胞系);任何通过常规手段对生物样本进行简单的替换,都落入本技术的保护范围。
18.在一些实施方案中,所述人源细胞系包括:hepg2细胞、huh7细胞或hep3b细胞。优选的所述人源细胞系为hepg2细胞。这三种细胞属于人肝癌细胞。
19.在一些实施方案中,还包括使用nahs处理生物样本,所述nahs的工作浓度为0-15mm。优选的,所述nahs的工作浓度为0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、 0.9mm、1mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm、1.6mm、1.7mm、1.8mm、1.9mm、2mm、 2.1mm、2.2mm、2.3mm、2.4mm、2.5mm、2.6mm、2.7mm、2.8mm、2.9mm、3mm、3.1mm、3.2mm、 3.3mm、3.4mm、3.5mm、3.6mm、3.7mm、3.8mm、3.9mm、4mm、4.1mm、4.2mm、4.3mm、4.4mm、 4.5mm、4.6mm、4.7mm、4.8mm、4.9mm、5mm、5.1mm、5.2mm、5.3mm、5.4mm、5.5mm、5.6mm、 5.7mm、5.8mm、5.9mm、6mm、6.1mm、6.2mm、6.3mm、6.4mm、6.5mm、6.6mm、6.7mm、6.8mm、 6.9mm、7mm、7.1mm、7.2mm、7.3mm、7.4mm、7.5mm、7.6mm、7.7mm、7.8mm、7.9mm、8mm、 8.1mm、8.2mm、8.3mm、8.4mm、8.5mm、8.6mm、8.7mm、8.8mm、8.9mm、9mm、9.1mm、9.2mm、 9.3mm、9.4mm、9.5mm、9.6mm、9.7mm、9.8mm、9.9mm、10mm、10.1mm、10.2mm、10.3mm、10.4mm、 10.5mm、10.6mm、10.7mm、10.8mm、10.9mm、11mm、11.1mm、11.2mm、11.3mm、11.4mm、11.5mm、 11.6mm、11.7mm、11.8mm、11.9mm、12mm、12.1mm、12.2mm、12.3mm、12.4mm、12.5mm、12.6mm、 12.7mm、12.8mm、12.9mm、13mm、13.1mm、
13.2mm、13.3mm、13.4mm、13.5mm、13.6mm、13.7mm、 13.8mm、13.9mm、14mm、14.1mm、14.2mm、14.3mm、14.4mm、14.5mm、14.6mm、14.7mm、14.8mm、 14.9mm、15mm。
20.在一些实施方案中,所述质谱包括:液相色谱质谱联用、三重串联液质联用、气相色谱质谱联用。优选的所述质谱为三重串联液质联用。
21.三重串联液质联用(lc-ms/ms)、液相色谱质谱联用(lc-ms)、气相色谱质谱联用(gc-ms) 这些质谱方法及仪器的使用,是本领域技术人员可根据实际需求进行的选择,另外,在一些实施方案中,还可将lc-ms与gc-ms联用,以对化学选择性标记后的生物样本进行鉴定。
22.在一些实施方案中,所述碘乙酰胺分子探针在对生物样本蛋白质组中半胱氨酸的过硫基进行化学选择性标记前,所述生物样本蛋白质组还需用生物素探针进行标记。优选的所述生物素探针为碘乙酰胺生物素(ia-biotin),可使蛋白质保持还原状态。
23.本技术另一方面提供所述的方法在鉴定gapdh上巯基化修饰的半胱氨酸的应用。
24.在一些实施方案中,所述应用鉴定的半胱氨酸包括gapdh的第152和247位的半胱氨酸。
附图说明
25.为了更清楚地说明本技术的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.图1为在不同ph条件下,溶液中rssh和rsh存在不同的质子平衡示意图;
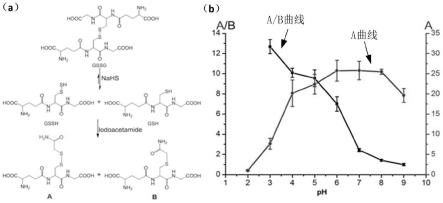
27.图2为不同ph条件下gssh和gsh分别和碘乙酰胺反应活性,其中a为以gssg为模型,在nahs诱导作用下产生等量的gssh和gsh,分别和iaa反应后生成产物a和b,b为在不同ph条件下分别和碘乙酰胺反应,表现出不同的反应活性,横坐标为ph值,左侧纵坐标表示a/b的量,右侧纵坐标为a的量;
28.图3为不同ph条件下利用bsa验证碘乙酰胺探针对rssh的选择性标记,a为基于荧光探针标记的检测方法,荧光探针tmria标记的过硫基在还原剂存在条件下被切断,信号丢失,可以直接在凝胶上读取;b为以bsa为模型,在nahs诱导作用下产生过硫基,随着反应体系 ph的升高,标记强度逐渐升高;ph在2.00到6.00之间,还原剂tcep导致的信号丢失差异都比较大;c为bsa经nahs诱导后,iaa封闭,酶切成肽段样品,lc-ms/ms鉴定到过硫基的生成的二级谱;
29.图4为蛋白质组背景下利用bsa验证低ph中碘乙酰胺探针对rssh的选择性标记,a为荧光探针在不同ph条件下标记带有过硫基的bsa和hepg2细胞裂解液混合物;在ph4到6左右,荧光探针对bsa上的过硫基选择性标记强,因此在有无还原剂存在的条件下信号差异大; b为在bsa和hepg2细胞裂解液混合物中鉴定到的iaa和过硫基反应后肽段的二级谱;
30.图5为生理条件下诱导产生巯基化修饰,a为tmria标记的蛋白质组,左边是荧光信号,右侧是考马斯亮蓝染色,和正常的hepg2细胞,hepg2-cse细胞相比,在hepg2-cse细胞中加入500μm l-半胱氨酸可以增强过硫基的水平,从而荧光信号更强;b为用甲基蓝方法测量细胞培养基中h2s的含量,含有500μm l-半胱氨酸的细胞培养基中h2s含量是正常hepg2和 hepg2-cse细胞培养基中h2s含量的两倍左右;c为ia-biotin探针标记的蛋白质组,左边为
streptavidin抗体检测biotin的信号,右边为poncean s对蛋白质染色,ia-biotin的标记信号也是随着l-半胱氨酸的加入逐渐升高的,在还原剂存在的条件下信号丢失;
31.图6为蛋白质组水平鉴定巯基化修饰蛋白方法示意图,方法包括:按照荧光标记的分布将iaa标记的蛋白质组进行切割,胶内酶切后进行质谱分析,用mascot软件对数据进行搜索;
32.图7为gapdh的第152位半胱氨酸(带*标记)上鉴定有巯基化修饰。
具体实施方式
33.下面将详细地对实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下实施例中描述的实施方式并不代表与本技术相一致的所有实施方式。仅是与权利要求书中所详述的、本技术的一些方面相一致的系统和方法的示例。
34.实施例1 gssg模型实验
35.称取一定量的gssg,溶解于1000μl 100mm的tris-hcl溶液中(ph=7.4)至10mm,然后加入200mm新配置的nahs水溶液至工作浓度为10mm。反应在37℃条件下进行30min,即制得含有等量的gssh和gsh的溶液。分别取出100μl加入到900μl ph为1到9的tris-hcl 溶液中,立即加入1mm的iaa(sigma-aldrich)在暗处室温反应1h。反应结束后,将样品用水稀释10倍,同时在每个样品中加入等量的内标(用于对产物进行定量比较)用lc-ms对样品进行分析。进行了三组生物学平行实验。
36.实施例2 bsa模型实验:不同ph条件下荧光探针的标记
37.称取一定量的bsa(sigma-aldrich)溶解于ph=7.4的pbs缓冲液中(用n2处理)得2mg/ml 的溶液,然后直接加入nahs水溶液,工作浓度为1mm,在37℃条件下进行30min。反应结束后,直接加入1/4体积的100%tca(三氯乙酸)(在4℃中保存)对蛋白进行沉淀。溶液在冰上放置30min,然后在4℃离心机中,20000g离心10min得白色蛋白沉淀,用冷丙酮清洗两次。
38.将得到的蛋白沉淀分别溶解在ph为1到9的6m尿素的pbs溶液中,离心去除不溶物。加入探针tmria(thermofisher)至工作浓度5μm,室温反应2h,然后加入20mm iaa停止反应。将溶液分成两部分,一组加入30mm的tcep(三(2-羰基乙基)磷盐酸盐),另一组加入等量的水,在37℃条件下进行30min。反应结束后加入不含巯基乙醇的上样缓冲溶液,进行凝胶电泳。
39.实施例3 bsa模型实验:lc-ms/ms鉴定bsa中诱导产生的过硫基
40.称取一定量的bsa溶解于ph=7.4的pbs缓冲液中(用n2处理)得1mg/ml的溶液,然后加入nahs水溶液,工作浓度为0.5mm,在37℃条件下进行30min。反应结束后,加入20mm 的iaa对bsa进行封闭。在反应体系中加入5倍体积的甲醇-氯仿混合物(甲醇:氯仿=4:1),混匀后加入3倍体积的水,混匀离心的蛋白沉淀,用冷甲醇清洗两遍然后溶解在2m尿素pbs 溶液中,加入1mm的cacl2。将trypsin(1:100)加入溶液中置于37℃中酶切过夜。酶切后的肽段中加入5%的甲酸保存于-20℃中待lc-ms/ms分析。
41.参见图2中a,gssg在nahs的作用下,生成等量的gssh和gsh,分别和iaa反应后生成产物a和b;在不同ph条件下,理论上gssh和gsh对于iaa的反应活性是不同的,通过 lc-ms对
除去残留的nahs。将1mg/ml bsa和新制备的3mg/ml hepg2细胞裂解液混合,立即加入1/4 体积的100%tca(在4℃中保存)对蛋白进行沉淀。溶液在冰上放置30min,然后在4℃离心机中,20000g离心10min的白色蛋白沉淀,用冷丙酮清洗两次。
50.将得到的蛋白沉淀分别溶解在ph=6的6m尿素的pbs溶液中,离心去除不溶物。加入20mm 的iaa对蛋白质组进行封闭。在反应体系中加入5倍体积的甲醇-氯仿混合物(甲醇:氯仿=4:1),混匀后加入3倍体积的水,混匀离心的蛋白沉淀,用冷甲醇清洗两遍然后溶解在2m尿素的 pbs溶液中,加入1mm的cacl2。trypsin(胰蛋白酶)(promega)(1:100)加入溶液中置于 37℃中酶切过夜。在酶切后的肽段中加入5%的甲酸保存于-20℃中待lc-ms/ms分析。
51.如图4中a所示,tca沉淀后的混合物分别溶解在不同ph的尿素pbs缓冲溶液中,再用荧光探针tmria进行标记,可以很清晰的看到bsa的信号取决于还原剂巯基乙醇的,同时在高的ph(7.4)条件下,标记信号在有无还原剂条件下都很强。在ph4到6左右bsa表现出很好的还原剂依赖的信号丢失和保留,这和单一的bsa模型得到的结果是一致的,符合预期。同样的,如图4中b所示,为在bsa和hepg2细胞裂解液混合物中鉴定到的iaa和过硫基反应后肽段的二级谱,用lc-ms/ms验证了在该混合物中bsa的标记信号来自于过硫基,在同一个肽段上相同的半胱氨酸位点看到了iaa反应后的产物。
52.实施例6蛋白质组中巯基化修饰的鉴定:荧光探针tmria标记
[0053]9×
106hepg2-cse细胞(人肝癌细胞hepg2过表达h2s合成酶cse)在15-cm细胞培养盘中培养48h,更换新鲜的培养液后,加入0和500μm的l-半胱氨酸继续培养9h。9
×
106hepg2 细胞在15-cm细胞培养盘中培养48h,更换新鲜的培养液后继续培养9h。
[0054]
9h后,用pbs清洗细胞两次,然后直接在细胞培养盘中加入冷的4ml 20%tca,将细胞放置在4℃冰箱中30min,这个过程可以快速固定细胞同时对细胞进行破碎。30min后,用细胞刮收集蛋白质组,在4℃离心机中以20000g离心30min。分别用10%,5%的tca清洗蛋白质组,然后用冷丙酮清洗两次,将蛋白质组在室温下干燥后立即加入ph=5.00的6m尿素的pbs 缓冲溶液,超声溶解。20000g离心10min,取上清,使用bio-rad dc assay(购自bio-rad) 对蛋白质进行定量。将蛋白质组稀释到2mg/ml后用荧光探针tmria进行标记。
[0055]
60μl反应体系,tmria浓度为50μm,反应在室温下进行2h。然后加入20mm iaa停止反应,反应在37℃下进行30min。将反应体系平均分成两份,一份中加入30mm的tcep,另一份中加入水,在37℃下孵育30min后加入不含还原剂的5
×
上样缓冲液进行凝胶电泳。
[0056]
在人肝癌细胞hepg2过表达h2s合成酶cse(胱硫醚-γ-裂解酶,cystathionineγ-lyase),在细胞生理环境下加入l-半胱氨酸,内源产生h2s,提高细胞内巯基化修饰水平。如图5中a 所示,和没有加入额外半胱氨酸的细胞相比,500μm l-半胱氨酸刺激条件下标记信号明显增强,说明产生了更多的过硫基。在没有加入过量的l-半胱氨酸的情况下,hepg2-cse和hepg2 细胞中的巯基化水平类似。在还原剂tcpe存在的条件下,标记信号明显丢失,证明了信号来自于可被还原的过硫基。
[0057]
实施例7蛋白质组中巯基化修饰的鉴定:细胞培养液中h2s含量的测量
[0058]
标准曲线的测定。用新鲜的细胞培养液配制0、6.25、12.5、25、50、100μm nahs标准溶液。在500μl反应体积中加入醋酸锌(1%w/v,50μl)。5min后,加入tca(10%,300μl)。反应5min后,将反应体系离心5min(12000rpm)。将上清液(600μl)转移至一个新的1.5ml 反应管
中,依次加入对氨基-n,n-二甲基苯胺(20mm 7.2m hcl,75μl)和fecl3(30mm 1.2m hcl,75μl)。反应在室温下进行30min后,12000rpm离心5min,取出200μl上清液,用紫外-可见吸收光谱仪测定670nm处的吸收。每个样品三个平行重复。
[0059]
细胞培养液中h2s含量的测量。在500μl取出的新鲜细胞培养液(hepg2,hepg2-cse(0 和500μm l-半胱氨酸)中加入醋酸锌(1%w/v,50μl)。5min后,加入tca(10%,300μl)。反应5min后,将反应体系离心5min(12000rpm)。将上清液(600μl)转移至一个新的1.5ml 反应管中,依次加入对氨基-n,n-二甲基苯胺(20mm 7.2m hcl,75μl)和fecl3(30mm 1.2m hcl,75μl)。反应在室温下进行30min后,12000rpm离心5min,取出200μl上清液,用紫外-可见吸收光谱仪测定670nm处的吸收。每个样品三个平行重复。
[0060]
用甲基蓝方法检测了细胞培养基中h2s含量,甲基蓝方法是检测生物样品中h2s含量最常用的方法,基于h2s和对氨基-n,n-二甲基苯胺的反应,在fecl3的催化作用下以1:2的化学计量比反应生成甲基蓝,在667nm处的摩尔吸光系数是71000m-1
cm-1
,因此可用吸收光直接测量。如图5中b所示,含有500μm l-半胱氨酸刺激的细胞培养基中h2s含量是0μm组的大约两倍,正常hepg2和hepg2-cse细胞培养基中h2s含量相当,这也和荧光信号相互吻合。
[0061]
实施例8蛋白质组中巯基化修饰的鉴定:生物素探针ia-biotin标记
[0062]9×
106hepg2-cse细胞在15-cm细胞培养盘中培养48h,更换新鲜的培养液后,加入0、 100μm和1000μm的l-半胱氨酸继续培养9h。
[0063]
9h后,用pbs清洗细胞两次,然后直接在细胞培养盘中加入冷的4ml 20%tca,将细胞放置在4℃冰箱中30min,这个过程可以快速固定细胞同时对细胞进行破碎。30min后,用细胞刮收集蛋白质组,在4℃离心机中以20000g离心30min。分别用10%,5%的tca清洗蛋白质组,然后用冷丙酮清洗两次,将蛋白质组在室温下干燥后立即加入ph=5.00的6m尿素的pbs 缓冲溶液,超声溶解。20000g离心10min,取上清,使用bio-rad dc assay对蛋白质进行定量。将蛋白质组稀释到2mg/ml后用生物素探针ia-biotin(sigma-aldrich)进行标记。
[0064]
100μl反应体系,ia-biotin浓度为50μm,反应在室温下进行2h。然后加入20mm iaa 停止反应,反应在37℃下进行30min。将反应体系平均分成两份,一份中加入30mm的tcep,另一份中加入水,在37℃下孵育30min后加入不含还原剂的5
×
上样缓冲液进行凝胶电泳和 western blot(anti-biotin)。
[0065]
同样的,用ia-biotin探针进行标记,如图5中c所示,也可以得到类似的结果,ia-biotin 的标记信号也是随着l-半胱氨酸的加入逐渐升高,在还原剂存在的条件下信号丢失。
[0066]
实施例9蛋白质组中巯基化修饰的鉴定:hepg2和hepg2-cse细胞中过硫基的鉴定
[0067]
7.2
×
106hepg2-cse细胞在15-cm细胞培养盘中培养50h,更换新鲜的培养液后,加入 500μm的l-半胱氨酸继续培养9h。
[0068]
4x106hepg2细胞在10-cm细胞培养盘中培养50h,更换新鲜的培养液后继续培养9h。
[0069]
9h后,用pbs清洗细胞两次,然后直接在细胞培养盘中加入冷的4ml 20%tca,将细胞放置在4℃冰箱中30min,这个过程可以快速固定细胞同时对细胞进行破碎。30min后,用细胞刮收集蛋白质组,在4℃离心机中以20000g离心30min。分别用10%,5%的tca清洗蛋白质组,然后用冷丙酮清洗两次,将蛋白质组在室温下干燥后立即加入ph=5.00的6m尿素的
pbs 缓冲溶液,超声溶解。20000g离心10min,取上清,使用bio-rad dc assay对蛋白质进行定量。
[0070]
将hepg2-cse和hepg2蛋白质组稀释到2mg/ml后用荧光探针tmria和iaa进行标记。
[0071]
60μl反应体系,tmria浓度为50μm,反应在室温下进行2h。然后加入20mm iaa停止反应,反应在37℃下进行30min。将反应体系平均分成两份,一份中加入30mm的tcep,另一份中加入水,在37℃下孵育30min后加入不含还原剂的5
×
上样缓冲液进行凝胶电泳。
[0072]
50μl反应体系,iaa浓度为20mm,反应在室温下进行2h。然后加入不含还原剂的5
×
上样缓冲液进行凝胶电泳。
[0073]
实施例10蛋白质组中巯基化修饰的鉴定:胶内酶切
[0074]
(1)将提取完荧光照片的凝胶进行考马斯亮蓝染色,然后过夜脱色并拍摄照片。将凝胶用高纯水清洗两次。
[0075]
(2)按照荧光凝胶中所对应的条带位置对凝胶进行切割。换新手套,将胶置玻璃板上切下所需部分,并切成1-1.5mm见方的小粒,装进相应管子。
[0076]
(3)加500μl脱色剂(50%乙腈25mm nh4hco3),稍作涡旋,低速振荡15min,该过程进行两次至脱色彻底。待胶粒全部为无色透明,离心并除去液体。
[0077]
(4)加500μl脱水剂乙腈,稍作涡旋,低速振荡10min。待胶粒全部为白色,离心并除去液体。若胶粒仍绵软,重复脱水一次。
[0078]
(5)加50μl iaa(或每1mm宽胶带30μl的比例),室温下黑暗中孵育60min。用500μl 高纯水清洗胶粒,涡旋,离心除去液体。
[0079]
(6)加500μl脱水剂,稍作涡旋,低速振荡10min,或置冰箱中脱水。待胶粒全部为白色,离心并除去液体。若胶粒仍绵软,重复脱水一次。
[0080]
(7)按每1mm见方胶粒为1μl计,加足够的酶液(2ng/μl trypsin的50mm nh4hco3),置冰箱中45-60min使充分溶胀。若有明显液体盈余,(可稍作离心)除去多余液体。按每1mm 宽胶条2μl的比例加入50mm nh4hco3。37℃孵育过夜,12-16h。
[0081]
(8)加50μl提取液(50%乙腈,5%甲酸,45%高纯水)(或每1mm宽胶带30μl的比例没过),室温下高速震荡25min。离心并将液体移入新的标注好的1.5ml管。重复提取一次,合并提取液。
[0082]
将收集的肽段样品用真空离心干燥器除去溶剂,重悬在10μl上样溶液(95%高纯水,5%乙腈,5%甲酸)中,lc-ms/ms分析。
[0083]
为了初步验证一下该方法是否可以鉴定到巯基化修饰位点,首先用lc-ms/ms在蛋白质组中直接寻找iaa和过硫基的反应产物。如图6所示,对同样的蛋白质组分别用tmria和iaa 标记,然后进行凝胶电泳,根据荧光信号,将iaa标记的蛋白质组切割成对应的条带,尽量将荧光标记对应的条带单独切割,这样可以降低其他蛋白带来的背景干扰。然后用胶内酶切的方法(省略还原剂还原步骤)制得肽段样品,经lc-ms/ms分析。
[0084]
在hepg2细胞中成功的鉴定到了大约18个含有巯基化修饰的蛋白质和它们相应的位点,结果如表1,表1为18个巯基化修饰的蛋白质和它们相应的位点,其中包括enog,gapdh在内已经报道含有巯基化修饰的蛋白质。为了进一步验证,在500μml-半胱氨酸培养的 hepg2-cse细胞中,选择性的对标记相对较强的条带做了胶内酶切,成功的鉴定到了gapdh 上第152位巯基化修饰的半胱氨酸(参见图7),这是用mbst方法报道的第一个带有巯基化修
饰的位点。同时也鉴定到了enog的第357位半胱氨酸,gapdh的第247位半胱氨酸,这些都是没有报道的。有意思的是,gapdh的c247报道有s-nitrosylation修饰,可能是由于 hepg2-cse细胞中h2s含量升高,与它们之间发生转化新产生的过硫基。
[0085]
表中prot.表示uniprot(universal protein)是包含蛋白质序列,功能信息,研究论文索引的蛋白质数据库,整合了包括ebi(european bioinformatics institute),sib(theswiss institute of bioinformatics),pir(protein information resource)三大数据库的资源。pept.表示具体的蛋白序列。*表示鉴定到的半胱氨酸。
[0086]
表-1-鉴定到的hepg2细胞中含有巯基化修饰的蛋白质和相应的位点(带*标记)
[0087][0088][0089]
本技术提供的实施例之间的相似部分相互参见即可,以上提供的具体实施方式只是本技术总的构思下的几个示例,并不构成本技术保护范围的限定。对于本领域的技术人员而言,在不付出创造性劳动的前提下依据本技术方案所扩展出的任何其他实施方式都属
于本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1