用于非结核分枝杆菌感染的临床诊断中的标志物使用的蛋白多肽及其蛋白及用途的制作方法
1.本发明涉及生物医药领域,具体涉及用于非结核分枝杆菌感染的临床诊断中的标志物使用的蛋白多肽及其蛋白及用途。
背景技术:
2.非结核分枝杆菌(nontuberculosis mycobacteria,ntm)是指结核分枝杆菌、牛分枝杆菌与麻风分枝杆菌以外的分枝杆菌,临床上常见的ntm病原菌主要包括脓肿分枝杆菌等(1)。非结核分枝杆菌病是指人类感染ntm所引起相关组织或脏器的病变。近年来,全球非结核分枝杆菌肺病的患病率呈上升趋势,已成为常见病,且对人类健康造成了威胁(2)。
3.非结核分枝杆菌(ntm)主要累及肺脏,ntm肺病缺乏特异性临床表现和体征,与其他疾病鉴别困难(3)。很多临床医师常忽略ntm肺病的存在,常出现误诊或者漏诊。目前没有高效的ntm感染的诊断方法。
4.ntm感染会诱导机体的部分免疫细胞呈免疫记忆状态,该类细胞遇到ntm抗原再次刺激后,会特异性产生包括伽马干扰素(ifn-γ)在内的大量细胞因子(4),据此可以诊断机体是否被ntm病原菌感染。本发明中,发明人筛选到两种可以用于脓肿分枝杆菌感染诊断的蛋白多肽,并证实这两种多肽及其蛋白有潜力用于脓肿分枝杆菌感染的临床诊断中的标志物使用。
5.参考文献:
6.1.cara d varley,kevin l winthrop,nontuberculous mycobacteria:diagnosis and therapy.clin chest med,2022mar;43(1):89-98.doi:10.1016/j.ccm.2021.11.007.
7.2.li-ping cheng,shan-hao chen,hai lou,xu-wei gui,xiao-na shen,jie cao,wei sha,qin sun,factors associated with treatment outcome in patients with nontuberculous mycobacterial pulmonary disease:a large population-based retrospective cohort study in shanghai,trop med infect dis.2022feb 15;7(2):27.doi:10.3390/tropicalmed7020027.
8.3.ye gu,chunyan wu,fangyou yu,xuwei gui,jun ma,liping cheng,qin sun,wei sha,application of endobronchial ultrasonography using a guide sheath and electromagnetic navigation bronchoscopy in the diagnosis of atypical bacteriologically-negative pulmonary tuberculosis,ann transl med.2019oct;7(20):567.doi:10.21037/atm.2019.09.37.
9.4.chi yang,xuejiao luo,lin fan,wei sha,heping xiao,haiyan cui,performance of interferon-gamma release assays in the diagnosis of nontuberculous mycobacterial diseases-a retrospective survey from2011to 2019,front cell infect microbiol.2021feb 18;10:571230.doi:10.3389/
γ等细胞因子,因此它们可以用于脓肿分枝杆菌感染患者的临床诊断中的标志物使用。
附图说明
22.图1为本发明的elisa检测ifn-γ在细胞培养上清中的含量示意图。
23.图2为本发明的elspot检测分泌ifn-γ的细胞数目示意图。
具体实施方式
24.发明人对脓肿分枝杆菌感染患者的肺部病理组织进行蛋白质谱分析,鉴定出多种可能有后续应用潜力的脓肿分枝杆菌的蛋白多肽。
25.通过酶联免疫吸附测定(enzyme linked immunosorbent assay,简写elisa或elasa)和酶联免疫斑点技术(enzyme linked immunospot assay,lispot)进行检测,发现其中两条多肽及其蛋白,能够特异性的刺激脓肿分枝杆菌感染患者的外周淋巴细胞产生伽马干扰素(ifn-γ)。这两个多肽及其蛋白可以用于脓肿分枝杆菌感染的临床诊断中的标志物使用。
26.1.由病理组织中寻找分枝杆菌的蛋白多肽:
27.收集手术切除的脓肿分枝杆菌感染患者的肺部病灶组织。将组织裂解后,进行蛋白质谱分析,通过与数据库比对。鉴定出多条脓肿分枝杆菌的蛋白多肽。
28.通过人工合成多肽,用灭菌水溶解后,贮存于-20℃备用。
29.将蛋白多肽序列进行blast分析,获得包含相应多肽的完整蛋白序列信息。按照蛋白序列信息,合成完整蛋白质。用灭菌水溶解后贮存于-20℃备用。
30.2.制备外周血pbmc细胞:
31.招募脓肿分枝杆菌感染患者和健康对照人群。采集受试者5ml的外周血注入到含肝素钠或枸橼酸钠的抗凝采血管,将采血管颠倒,充分混匀。按照我们已经建立的技术体系(如参考文献5),从外周血中用ficoll-hypaque(聚蔗糖-泛影葡胺)密度梯度离心的方法分离外周血单个核细胞(peripheral blood mononuclear cell,pbmc)。
32.3.elisa检测:
33.3.1用1得到的蛋白多肽刺激2制备的pbmc细胞
34.(1)将制备好的pbmc细胞铺于96孔板中,每孔铺100ul,每例样本铺4个孔。
35.(2)每例样本按阴性对照孔(细胞培养基)、阳性对照孔(佛波酯pma工作浓度100ng/ml)、417号多肽刺激孔(工作浓度1mg/ml)、421号多肽刺激孔(工作浓度1mg/ml),分别加入刺激物,即1得到的蛋白多肽。
36.(3)细胞孵育20-24h后,收集细胞培养上清做后续elisa检测。
37.3.2 elisa检测
38.(1)根据实验孔(空白和标准品)数量,确定所需的elisa板条数目。样本(含标准品)和空白都应做复孔。
39.(2)加样:100l/well加入稀释后的细胞因子(cytokine standard)(细胞因子采用的是ifn-γ)至标准品孔,100l/well加入样本至样本孔,100l/well加入稀释缓冲液(dilution buffer)r(1
×
)至空白对照孔。加样:100ml/well加入稀释后的细胞因子(cytokine standard)至标准品孔,100ml/well加入样本至样本孔,100ml/well加入
dilution bufferr(1
×
)至空白对照孔。
40.(3)加检测抗体:50l/well加入抗体工作液(biotinylated antibody)。混匀后盖上封板膜,室温(18-25℃)孵育2小时。
41.(4)洗板:扣去孔内液体,300l/well加入1
×
冲洗缓冲液(washing buffer);停留1分钟后弃去孔内液体。重复3次,每一次在滤纸上扣干。
42.(5)加酶:100l/well加入辣根过氧化物酶标记链霉亲和素工作液(streptavidin-hrp)。盖上封板膜,室温(18-25℃)孵育20分钟。
43.(6)洗板:重复步骤(4)。
44.(7)显色:100ml/well加入tmb(3,3',5,5'-四甲基联苯胺)显色液,室温(18-25℃)避光孵育5-30分钟,根据孔内颜色的深浅(深蓝色)来判定终止反应(深蓝色出现便立即终止反应)。通常显色10-20分钟可以达到很好的效果。
45.(8)终止反应:100ml/well迅速加入终止液(stop solution)终止反应。
46.(9)读板:终止后10分钟内,用检测波长450nm读值。推荐用双波长即检测波长450nm、参考波长或校正波长610-630nm同时读板。
47.4.elispot检测:
48.4.1用蛋白多肽刺激pbmc细胞
49.(1)将预包被了抗ifn-γ的单克隆抗体的pvdf板从4℃取出,恢复室温,包被板每孔加入200μl rpmi-1640培养基,室温静置5-10分钟后将培养基去除。
50.(2)加入刺激物:10μl/well,具体如下:
51.阳性对照孔:加入50ug/ml的pha(植物血凝素);
52.阴性对照孔(含背景空白对照孔):加入rpmi-1640培养基;
53.实验孔:加入20-100ng/ml的ntm合成蛋白。
54.(3)加入细胞悬液:将调整好浓度的细胞悬液加入各实验孔,100μl/孔。
55.(4)孵育:所有样品和刺激物加完后,盖好板盖。放入37℃,5%co 2
培养箱培养16-24小时。
56.4.2elispot检测:
57.(1)倾倒孔内细胞及培养基,加入冰冷的去离子水,200μl/well,4℃冰箱放置10分钟低渗裂解细胞。
58.(2)甩出孔内液体,加入1
×
冲洗缓冲液(washing buffer),260μl/well,停留1分钟后弃去孔内液体,重复六次,每一次在吸水纸上扣干。
59.(3)检测抗体孵育:将稀释好的生物素标记的抗体(biotinylated antibody)工作液加入各实验孔,100μl/well。37℃孵育1小时。
60.(4)重复步骤(2)。
61.(5)将稀释好的辣根过氧化物酶标记链霉亲和素(streptavidin-hrp)工作液加入各实验孔,100μl/well。37℃孵育1小时。
62.(6)甩出孔内液体,加入1
×
washing buffer,260μl/well,停留1分钟后弃去孔内液体,重复五次,每一次在吸水纸上扣干,然后揭开板底座,用去离子水/自来水洗涤膜底面及底座,用吸水纸小心吸干底座及膜底残留的水迹,合上底座,加入1
×
冲洗缓冲液(washing buffer),260μl/well,停留1分钟后弃去孔内液体,彻底扣干孔内液体。
63.(7)将现配的aec显色液加入各实验孔,100μl/well。室温避光静置5-30分钟,根据斑点生成情况选择终止显色时间。若室温低于20℃,每隔5-10分钟检查一次。
64.(8)倾倒孔内液体,揭开板底座,用去离子水/自来水洗涤正反面及底座3-5遍,终止显色。将板放置在室温阴凉处,待其自然晾干后合上底座。
65.(9)用放大镜或倒置的显微镜对elispot板的斑点进行计数,每一个点代表一个分泌ifn-γ的细胞,即斑点形成单位(spot forming units)。
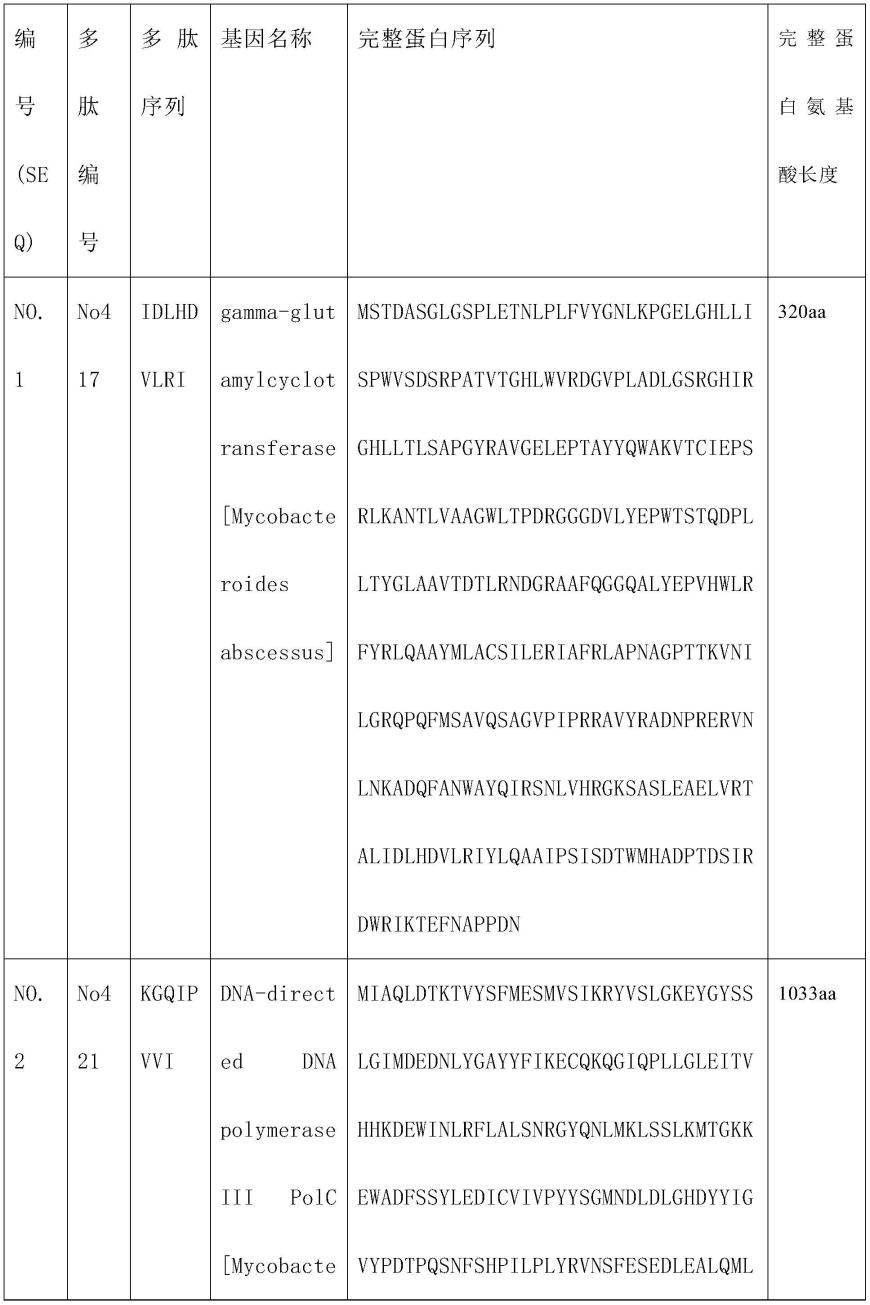
66.(10)阴性对照孔要求《10sfu/106pbmc,阳性对照孔要求》25sfu/106pbmc。
67.5.结果:
68.5.1筛选到两条蛋白多肽能够特异性刺激ntm患者的pbmc细胞大量分泌ifn-γ。
69.为了从质谱分析获得的多条蛋白多肽中筛选出具有临床诊断应用潜力的多肽,发明人利用每条多肽分别刺激ntm患者和健康对照人群来源的pbmc细胞,收集培养上清。
70.采用elisa的方法检测上清中ifn-γ的含量。结果表明,编号为no417和no421的多肽(表1),刺激pbmc后,在ntm患者的细胞培养上清中ifn-γ的含量显著高于未刺激组(图1),即多肽no417和no421能够特异性刺激ntm患者的pbmc细胞,诱导大量产生ifn-γ。
71.在图1当中,medium代表细胞培养基的对照组;pma代表阳性刺激组;no417代表用417号多肽刺激组;no421代表用421号多肽刺激组。
72.表1.有潜力用于临床诊断ntm感染患者的多肽信息。
73.74.[0075][0076]
5.2蛋白多肽no417和no421能够特异性诱导ntm患者的更多pbmc细胞分泌ifn-γ。
[0077]
为了验证蛋白多肽对ntm来源pbmc细胞诱导的特异性,发明人采用elispot的方法比较了蛋白多肽刺激ntm和健康人(healthy control,简称hc)来源的pbmc细胞后分泌ifn-γ的细胞数目。
[0078]
结果表明,在多肽no417和no421分别刺激后,与健康人hc的pbmc细胞相比,ntm来源的pbmc细胞中产生了更多的ifn-γ阳性斑点(如图2所示)。
[0079]
图2中的a为no417多肽刺激后pbmc细胞中分泌ifn-γ的阳性细胞数目。
[0080]
ntm是指ntm感染患者的pbmc细胞;hc是指健康人群来源的pbmc细胞。b为no421多肽刺激后pbmc细胞中分泌ifn-γ的阳性细胞数目。
[0081]
ntm是指ntm感染患者的pbmc细胞;hc是指健康人群来源的pbmc细胞。
[0082]
通过上述大量的实验,本发明的发明人出乎意料地发现:
[0083]
脓肿分枝杆菌的蛋白多肽no417(序列idlhdvlri)和no421(序列kgqipvvi)及其完整蛋白(分别为:gamma-glutamylcyclotransferase[mycobacteroides abscessus],dna-directed dna polymerase iii polc[mycobacteroides abscessus subsp.abscessus]),能够特异性刺激脓肿分枝杆菌感染患者的淋巴细胞分泌ifn-γ等细胞因子,因此它们可以用于脓肿分枝杆菌感染患者的临床诊断中的标志物使用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1