一种蔬果中苯醚菌酯残留量的检测方法与流程
1.本发明属于食品安全检测技术领域,尤其涉及一种蔬果中苯醚菌酯残留量的检测方法。
背景技术:
2.苯醚菌酯是具有高效杀菌活性的甲氧基丙烯酸甲酯类化合物,具有杀菌谱广、杀菌活性高、见效快,且耐雨水冲刷、持效期长等特点,属高效、低毒农药,其对各种作物的白粉病、锈病、霜霉病、炭疽病等都表现出优异的防治效果。另外,苯醚菌酯是一个预防兼治的杀菌剂,经药剂喷施后植株的光合作用会增强,能使作物在较长时间内保持青枝绿叶,提高了作物的产量和品质。我国最新版的gb 2763-2021《食品安全国家标准食品中农药最大残留限量》对蔬菜类别中的黄瓜作了限量规定,最大残留限量为0.5mg/kg,该限量为临时限量。
3.检测蔬果中苯醚菌酯残留,目前没有国家推荐标准;检索文献论文方法少,所使用的方法均为液相色谱分析法。
4.现有技术存在的问题及缺陷为:液相色谱分析方法需要使用大量的有机溶剂进行提取,使用多种溶剂作为流动相,步骤繁琐,试剂耗费量大,废液产生较多容易污染环境,另外液相色谱法存在检测限较高,容易产生假阳性的缺点。解决此问题的难度在于前处理需要筛选出合适的除杂方式,质谱需要使用质谱全扫描确定目标物,再进一步选择监测合适的离子对,排除干扰离子,通过优化质谱参数选择合适的离子对进行监测。
技术实现要素:
5.针对现有技术存在的问题,本发明提供了一种蔬果中苯醚菌酯残留量的检测方法。
6.本发明是这样实现的,使用乙腈溶液加入1包quechers提取粉包(含4gmgso4、1g nacl、0.5g柠檬酸氢二钠、1g柠檬酸钠),水平振荡提取蔬菜或水果样品中残留的苯醚菌酯,提取液经[psa(乙二胺-n-丙基硅烷),无水硫酸镁,c18(十八烷基键合硅胶吸附剂)]基质分散净化后,气相色谱-三重四极杆质谱(gc-ms/ms)检测。包括:
[0007]
步骤一,采样和试样制备:按照食品类别及测定部位的要求,将样品打成匀浆,并分装标记保存,备用,即得到均匀待测样品;
[0008]
步骤二,提取:称取样品于离心管中,加乙腈,再加入quechers提取粉包(含4g mgso4、1g nacl、0.5g柠檬酸氢二钠、1g柠檬酸钠),振荡后置于水浴摇床,振荡提取后,取上清液备用。通过quechers提取粉包能起到去除样品中干扰物质,去除多余水分的作用;
[0009]
步骤三,净化:吸取步骤二中上清液2ml于高速离心管中[高速离心管中含有0.05g psa(乙二胺-n-丙基硅烷),0.15g无水硫酸镁,0.015g c18],振荡充分混合后吸取上清液1.0ml于小玻璃管中,用乙酸乙酯溶剂置换,并定容到2ml,过尼龙滤膜,供气相色谱-三重四级杆质谱联用仪(gc-ms/ms)分析。其中psa有助于去除样品中的有机酸,色素等成分,c18有
助于去除非极性杂质,无水硫酸镁有助于去除水分。
[0010]
步骤四,标准溶液的配制:吸取适量苯醚菌酯标准溶液,稀释定容至25ml,配制成40mg/l的苯醚菌酯标准储备液;吸取适量苯醚菌酯标准储备液,稀释成1.0mg/l的标准工作液;
[0011]
步骤五,标准曲线配备:吸取一定量的标准工作液,逐级用空白基质溶液稀释成梯度工作溶液,供气相色谱-三重四级杆质谱联用仪测定;
[0012]
步骤六,结果计算:测量样品和相当标准品的特征单离子信号响应峰面积,对苯醚菌酯的含量进行计算。
[0013]
进一步,所述步骤一中,将样品置于-20℃-16℃条件下保存。
[0014]
进一步,所述步骤二中,称取10g(精确到0.01g)样品于50ml塑料离心管中,加10ml乙腈,再加入quechers提取粉包一包(含4g mgso4、1g nacl、0.5g柠檬酸氢二钠、1g柠檬酸钠)。
[0015]
进一步,所述步骤二中加一颗陶瓷均质子,盖上离心管盖,激烈振荡30s。
[0016]
进一步,所述步骤二中振荡提取10min,以4200r/min离心5min。
[0017]
进一步,所述步骤三中的高速离心管中含有0.05g psa(乙二胺-n-丙基硅烷),0.15g无水硫酸镁,0.015g c18,振荡参数为12000r/min,离心5min。
[0018]
进一步,所述标准储备液的制备方法包括:
[0019]
准确吸取1ml苯醚菌酯标准溶液(1000mg/l),用乙腈稀释定容至25ml,配制成40mg/l的苯醚菌酯标准储备液转移至棕色玻璃瓶中,于0~4℃避光储存。
[0020]
进一步,所述标准工作液的制备方法包括:准确吸取苯醚菌酯标准储备液适量,用乙腈稀释,配制成1.0mg/l的标准工作液,于0~4℃避光储存,备用;临用时,用空白基质溶液逐级稀释成适当浓度,待测。
[0021]
进一步,所述步骤五中的气相色谱条件为:
[0022]
毛细管柱:30m
×
0.25mm,0.25μm;
[0023]
载气:以高纯氦气为载气,流速1.0ml/min;
[0024]
进样模式:不分流进样;
[0025]
进样量:1μl;
[0026]
进样口温度:250℃;
[0027]
升温程序:60℃保持1min,以25℃/min升温到90℃,保持2min,以25℃/min升温到180℃,再以5℃/min升温到300℃,保持5min。
[0028]
质谱条件为:
[0029]
离子源:电子轰击源(electron impact ion source,ei);
[0030]
电离能量:70ev;
[0031]
进样口温度:280℃;
[0032]
离子源温度:300℃;
[0033]
传输线温度:300℃;
[0034]
溶剂延迟:10min;
[0035]
发射电流:100μa;
[0036]
ms电离方式:ei;
[0037]
碰撞气压力:1.2mtorr(ar)。
[0038]
进一步,所述步骤六中苯醚菌酯的含量用下式计算:
[0039][0040]
式中:x为试样中目标化合物残留含量,单位为μg/kg;
[0041]
a为样液中目标化合物色谱峰面积;
[0042]as
为标准工作溶液中目标化合物色谱峰面积;
[0043]
c为标准工作溶液中目标化合物浓度,单位为μg/l;
[0044]
v为最终样液的定容体积,单位为ml;
[0045]
m为最终样液所代表试样量,单位为g。
[0046]
结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
[0047]
第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
[0048]
1.净化条件的选择节约溶剂,通过quechers净化方式,节约了提取时间,固相分散萃取,节约了成本。
[0049]
2.质谱条件的优化,选取排除干扰后的定性、定量离子对,使结果更加准确,定量限符合gb 2763要求。
[0050]
3.实验选取了三种基质,在三到四个水平进行加标回收实验,实验结果表明具有良好的回收率,所选取离子对,基质不存在干扰,平均相对标准偏差符合gb/t 27404-2008《实验室质量控制规范食品理化检测》要求。
[0051]
第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
[0052]
本发明主要用于测定蔬菜,水果中残留的苯醚菌酯。本发明具有操作简单,除杂效果好,快速、灵敏度高、定性定量准确的特点。
[0053]
本发明提供了一种更快速、更准确、稳定、有效的检测方法,提高检测效率和准确度。
[0054]
第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
[0055]
本发明的技术方案填补了国内外业内技术空白:目前,我国最新版的gb2763《食品安全国家标准食品中农药最大残留限量》中对蔬菜类别中的黄瓜中苯醚菌酯作了限量规定,最大残留限量为0.5mg/kg,没有推荐检测标准,经查询,目前蔬菜水果中苯醚菌酯没有国家、行业相关标准,存在标准空白,现有涉及蔬果中苯醚菌酯残留量检测的文献比较少,所使用的方法均为液相色谱法,未检索到使用气相色谱串联三重四极杆质谱的方法测定苯醚菌酯残留的相关报道。因此,建立一个蔬菜和水果中快速、准确的苯醚菌酯残留量的检测方法,既能满足gb2763《食品安全国家标准食品中农药最大残留限量》对苯醚菌酯残留量的检测要求,确保农产品的质量安全,也能对提高检测机构水平,为该项目提供更多的快速、准确的检测方法参考具有重要的意义。
附图说明
[0056]
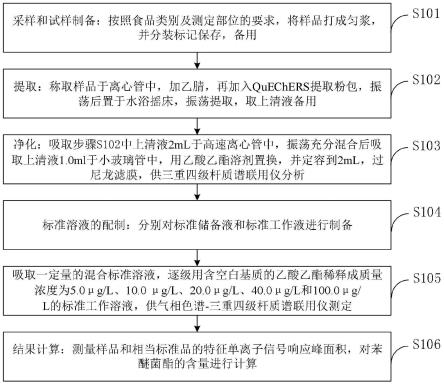
图1是本发明实施例提供的蔬果中苯醚菌酯残留量的检测方法的流程图。
[0057]
图2是本发明实施例提供的不含苯醚菌酯的黄瓜空白样品的选择离子色谱图。
[0058]
图3是本发明实施例提供的添加在空白黄瓜基质中的0.01mg/kg的苯醚菌酯标液的选择离子色谱图。
具体实施方式
[0059]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0060]
一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
[0061]
如图1所示,本发明实施例提供的蔬果中苯醚菌酯残留量的检测方法包括:
[0062]
s101,采样和试样制备:按照食品类别及测定部位的要求,将样品打成匀浆,并分装标记保存,备用;
[0063]
s102,提取:称取样品于离心管中,加乙腈,再加入quechers提取粉包,振荡后置于水浴摇床,振荡提取,取上清液备用;
[0064]
s103,净化:吸取步骤s102中上清液2ml于高速离心管中,振荡充分混合后吸取上清液1.0ml于小玻璃管中,用乙酸乙酯溶剂置换,并定容到2ml,过尼龙滤膜,供气相色谱-三重四级杆质谱联用仪分析;
[0065]
s104,标准溶液的配制:分别对标准储备液和标准工作液进行制备;
[0066]
s105,吸取一定量的混合标准溶液,逐级用含空白基质的乙酸乙酯稀释成质量浓度为5.0μg/l、10.0μg/l、20.0μg/l、40.0μg/l和100.0μg/l的标准工作溶液,供气相色谱-三重四级杆质谱联用仪测定;
[0067]
s106,结果计算:测量样品和相当标准品的特征单离子信号响应峰面积,对苯醚菌酯的含量进行计算。
[0068]
二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
[0069]
实施例1:黄瓜中苯醚菌酯残留量的检测方法
[0070]
材料与方法
[0071]
1.1主要试剂与药品
[0072]
苯醚菌酯标准溶液(质量浓度1000mg/l,天津阿尔塔科技有限公司);
[0073]
乙酸乙酯、乙腈(色谱纯,美国赛默飞世尔科技有限公司);
[0074]
quechers提取粉包[shimsen quechers extraction salts packets only,4gmgso4,1gnacl,0.5g dhs(柠檬酸氢二纳),1g tscd(柠檬酸钠)](广州凯恩化工科技有限公司)。
[0075]
1.2主要仪器及设备
[0076]
tsq8000evo气相色谱-三重四极杆串联质谱仪、tr-pesticide毛细管柱(30m
×
0.25mm,0.25μm)(美国赛默飞世尔科技公司);
[0077]
700e均质器(美国tomtec公司);
[0078]
bt223s分析天平[精确到0.01g(北京sartorius公司)];
[0079]
3-16p高速离心机(德国sigma公司);
[0080]
et3301全自动氮吹浓缩仪(可控温上海欧陆公司);
[0081]
promax2020水平往复式振荡器(德国heidolph公司)
[0082]
multi reax涡旋振荡器(德国heidolph公司);
[0083]
joyoung(九阳)jys-m01型磨粉机:九阳股份有限公司。
[0084]
步骤方法
[0085]
(1)样品前处理
[0086]
称取经充分混匀的黄瓜10g(精确到0.01g)于50ml塑料离心管中,加10ml乙腈,加入quechers提取粉包一包,加一颗陶瓷均质子,盖上离心管盖,激烈振荡30s,后置于水浴摇床,振荡提取10min,以4200r/min离心5min,取上清液备用。吸上述上清液2ml于高速离心管中[高速离心管中含有0.05gpsa(乙二胺-n-丙基硅烷),0.15g无水硫酸镁,0.015g c18],振荡充分混合,12000r/min离心5min后吸取上清液1ml于小玻璃管中,用乙酸乙酯溶剂置换,并定容到2ml,过尼龙滤膜,供gc-ms/ms分析。
[0087]
(2)标准工作溶液的配制
[0088]
准确吸取1ml苯醚菌酯标准溶液(1000mg/l),用乙腈稀释定容至25ml,配制成40mg/l的苯醚菌酯标准储备液转移至棕色玻璃瓶中,得到苯醚菌酯储备液。准确吸取0.25ml苯醚菌酯标准储备液,用乙腈定容到10ml,得到1.0mg/l的标准工作液。精确吸取一定量的标准工作溶液,逐级用含空白基质的乙酸乙酯稀释成质量浓度为5.0μg/l、10.0μg/l、20.0μg/l、40.0μg/l和100.0μg/l的标准基质工作溶液。
[0089]
(3)气相色谱-三重四级杆质谱联用仪测定
[0090]
气相色谱条件
[0091]
毛细管柱:赛默飞tr-pesticide毛细管柱(30m
×
0.25mm,0.25μm);载气:以高纯氦气为载气(99.999%以上),流速1.0ml/min;进样模式:不分流进样;进样量:1μl;进样口温度:250℃;升温程序:60℃保持1min,以25℃/min升温到90℃,保持2min,以25℃/min升温到180℃,再以5℃/min升温到300℃,保持5min。
[0092]
(4)质谱条件
[0093]
离子源:电子轰击源(electron impact ion source,ei);电离能量:70ev;进样口温度:280℃;离子源温度:300℃;传输线温度:300℃;溶剂延迟:10min;发射电流:100μa;ms电离方式:ei;碰撞气压力:1.2mtorr(ar);定时选择反应检测(timed selective reaction monitoring,timed-srm)模式,监测离子对,205.200-》145.100,145.100-》102.100,以205.200-》145.100为定量离子对。
[0094]
试样中被测农药残留量用下式计算:
[0095][0096]
式中:x为试样中目标化合物残留含量,单位为μg/kg;
[0097]
a为样液中目标化合物色谱峰面积;
[0098]as
为标准工作溶液中目标化合物色谱峰面积;
[0099]
c为标准工作溶液中目标化合物浓度,单位为μg/l;
[0100]
v为最终样液的定容体积,单位为ml;
[0101]
m为最终样液所代表试样量,单位为g。
[0102]
定性鉴定:
[0103]
样品的gc-ms/ms数据符合下列要求时,可判定为目标物残留。在相同试验条件下,样品中待测物质与标准品具有相同的保留时间,偏差在
±
2.5%以内,监测离子的信噪比≥3。
[0104]
对同一化合物,样品中目标化合物的定性离子和定量离子的相对丰度比与质量浓度相当的标准溶液相比,相对离子丰度》50%,允许相对偏差
±
20%;相对离子丰度》20%~50%(含),允许相对偏差
±
25%;相对离子丰度》10%~20%(含),允许相对偏差
±
30%;相对离子丰度≤10%(含),允许相对偏差
±
50%。
[0105]
以标准工作液的色谱峰面积对其相应浓度进行回归分析,得到标准工作曲线如下表1。
[0106]
表1黄瓜空白基质中苯醚菌酯的标准曲线
[0107]
名称保留时间(min)回归方程相关系数苯醚菌酯20.85y=1.242e4x-1.007e40.9997
[0108]
加标回收率和重复性
[0109]
在不含苯醚菌酯的黄瓜中加入0.01、0.02、0.05和0.5mg/kg四个浓度水平的苯醚菌酯标准溶液,待标准溶液添加30min后按上述处理步骤进行残留量测定,0.5mg/kg添加浓度的样品待测液测定前,用黄瓜空白基质溶液将净化定容液稀释至残留量在线性范围之内。将测定浓度与农药理论添加浓度进行比较,得到农药平均添加回收率,每个添加水平平行测定6次,得其平均相对标准偏差,测定结果见表2。由表2可以看出,在四个加标水平上,苯醚菌酯的平均回收率为87.1%~101.6%,平均相对标准偏差(rsd)为1.8%~8.3%,说明本发明方法的回收率较高,重复性好。
[0110]
表2苯醚菌酯在黄瓜基质中的回收率和重复性(n=6)
[0111][0112]
实施例2:苹果中苯醚菌酯残留量的检测方法
[0113]
材料与方法
[0114]
主要试剂与药品,仪器及设备同上述黄瓜中苯醚菌酯残留量的检测一致。
[0115]
步骤方法
[0116]
(1)样品前处理
[0117]
称取经充分混匀的苹果10g(精确到0.01g)于50ml塑料离心管中,加10ml乙腈,加
入quechers提取粉包一包,加一颗陶瓷均质子,盖上离心管盖,激烈振荡30s,后置于水浴摇床,振荡提取10min,以4200r/min离心5min,取上清液备用。吸上述上清液2ml于高速离心管中[高速离心管中含有0.05g psa(乙二胺-n-丙基硅烷),0.15g无水硫酸镁,0.015g c18],振荡充分混合,12000r/min离心5min后吸取上清液1.0ml于小玻璃管中,用乙酸乙酯溶剂置换,并定容到2ml,过尼龙滤膜,供gc-ms/ms分析。
[0118]
(2)标准工作溶液的配制
[0119]
准确吸取1ml苯醚菌酯标准溶液(1000mg/l),用乙腈稀释定容至25ml,配制成40mg/l的苯醚菌酯标准储备液转移至棕色玻璃瓶中,得到苯醚菌酯储备液。准确吸取0.25ml苯醚菌酯标准储备液,用乙腈定容到10ml,得到1.0mg/l的标准工作液。精确吸取一定量的标准工作溶液,逐级用含空白苹果基质的乙酸乙酯稀释成质量浓度为5.0μg/l、10.0μg/l、20.0μg/l、40.0μg/l和100.0μg/l的标准基质工作溶液。
[0120]
(3)气相色谱-三重四级杆质谱联用仪测定
[0121]
操作步骤、色谱和质谱条件及计算公式与上述黄瓜样品中苯醚菌酯残留量的检测一致。
[0122]
定性鉴定:
[0123]
同上述黄瓜样品中苯醚菌酯残留量的检测一致。
[0124]
线性关系见表3
[0125]
表3苹果空白基质中苯醚菌酯的标准曲线
[0126]
名称保留时间(min)回归方程相关系数苯醚菌酯20.85y=1.122e4x-7.961e30.9998
[0127]
加标回收率和重复性
[0128]
在不含苯醚菌酯的苹果中加入0.01mg/kg、0.02mg/kg和0.05mg/kg三个浓度水平的苯醚菌酯标准溶液,待标准溶液添加30min后按上述处理步骤进行残留量测定。将测定浓度与农药理论添加浓度进行比较,得到农药平均添加回收率,每个添加水平平行测定6次,得其平均相对标准偏差,测定结果见表4。由表4可以看出,在三个加标水平上,苯醚菌酯的平均回收率为90.9%~95.4%,平均相对标准偏差(rsd)为3.1%~9.8%,说明本发明方法的回收率较高,重复性好。
[0129]
表4苯醚菌酯在苹果基质中的回收率和重复性(n=6)
[0130][0131]
实施例3:包菜中苯醚菌酯残留量的检测方法
[0132]
材料与方法
[0133]
主要试剂与药品,仪器及设备同上述黄瓜中苯醚菌酯残留量的检测一致。
[0134]
步骤方法
[0135]
(1)样品前处理
[0136]
称取经充分混匀的包菜10g(精确到0.01g)于50ml塑料离心管中,加10ml乙腈,加
入quechers提取粉包一包,加一颗陶瓷均质子,盖上离心管盖,激烈振荡30s,后置于水浴摇床,振荡提取10min,以4200r/min离心5min,取上清液备用。吸上述上清液2ml于高速离心管中[高速离心管中含有0.05gpsa(乙二胺-n-丙基硅烷),0.15g无水硫酸镁,0.015g c18],振荡充分混合,12000r/min离心5min后吸取上清液1.0ml于小玻璃管中,用乙酸乙酯溶剂置换,并定容到2ml,过尼龙滤膜,供gc-ms/ms分析。
[0137]
(2)标准工作溶液的配制
[0138]
准确吸取1ml苯醚菌酯标准溶液(1000mg/l),用乙腈稀释定容至25ml,配制成40mg/l的苯醚菌酯标准储备液转移至棕色玻璃瓶中,得到苯醚菌酯储备液。准确吸取0.25ml苯醚菌酯标准储备液,用乙腈定容到10ml,得到1.0mg/l的标准工作液。精确吸取一定量的标准工作溶液,逐级用含空白包菜基质的乙酸乙酯稀释成质量浓度为5.0μg/l、10.0μg/l、20.0μg/l、40.0μg/l和100.0μg/l的标准基质工作溶液。
[0139]
(3)气相色谱-三重四级杆质谱联用仪测定
[0140]
作步骤、色谱和质谱条件及计算公式与上述黄瓜样品中苯醚菌酯残留量的检测一致。
[0141]
定性鉴定:
[0142]
同上述黄瓜样品中苯醚菌酯残留量的检测一致。
[0143]
线性关系见表5
[0144]
表5包菜空白基质中苯醚菌酯的标准曲线
[0145]
名称保留时间(min)回归方程相关系数苯醚菌酯20.85y=4.096e3x+1.411e40.9999
[0146]
加标回收率和重复性
[0147]
在不含苯醚菌酯的包菜中加入0.01mg/kg、0.02mg/kg和0.05mg/kg三个浓度水平的苯醚菌酯标准溶液,待标准溶液添加30min后按上述处理步骤进行残留量测定。将测定浓度与农药理论添加浓度进行比较,得到农药平均添加回收率,每个添加水平平行测定6次,得其平均相对标准偏差,测定结果见表6。由表6可以看出,在三个加标水平上,苯醚菌酯的平均回收率为93.1%~96.2%,平均相对标准偏差(rsd)为1.1%~7.7%,说明本发明方法的回收率较高,重复性好。
[0148]
表6苯醚菌酯在包菜基质中的回收率和重复性(n=6)
[0149][0150]
三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
[0151]
(1)采样和试样制备
[0152]
按照gb 2763-2021《食品安全国家标准食品中农药最大残留限量》中附录a(规范性)-食品类别及测定部位的要求,将样品打成匀浆,并分装标记置于-20℃-16℃条件下保
存,备用。
[0153]
(2)提取:准确称取10g(精确到0.01g)样品于50ml塑料离心管中,加10ml乙腈,在加入quechers提取粉包一包,加一颗陶瓷均质子,盖上离心管盖,激烈振荡30s,后置于水浴摇床,振荡提取10min,以4200r/min离心5min,取上清液备用。
[0154]
(3)净化:吸取上述(2)中上清液2ml于高速离心管中[高速离心管中含有0.05g psa(乙二胺-n-丙基硅烷),0.15g无水硫酸镁,0.015g c
18
],振荡充分混合,12000r/min离心5min后吸取上清液1.0ml于小玻璃管中,用乙酸乙酯溶剂置换,并定容到2ml,过尼龙滤膜,供gc-ms/ms分析。
[0155]
(4)标准溶液的配制
[0156]
标准储备液:准确吸取1ml苯醚菌酯标准溶液(1000mg/l),用乙腈稀释定容至25ml,配制成40mg/l的苯醚菌酯标准储备液转移至棕色玻璃瓶中,于0~4℃避光储存。
[0157]
标准工作液:准确吸取苯醚菌酯标准储备液适量,用乙腈稀释,配制成1.0mg/l的标准工作液,于0~4℃避光储存,备用。临用时,用空白基质溶液逐级稀释成适当浓度,待测。
[0158]
(5)气相色谱条件
[0159]
毛细管柱:赛默飞tr-pesticide毛细管柱(30m
×
0.25mm,0.25μm);载气:以高纯氦气为载气(99.999%以上),流速1.0ml/min;进样模式:不分流进样;进样量:1μl;进样口温度:250℃;升温程序:60℃保持1min,以25℃/min升温到90℃,保持2min,以25℃/min升温到180℃,再以5℃/min升温到300℃,保持5min。
[0160]
(6)质谱条件
[0161]
离子源:电子轰击源(electron impact ion source,ei);电离能量:70ev;进样口温度:280℃;离子源温度:300℃;传输线温度:300℃;溶剂延迟:10min;发射电流:100μa;ms电离方式:ei;碰撞气压力:1.2mtorr(ar);定时选择反应检测(timed selective reaction monitoring,timed-srm)模式。
[0162]
(7)主要仪器与试剂
[0163]
7.1 tsq8000evo气相色谱-三重四极杆串联质谱仪、tr-pesticide毛细管柱(30m
×
0.25mm,0.25μm)(美国赛默飞世尔科技公司);
[0164]
7.2 700e均质器(美国tomtec公司);
[0165]
7.3 bt223s分析天平[精确到0.01g(北京sartorius公司)];
[0166]
7.4 3-16p高速离心机(德国sigma公司);
[0167]
7.5 et3301全自动氮吹浓缩仪(可控温上海欧陆公司);
[0168]
7.6 promax2020水平往复式振荡器(德国heidolph公司)
[0169]
7.7 multi reax涡旋振荡器(德国heidolph公司)。
[0170]
7.8 joyoung(九阳)jys-m01型磨粉机:九阳股份有限公司
[0171]
7.9苯醚菌酯标准溶液(质量浓度1000mg/l,天津阿尔塔科技有限公司);
[0172]
7.10乙酸乙酯、乙腈(色谱纯,美国赛默飞世尔科技有限公司);
[0173]
7.11 quechers提取粉包[shimsen quechers extraction salts packets only,4gmgso4,1gnacl,0.5g dhs(柠檬酸氢二纳),1g tscd(柠檬酸钠)](广州凯恩化工科技有限公司)。
[0174]
7.12 0.22μm尼龙滤膜(天津市津腾实验设备有限公司)。
[0175]
(8)标准工作曲线
[0176]
精确吸取一定量的混合标准溶液,逐级用含空白基质的乙酸乙酯稀释成质量浓度为5.0μg/l、10.0μg/l、20.0μg/l、40.0μg/l和100.0μg/l的标准工作溶液,供气相色谱-三重四级杆质谱联用仪测定。以农药定量离子对峰面积为纵坐标,农药标准溶液质量浓度为横坐标,绘制标准曲线,结果表明,苯醚菌酯的线性良好(r2≥0.99)。
[0177]
(9)定性及定量
[0178]
9.1定性
[0179]
样品的gc-ms/ms数据符合下列要求时,可判定为目标物残留。在相同试验条件下,样品中待测物质与标准品具有相同的保留时间,偏差在
±
2.5%以内,监测离子的信噪比应≥3。
[0180]
对同一化合物,样品中目标化合物的定性离子和定量离子的相对丰度比与质量浓度相当的基质标准溶液相比,其允许偏差不超过下表规定的范围,则可判断样品中存在目标农药。
[0181]
表1相对离子丰度的最大允许偏差
[0182][0183][0184]
9.2定量
[0185]
对标准工作溶液和样液等体积进样测定,待测样液中目标物的响应值应在标准曲线线性范围内,超过线性范围则应稀释后再进样分析。标准工作液和样液中被测组分的响应值均应在仪器线性响应范围内。
[0186]
以最少添加浓度来确定定量限,加标量在0.01mg/kg水平下,苯醚菌酯在三种基质中的回收率范围在93.1%-101.6%,平均相对标准偏差(rsd)在1.1%-4.0%,见表2、4、6,符合gb/t 27404-2008《实验室质量控制规范食品理化检测》要求。
[0187]
9.3结果计算
[0188]
计算公式及表述,测量样品和相当标准品的特征单离子信号响应峰面积,其含量用下式计算:
[0189][0190]
式中:
[0191]
x——试样中目标化合物残留含量,μg/kg;
[0192]
a——样液中目标化合物色谱峰面积;
[0193]as
——标准工作溶液中目标化合物色谱峰面积;
[0194]
c——标准工作溶液中目标化合物浓度,μg/l;
[0195]
v——最终样液的定容体积,ml;
[0196]
m——最终样液所代表试样量,g。
[0197]
计算结果应表示到小数点后两位,计算结果需扣除空白值。
[0198]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1