一种测定烟梗中木质素含量的方法与流程
1.本发明涉及木质素检测技术领域,特别是涉及一种测定烟梗中木质素含量的方法。
背景技术:
2.烟草属茄科(solanaceas)烟草属(nicotiana),是一年生草本植物。烟梗即烟叶中粗硬的叶脉,约占整个烟叶重量的25%左右,作为烟叶的一部分,主要起支撑叶片的作用,目前将烟梗加工成梗丝并添加到卷烟中是烟梗利用的主要途径之一。烟草属于双子叶植物,烟草中的木质素是愈创木基木质素和紫丁香基木质素的混合体。木质素是烟草中主要的细胞壁物质之一,会造成梗丝木质气重,且燃烧时产生灼喉。木质素是烟梗中主要的芳香族组分,因而也可能是焦油中稠环芳烃类、芳香胺等有害物质的主要来源,木质素热解的产物中含有儿茶酚和烷基儿茶酚成分,不仅会引起涩口,而且有促癌活性,对梗丝品质带来不良的影响。
3.木质素含量的分析需要对木质素进行提取,目前最常用的方法包括二氧六环等有机溶剂溶解提取的方法,但烟梗基质复杂,纤维素、蛋白质、果胶等物质与木质素相互结合,包裹着木质素等,造成这些提取方法难以将木质素较完全的溶解提取出来,并且其他干扰物质还会溶解到提取溶液中,造成测定误差较大。因此,需要建立一种更准确的烟梗中木质素含量分析方法,用此方法可以对不同来源的烟梗原料品质进行评价,从而为烟梗加工过程中提高梗丝及卷烟感官品质提供参考依据。
技术实现要素:
4.鉴于以上所述现有技术的不足,本发明的目的在于提供一种更有效的去除烟草复杂基质中干扰物,能更准确的测定烟梗等制品中木质素含量的方法。
5.为实现上述目的及其他相关目的,本发明提供一种测定烟梗中木质素含量的方法,包括如下步骤:
6.s1、烟梗样品经过前处理得到烟梗滤渣,所述前处理包括依次除去烟梗样品中的脂溶性物质和色素;可溶性糖和酚类物质;淀粉大分子物质;纤维素、果胶和蛋白质;
7.s2、向s1步骤中的烟梗滤渣中加入naoh/尿素溶液溶解后分离获得滤渣;
8.s3、向s2步骤中得到的滤渣中加入硫酸溶液溶解后分层获得上层清液和下层滤渣;
9.s4、采用分光光度法测定上层清液中酸溶木质素的含量;
10.s5、将下层滤渣洗涤呈中性后烘干,再加入naoh/尿素溶液溶解后分离获得待测量滤渣,然后将待测量滤渣干燥称量获得酸不溶木质素的含量。
11.本发明的有益技术效果是:发明了一种经过前处理后再用naoh/尿素溶液进行低温溶解来测定木质素含量的方法,有效的去除了烟梗中的其他杂质,更有利于烟梗中木质素的分离提取和含量测定。用该方法测得的烟梗中木质素的平均含量为7.92%,且相对标
准偏差(rsd)为11.06%,利用该方法从烟梗中提取获得的木质素,结构比较疏松,有利于木质素的进一步分析利用。该方法重复性好,准确性高,适用于烟梗中纤维素测定,可以为梗丝及卷烟品质的提升提供参考。
附图说明
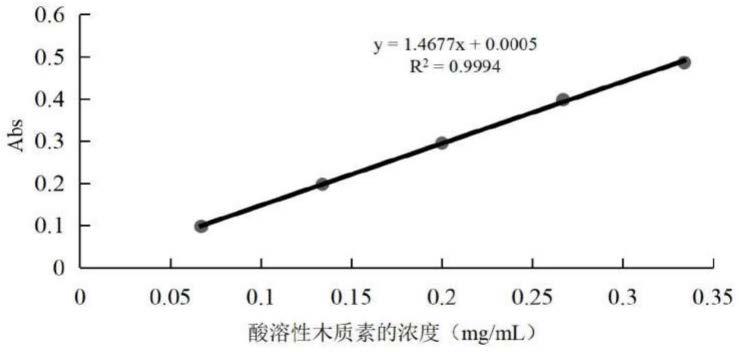
12.图1为酸溶性木质素浓度-吸光度标准曲线。
具体实施方式
13.本发明的先对烟梗进行前处理后再用naoh/尿素溶液进行低温溶解来测定木质素含量的方法,更有效的去除烟草复杂基质中干扰物,能更准确的测定烟梗等制品中木质素含量的方法。采用分光光度法测量酸溶木质素的含量,通过称重法测量酸不溶木质素的含量,且采用本工艺方法制备的木质素结构较疏松,有利于木质素的进一步分析利用。在此基础上,完成了本发明。
14.本发明采用的技术方案提供一种测定烟梗中木质素含量的方法,包括如下步骤:
15.s1、烟梗样品经过前处理得到烟梗滤渣,所述前处理包括依次除去烟梗样品中的脂溶性物质和色素;可溶性糖和酚类物质;淀粉大分子物质;纤维素、果胶和蛋白质;
16.s1步骤具体依次包括如下步骤:
17.在一具体实施例中,第一步中前处理的具体方式包括如下:
18.a)去除烟梗样品中的脂溶性物质和色素:将烟梗样品粉碎得到烟梗粉末,为了使粉末粉碎更充分,粒径小且均匀,先将烟梗样品冷冻干燥后再进行粉碎,烟梗粉末的粒径为30目~120目,优选30目~60目。得到烟梗粉末后,采用有机溶剂去除烟梗样品中的脂溶性物质和色素,有机溶剂常用脂类溶剂,优选乙酸乙酯。具体的去除方法为采用有机溶剂反复洗涤去除烟梗粉末中的脂溶性物质和色素得到第一滤渣。所用的有机溶剂(ml)与烟梗样品(g)比例为1:10~30,此比例为通过多次实验验证,既能达到良好的效果,又不造成有机溶剂的过度使用。反复洗涤的过程,配合超声、离心等处理方式去除脂溶性物质和色素。使用的有机溶剂优选为乙酸乙酯,经过多次超声、离心洗涤操作,得到沉淀即为去除脂溶性物质的烟梗样品。烟梗样品g:乙酸乙酯ml为1:10~30,优选烟梗样品g:乙酸乙酯ml为1:15~25。
19.b)去除烟梗样品中的可溶性糖和酚类物质:对上述a)中得到的第一滤渣继续采用醇溶液去除烟梗样品中的可溶性糖和酚类物质,具体方法为采用醇溶液反复洗涤滤渣以去除烟梗样品中的可溶性糖和酚类物质,洗涤方法具体洗涤方法为超声30min(2遍),离心(4000r/min,5min),得到滤渣。烟梗样品g:醇溶液ml为1:10~50,醇溶液一般采用乙醇溶液(乙醇的质量分数为30%-100%,优选为75%-95%),醇溶液处理烟梗样品完成后得到滤渣,滤渣采用水反复洗涤,采用dns试剂(二硝基水杨酸)监测洗涤水,从而判断滤渣中可溶性糖的去除程度。操作方法为,滤渣用冷水反复洗涤,向洗涤水中加入dns试剂,沸水浴共热5min后,根据是否显色判断滤渣中可溶性糖是否去除干净。当监测不到可溶性糖时,即完成本步处理。优选为85%乙醇,超声30min(2遍),离心(4000r/min,5min),得到滤渣,滤渣采用水反复洗涤得到去除可溶性糖和酚类物质的第二滤渣。
20.c)去除烟梗样品中的淀粉大分子物质:对上述b)中得到的第二滤渣采用α-淀粉酶和/或糖化酶去除烟梗样品中的淀粉大分子物质,具体为向已经去除脂溶性物质和色素、可
溶性糖和酚类物质的烟梗滤渣中,加入磷酸二氢钠-磷酸氢二钠缓冲液及α-淀粉酶,进行水解;完成s12步骤的水解后,加入醋酸-醋酸钠缓冲溶液及糖化酶,再进行水解得到滤渣,经后处理得到去除淀粉的烟梗样品。其中,磷酸二氢钠-磷酸氢二钠缓冲液的ph=5~6.5,优选为ph=5.5~6。α-淀粉酶的用量为1000u/g~3000u/g,优选为1500u/g~2000u/g。α-淀粉酶的水解条件为50℃~70℃水浴水解0.5h~5h,优选为55℃~60℃水浴水解2h~3h。醋酸-醋酸钠缓冲溶液的ph=3.5~5.5,优选为ph=4~4.5。糖化酶的用量为5000u/g~20000u/g,优选为8000u/g~12000u/g。糖化酶的水解条件为50~70℃水浴水解0.5h~5h,优选为55℃~60℃水浴水解1h~2h。水解后,离心(4000r/min,5min),再采用水反复洗涤水解得到滤渣,得到去除淀粉大分子物质的第三滤渣。
21.d)去除烟梗样品中的纤维素、果胶和蛋白质:对上述c)中得到的第三滤渣采用纤维素酶、果胶酶和蛋白酶去除纤维素、果胶和蛋白质,向已经去除脂溶性物质和色素、可溶性糖和酚类物质、淀粉大分子物质的烟梗滤渣中,加入柠檬酸-柠檬酸三钠缓冲液,分别加入纤维素酶、果胶酶、蛋白酶进行酶解,后处理得到去除纤维素、果胶和蛋白质的烟梗滤渣。其中,柠檬酸-柠檬酸三钠缓冲液的ph=3.5~5,优选为ph=4~4.7。纤维素酶用量为100u/g~300u/g,优选为150u/g~300u/g。果胶酶的用量为1000u/g~8000u/g,优选为4000u/g~6000u/g。蛋白酶的用量为1000u/g~8000u/g,优选为4000u/g~6000u/g。酶解的条件为在35~55℃振荡培养箱(90~120rpm)中酶解5h~15h。最后将将酶解液离心(4000r/min,5min),滤渣用冷水反复洗涤得到烟梗滤渣。
22.s2、向s1步骤中的烟梗滤渣中加入naoh/尿素溶液溶解处理,再去除naoh/尿素得到滤渣;溶剂处理的方法一般为搅拌、振荡或超声等;去除naoh/尿素的方法一般为,将上述溶液离心分离,用纯水洗涤至上清液为中性,下层得到即为所述滤渣。向滤渣中加入一定体积的naoh/尿素溶液,在一定温度下搅拌一定时长,然后离心分离,用纯水洗涤至上清液为中性,得到下层的滤渣。其中烟梗样品质量g:加入naoh/尿素溶液体积ml为1:15~50,优选为加入naoh/尿素溶液体积ml为1:20~30,加入naoh/尿素溶液的体积可为20ml,22ml,24ml,25ml,26ml,28ml,30ml。加入naoh/尿素溶液中naoh的质量分数为5%~10%,优选为7%~9%;所述尿素的质量分数为6%~20%,优选为10%~15%,更优选为naoh的质量分数为8%,所述尿素的质量分数为12%。溶解处理为在-12℃~-8℃下搅拌25min-35min,所述搅拌时所需温度可为-12℃,-11℃,-10℃,-9℃,-8℃,所述搅拌时长可为25min,27min,29min,30min,31min,33min,35min。采用naoh/尿素溶解纤维素半纤维素等物质使组织变得更疏松状态。
23.s3、向s2步骤中得到的滤渣中加入硫酸溶液溶解处理,再经处理后得到上层清液和下层滤渣。硫酸溶液中硫酸的质量分数为15%~20%,优选为16%~18%。烟梗样品质量g:加入硫酸溶液体积ml为1:10~30,优选为1:18~22。加入硫酸溶液后反应的条件为:在90~110℃下搅拌15min-45min。优选的,在99~101℃下搅拌25min-35min。
24.s4、采用分光光度法测定上层清液中酸溶木质素的含量,通过测定上层清液的酸溶木质素最大吸收峰对应的吸光度(一般为325nm处),代入酸溶木质素浓度-吸光度标准曲线中得到酸溶木质素含量,具体为,取上层清液1ml稀释3倍,测定其在325nm处的吸光度,通过酸溶木质素标准曲线得到酸溶木质素的浓度,酸溶木质素的含量酸溶木质素浓度-吸光度标准曲线的制备方法为:
25.称取0.5g玉米芯木质素标准品,加入20ml质量分数为17.5%的硫酸溶液,在100℃下搅拌溶解反应30min后,用17.5%的稀硫酸溶液稀释成一系列不同浓度的溶液,浓度范围为0.06-0.34mg/ml测定其在325nm处的吸光度,根据木质素浓度和吸光度的关系拟合出酸溶木质素的标准曲线。
26.s5、处理s3步骤中的下层滤渣至呈中性,在用丙酮洗涤多次,将滤渣烘干后再次加入naoh/尿素溶液进行溶解处理,再去除naoh/尿素得到待测量滤渣,干燥称量得到酸不溶木质素含量。采用丙酮洗涤出去酸处理后的一些小分子有机物,另外可以使滤渣更快干燥。具体为,处理下层滤渣至呈中性,在用丙酮洗涤多次后放在一定温度的烘箱中干燥一段时间。再加入一定体积naoh/尿素溶液,在一定温度下搅拌一段时间,然后离心分离,用纯水洗涤至上清液为中性,将滤渣进行冷冻干燥,称量后,通过计算可得到酸不溶木质素含量。其中烟梗样品质量g:加入naoh/尿素溶液体积ml为1:15~50,加入naoh/尿素溶液中naoh的质量分数为5%~10%,优选为7%~9%;所述尿素的质量分数为6%~20%,优选为10%~15%,更优选为naoh的质量分数为8%,所述尿素的质量分数为12%。溶解处理为在-12℃~-8℃下搅拌25min-35min。烘干在烘箱干燥,干燥所需温度为49℃-51℃。所述用烘箱干燥时长可为15min-45min,优选为15min-25min。
27.以下结合实施例进一步说明本发明的有益效果。
28.为了使本发明的发明目的、技术方案和有益技术效果更加清晰,以下结合实施例进一步详细描述本发明。但是,应当理解的是,本发明的实施例仅仅是为了解释本发明,并非为了限制本发明,且本发明的实施例并不局限于说明书中给出的实施例。实施例中未注明具体实验条件或操作条件的按常规条件制作,或按材料供应商推荐的条件制作。
29.此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
30.在下述实施例中,所使用到的试剂、材料以及仪器如没有特殊的说明,均可商购获得。
31.实施例1
32.(1)去除脂溶性物质和色素
33.烟梗经冷冻干燥除去水分,经高速粉碎机打碎呈粉末状,过60目筛;称取1.005g的粉状样品,加入25ml乙酸乙酯超声30min,离心(4000r/min,5min),所得沉淀物再利用上述方法第二次超声处理,沉淀物即为去除脂溶性物质的烟梗滤渣。
34.(2)乙醇超声提取去除可溶性糖和酚类物质
35.向上述沉淀中加入25ml 85%乙醇超声30min(2遍),离心(4000r/min,5min),滤渣用冷水反复洗涤,向上清液中加入dns试剂,沸水浴共热5min后,根据是否显色判断滤渣中可溶性糖是否去除干净。
36.(3)α-淀粉酶、糖化酶酶解去除淀粉大分子物质
37.向上述滤渣中加入40ml,ph=6磷酸二氢钠-磷酸氢二钠缓冲液及2000u/g的α-淀粉酶,60℃恒温水浴水解2.5h。之后加入40ml,ph=4.5的醋酸-醋酸钠缓冲溶液及10000u/g的糖化酶,60℃恒温水浴水解1.5h,离心(4000r/min,5min),滤渣用冷水反复洗涤。
38.(4)纤维素酶、果胶酶、蛋白酶酶解去除纤维素、果胶、蛋白质等大分子物质
39.向上述滤渣中加入40ml的ph=4.7的柠檬酸-柠檬酸三钠缓冲液,分别加入纤维素酶、果胶酶、蛋白酶(用量分别为150u/g、5000u/g、5000u/g),摇匀后置于恒温振荡培养箱中45℃(90rpm)酶解10h。酶解后,将酶解液离心(4000r/min,5min),滤渣用冷水反复洗涤。
40.(5)向步骤(4)所述滤渣中加入26mlnaoh/尿素溶液,其中氢氧化钠的质量分数是8%,尿素的质量分数是12%;在-9℃下搅拌27min,然后离心分离,用纯水洗涤至上清液为中性,得到下层滤渣。
41.(6)向步骤(5)所述滤渣中加入19ml,质量分数为17.5%的硫酸溶液,在101℃下搅拌反应35min,离心分离,得到上层清液和下层滤渣,保留上层清液,用来测定滤液中酸溶木质素的含量;
42.(7)用纯水洗涤(6)中下层滤渣至中性,再用丙酮洗涤三次,然后放在55℃的烘箱中干燥21min。再加入23ml naoh/尿素溶液,该溶液中氢氧化钠的质量分数是8%,尿素的质量分数是12%,在-12℃下搅拌31min,然后离心分离,用纯水洗涤至上清液为中性,将滤渣进行冷冻干燥,称量后,通过计算可得到酸不溶木质素含量;
43.(8)取上层清液1ml稀释3倍,测定其在325nm处的吸光度,通过酸溶木质素标准曲线得到酸溶木质素的浓度(标准曲线如图1所示),计算得到酸溶木质素的含量为0.95%,酸不溶木质素的含量为7.38%,总木质素含量为8.33%。
44.实施例2
45.(1)去除脂溶性物质和色素
46.烟梗经冷冻干燥除去水分,经高速粉碎机打碎呈粉末状,过60目筛;称取1.004g的粉状样品,加入25ml乙酸乙酯超声30min,离心(4000r/min,5min);所得沉淀物再利用上述方法第二次超声处理;
47.(2)乙醇超声提取去除可溶性糖和酚类物质
48.向上述沉淀中加入25ml 85%乙醇超声30min(2遍),离心(4000r/min,5min),滤渣用冷水反复洗涤,向上清液中加入dns试剂,沸水浴共热5min后,根据是否显色判断滤渣中可溶性糖是否去除干净;
49.(3)α-淀粉酶、糖化酶酶解去除淀粉大分子物质
50.向上述滤渣中加入40ml,ph=6磷酸二氢钠-磷酸氢二钠缓冲液及2000u/g的α-淀粉酶,60℃恒温水浴水解2.5h;之后加入40ml,ph=4.5的醋酸-醋酸钠缓冲溶液及10000u/g的糖化酶,60℃恒温水浴水解1.5h,离心(4000r/min,5min),滤渣用冷水反复洗涤;
51.(4)纤维素酶、果胶酶、蛋白酶酶解去除纤维素、果胶、蛋白质等大分子物质
52.向上述滤渣中加入40ml的ph=4.7的柠檬酸-柠檬酸三钠缓冲液,分别加入纤维素酶、果胶酶、蛋白酶(用量分别为150u/g、5000u/g、5000u/g),摇匀后置于恒温振荡培养箱中45℃(90rpm)酶解10h;酶解后,将酶解液离心(4000r/min,5min),滤渣用冷水反复洗涤;
53.(5)向步骤(4)所述滤渣中加入25mlnaoh/尿素溶液,其中氢氧化钠的质量分数是
8%,尿素的质量分数是12%;在-10℃下搅拌30min,然后离心分离,用纯水洗涤至上清液为中性,得到下层滤渣;
54.(6)向步骤(5)所述滤渣中加入20ml,质量分数为17.5%的硫酸溶液,在100℃下搅拌反应30min,离心分离,得到上层清液和下层滤渣,保留上层清液,用来测定滤液中酸溶木质素的含量;
55.(7)用纯水洗涤下层滤渣至中性,再用丙酮洗涤三次,然后放在50℃的烘箱中干燥20min。再加入25ml naoh/尿素溶液,该溶液中氢氧化钠的质量分数是8%,尿素的质量分数是12%,在-10℃下搅拌30min,然后离心分离,用纯水洗涤至上清液为中性,将滤渣进行冷冻干燥,称量后,通过计算可得到酸不溶木质素含量;
56.(8)取上层清液1ml稀释3倍,测定其在325nm处的吸光度,通过酸溶木质素标准曲线得到酸溶木质素的浓度,计算得到酸溶木质素的含量为1.16%,酸不溶木质素的含量为8.15%,总木质素含量为9.31%。
57.实施例3
58.(1)去除脂溶性物质和色素
59.烟梗经冷冻干燥除去水分,经高速粉碎机打碎呈粉末状,过60目筛;称取1.004g的粉状样品,加入25ml乙酸乙酯超声30min,离心(4000r/min,5min);所得沉淀物再利用上述方法第二次超声处理;
60.(2)乙醇超声提取去除可溶性糖和酚类物质
61.向上述沉淀中加入25ml 85%乙醇超声30min(2遍),离心(4000r/min,5min),滤渣用冷水反复洗涤,向上清液中加入dns试剂,沸水浴共热5min后,根据是否显色判断滤渣中可溶性糖是否去除干净;
62.(3)α-淀粉酶、糖化酶酶解去除淀粉大分子物质
63.向上述滤渣中加入40ml,ph=6磷酸二氢钠-磷酸氢二钠缓冲液及2000u/g的α-淀粉酶,60℃恒温水浴水解2.5h;之后加入40ml,ph=4.5的醋酸-醋酸钠缓冲溶液及10000u/g的糖化酶,60℃恒温水浴水解1.5h,离心(4000r/min,5min),滤渣用冷水反复洗涤;
64.(4)纤维素酶、果胶酶、蛋白酶酶解去除纤维素、果胶、蛋白质等大分子物质
65.向上述滤渣中加入40ml的ph=4.7的柠檬酸-柠檬酸三钠缓冲液,分别加入纤维素酶、果胶酶、蛋白酶(用量分别为150u/g、5000u/g、5000u/g),摇匀后置于恒温振荡培养箱中45℃(90rpm)酶解10h;酶解后,将酶解液离心(4000r/min,5min),滤渣用冷水反复洗涤;
66.(5)向步骤(4)所述滤渣中加入20ml naoh/尿素溶液,其中氢氧化钠的质量分数是8%,尿素的质量分数是12%;在-8℃下搅拌25min,然后离心分离,用纯水洗涤至上清液为中性,得到下层滤渣;
67.(6)向步骤(5)所述滤渣中加入18ml,质量分数为17.5%的硫酸溶液,在97℃下搅拌反应25min,离心分离,得到上层清液和下层滤渣,保留上层清液,用来测定滤液中酸溶木质素的含量;
68.(7)用纯水洗涤下层滤渣至中性,再用丙酮洗涤三次,然后放在47℃的烘箱中干燥15min。再加入20ml naoh/尿素溶液,该溶液中氢氧化钠的质量分数是8%,尿素的质量分数是12%,在-8℃下搅拌25min,然后离心分离,用纯水洗涤至上清液为中性,将滤渣进行冷冻干燥,称量后,通过计算可得到酸不溶木质素含量;
69.(8)取上层清液1ml稀释3倍,测定其在325nm处的吸光度,通过酸溶木质素标准曲线得到酸溶木质素的浓度,计算得到酸溶木质素的含量为1.16%,酸不溶木质素的含量为5.28%,总木质素含量为6.44%。
70.实施例4
71.(1)去除脂溶性物质和色素
72.烟梗经冷冻干燥除去水分,经高速粉碎机打碎呈粉末状,过60目筛;称取1.001g的粉状样品,加入25ml乙酸乙酯超声30min,离心(4000r/min,5min);所得沉淀物再利用上述方法第二次超声处理;
73.(2)乙醇超声提取去除可溶性糖和酚类物质
74.向上述沉淀中加入25ml 85%乙醇超声30min(2遍),离心(4000r/min,5min),滤渣用冷水反复洗涤,向上清液中加入dns试剂,沸水浴共热5min后,根据是否显色判断滤渣中可溶性糖是否去除干净;
75.(3)α-淀粉酶、糖化酶酶解去除淀粉大分子物质
76.向上述滤渣中加入40ml,ph=6磷酸二氢钠-磷酸氢二钠缓冲液及2000u/g的α-淀粉酶,60℃恒温水浴水解2.5h;之后加入40ml,ph=4.5的醋酸-醋酸钠缓冲溶液及10000u/g的糖化酶,60℃恒温水浴水解1.5h,离心(4000r/min,5min),滤渣用冷水反复洗涤;
77.(4)纤维素酶、果胶酶、蛋白酶酶解去除纤维素、果胶、蛋白质等大分子物质
78.向上述滤渣中加入40ml的ph=4.7的柠檬酸-柠檬酸三钠缓冲液,分别加入纤维素酶、果胶酶、蛋白酶(用量分别为150u/g、5000u/g、5000u/g),摇匀后置于恒温振荡培养箱中45℃(90rpm)酶解10h;酶解后,将酶解液离心(4000r/min,5min),滤渣用冷水反复洗涤;
79.(5)向步骤(4)所述滤渣中加入22mlnaoh/尿素溶液,其中氢氧化钠的质量分数是8%,尿素的质量分数是12%;在-11℃下搅拌31min,然后离心分离,用纯水洗涤至上清液为中性,得到下层滤渣;
80.(6)向步骤(5)所述滤渣中加入20ml,质量分数为17.5%的硫酸溶液,在95℃下搅拌反应29min,离心分离,得到上层清液和下层滤渣,保留上层清液,用来测定滤液中酸溶木质素的含量;
81.(7)用纯水洗涤下层滤渣至中性,再用丙酮洗涤三次,然后放在45℃的烘箱中干燥23min。再加入22ml naoh/尿素溶液,该溶液中氢氧化钠的质量分数是8%,尿素的质量分数是12%,在-9℃下搅拌29min,然后离心分离,用纯水洗涤至上清液为中性,将滤渣进行冷冻干燥,称量后,通过计算可得到酸不溶木质素含量;
82.(8)取上层清液1ml稀释3倍,测定其在325nm处的吸光度,通过酸溶木质素标准曲线得到酸溶木质素的浓度,计算得到酸溶木质素的含量为1.13%,酸不溶木质素的含量为6.32%,总木质素含量为7.45%。
83.实施例5
84.(1)去除脂溶性物质和色素
85.烟梗经冷冻干燥除去水分,经高速粉碎机打碎呈粉末状,过60目筛;称取1.006g粉状样品,加入25ml乙酸乙酯超声30min,离心(4000r/min,5min);所得沉淀物再利用上述方法第二次超声处理;
86.(2)乙醇超声提取去除可溶性糖和酚类物质
87.向上述沉淀中加入25ml 85%乙醇超声30min(2遍),离心(4000r/min,5min),滤渣用冷水反复洗涤,向上清液中加入dns试剂,沸水浴共热5min后,根据是否显色判断滤渣中可溶性糖是否去除干净;
88.(3)α-淀粉酶、糖化酶酶解去除淀粉大分子物质
89.向上述滤渣中加入40ml,ph=6磷酸二氢钠-磷酸氢二钠缓冲液及2000u/g的α-淀粉酶,60℃恒温水浴水解2.5h;之后加入40ml,ph=4.5的醋酸-醋酸钠缓冲溶液及10000u/g的糖化酶,60℃恒温水浴水解1.5h,离心(4000r/min,5min),滤渣用冷水反复洗涤;
90.(4)纤维素酶、果胶酶、蛋白酶酶解去除纤维素、果胶、蛋白质等大分子物质
91.向上述滤渣中加入40ml的ph=4.7的柠檬酸-柠檬酸三钠缓冲液,分别加入纤维素酶、果胶酶、蛋白酶(用量分别为150u/g、5000u/g、5000u/g),摇匀后置于恒温振荡培养箱中45℃(90rpm)酶解10h;酶解后,将酶解液离心(4000r/min,5min),滤渣用冷水反复洗涤;
92.(5)向步骤(4)所述滤渣中加入22mlh/尿素溶液,其中氢氧化钠的质量分数是8%,尿素的质量分数是12%;在-12℃下搅拌35min,然后离心分离,用纯水洗涤至上清液为中性,得到下层滤渣;
93.(6)向步骤(5)所述滤渣中加入22ml,质量分数为17.5%的硫酸溶液,在103℃下搅拌反应27min,离心分离,得到上层清液和下层滤渣,保留上层清液,用来测定滤液中酸溶木质素的含量;
94.(7)用纯水洗涤下层滤渣至中性,再用丙酮洗涤三次,然后放在49℃的烘箱中干燥25min。再加入28ml naoh/尿素溶液,该溶液中氢氧化钠的质量分数是8%,尿素的质量分数是12%,在-11℃下搅拌33min,然后离心分离,用纯水洗涤至上清液为中性,将滤渣进行冷冻干燥,称量后,通过计算可得到酸不溶木质素含量;
95.(8)取上层清液1ml稀释3倍,测定其在325nm处的吸光度,通过酸溶木质素标准曲线得到酸溶木质素的浓度,计算得到酸溶木质素的含量为1.18%,酸不溶木质素的含量为7.01%,总木质素含量为8.19%。
96.上述实施例仅例示性说明本技术的原理及其功效,而非用于限制本技术。任何熟悉此技术的人士皆可在不违背本技术的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本技术所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本技术的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1