基于竞争性免疫分析的定量检测试剂盒及方法与流程
1.本发明属于体外诊断与免疫检测技术领域,特别涉及一种基于竞争性免疫分析的定量检测试剂盒及方法。
背景技术:
2.雌二醇(estradiol,e2)是一种分子量为 272da的类固醇激素,它是最具生物活性的雌激素。下丘脑-垂体-性腺轴负责调控 e2 的分泌,e2 在排卵的控制机制中起主导作用。e2 是非妊娠女性体内的一种重要且主要的生物活性雌激素,它主要由发育中的卵泡或黄体中产生,并且在促卵泡激素和黄体生成素的共同作用下,由卵泡细胞和颗粒细胞合成。睾丸和肾上腺皮质也可产生少量 e2,妊娠期妇女主要由胎盘产生 e2。循环中的 e2 主要与蛋白质相结合,只有 1-3% 的 e2 处于游离状态。血清中的雌二醇在男性和女性的各种临床疾病中均起着重要的诊断标志物的作用。定量检测血清雌二醇水平,在临床上用于阐明下丘脑-垂体-性腺轴,男性乳房发育症、产生雌激素的卵巢和睾丸肿瘤以及肾上腺皮质增生的生育障碍。此外,雌激素的检测还用于在体外受精中监测生育治疗和确定排卵时间。
3.在不同人群中,雌二醇水平跨度相当大,青春期前儿童,青少年,绝经前后妇女和孕妇中的雌二醇浓度范围超过几个数量级(40
–
2000 pg/ml)。此外,而对于进行体外受精的女性经卵巢刺激治疗后血清雌二醇水平可升高至10ng/ml左右。目前的免疫检测方法的在低雌二醇水平(<40pg/ml)下缺乏适当的敏感度,而对于超出检测上限的高水平雌二醇的测定常需将标本稀释后再行测定,增加了检验人员的工作量和试剂成本以及出错误的风险。
4.目前临床上多采用免疫分析方法对雌二醇进行定量检测。雌二醇属于小分子半抗原类激素,只含单一抗原表位,需采用竞争性免疫分析模式进行检测。目前主流的用于检测只含单一抗原表位的分析物检测试剂主要分为两种竞争模式,分别是延时竞争法和非延时竞争法。采用延时竞争法可以提升检测的敏感度,但会导致检测时间增加,检测上限下降等,而非延时竞争法可以缩短检测时间,降低自动化难度,但会损失一定的敏感度。
技术实现要素:
5.本发明针对现有的对具有单一抗原表位的化合物定量检测的不足,提供一种基于竞争性免疫分析的定量检测试剂盒及方法,利用该试剂盒检测时,具有优异的敏感度和较宽的检测范围,可满足临床上患者的鉴别诊断和治疗疗效监测两种需求。
6.为实现上述目的,本发明的技术方案是这样实现的,一种基于竞争性免疫分析的定量检测试剂盒,包括载体,所述载体上沿样本流动方向依次设置低浓度检测区和高浓度检测区,其中低浓度检测区包被有相对于靶分析物低亲和力的竞争抗原一,高浓度检测区包被有相对于竞争抗原一高亲和力的竞争抗原二,竞争抗原一和/或竞争抗原二与靶分析物竞争结合标记抗体。
7.在本发明第一个实施方案中,竞争抗原一为靶分析物结构类似物,竞争抗原二与
靶分析物结构一致。
8.在本发明的一个实施方案中,所述标记抗体为被荧光微球标记的抗体。
9.在本发明的一个实施方案中,所述载体为微流控芯片,竞争抗原一和竞争抗体二沿样本流动方向依次包被在微通道内形成低浓度检测区和高浓度检测区。
10.在本发明的一个实施方案中,当载体为微流控芯片时,标记抗体设置在微通道内位于低浓度检测区的前端或设置在加样孔形成标记区。
11.在本发明的一个实施方案中,当载体为微流控芯片时,高浓度检测区与废液收集池之间还设置有质控位区。
12.在本发明的一个实施方案中,所述载体上还设置释放剂,所述释放剂位于标记区之前或者位于标记区内。
13.在本发明的一个实施方案中,所述释放剂为酸性溶液并内包含置换剂。
14.在本发明的一个实施方案中,竞争抗原一和竞争抗原二与载体蛋白偶联后分别包被在低浓度检测区和高浓度检测区。
15.另一方面,本发明还提供了一种利用上述任一一个技术方案中的试剂盒进行定量检测的方法,通过设置临界点,比对校准函数,准确计算两类样本的结果,包括至少以下步骤:1)获取校准函数:通过含有靶分析物的系列浓度标准品溶液分别流经试剂盒获取标准品溶液的信号值,以抑制率为纵坐标、标准品溶液浓度为横坐标,获取校准函数,其中lt区的校准函数为t1,ht区的校准函数为t2;2)将可能包含靶分析物的样品与标记抗体混合后依次流经载体的lt区和ht区,反应结束后利用检测仪器分别获取lt区和ht区的信号值,进而得到lt点的抑制率、ht点的抑制率;3)将lt点的抑制率与临界点进行比较,若大于临界点,则属于低值样本,若小于临界点,则属于高值样本;4)通过比对校准函数确定靶分析物的浓度:若属于低值样本,选择样本在lt区的抑制率与t1比对,获取浓度值;若属于高值样本,选择样本在ht区的抑制率与t2比对,获取浓度值。
16.通过上述技术方案得到的一种基于竞争性免疫分析的定量检测试剂盒及方法,其有益效果是:1、将低亲和力的竞争抗原一和高亲和力的竞争抗原二沿样本流经的方向依次设置,使不同亲和力的抗原发挥不同作用,在确保功能灵敏度的同时,拓宽了检测范围,实现对浓度范围跨度较大的具有单一抗原表位的化合物浓度的准确定量,减少不必要的稀释;2、应用所述的微流控芯片体积小,所消耗的试剂和样本量少,整个反应过程时间短,操作简单,前期芯片的制备简单,免疫微流控芯片技术成熟,容易实施。
附图说明
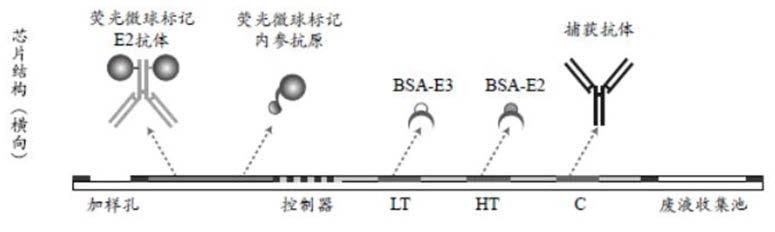
17.图1是根据本发明的一个技术方案提出的检测e2的试剂盒结构。
18.图2是应用图1中试剂盒的检测过程。
19.图3是应用图1中试剂盒的检测结果示意(其中坐标系中的横坐标代表载体的不同
区域,纵坐标b/b0代表抑制率)。
具体实施方式
20.需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
21.除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
22.本文中所述的竞争性免疫分析特指延时竞争法。关于竞争性免疫分析,欲获得优质竞争性校准函数,其需确保抗体限量原则,检测抗体用量需要小于待测抗原和竞争抗原所需抗体的累计用量,但必须大于竞争抗原或待检抗原所需抗体累计用量。竞争抗原,是决定延时竞争免疫分析敏感度的关键因素。待测抗原和竞争抗原与抗体的亲和力差异,可决定待检抗原低区的灵敏度和准确度。若使用与抗体亲和力较弱的竞争抗原参与竞争反应,可以提升检测的敏感度,相反,若使用与抗体亲和力较高的竞争抗原参与竞争反应,可以拓宽检测方法的检测上限。若能将两种不同亲和力的竞争抗原联合使用,使各自发挥其优点,则可以实现对较高的敏感度和较宽的检测范围的兼顾。
23.为此,本发明提出一种基于竞争性免疫分析的定量检测试剂盒,使用两种亲和力不同的竞争抗原,使各自发挥其优点,则可以实现对较高的敏感度和较宽的检测范围的兼顾。
24.下面结合实施例和附图对本发明作进一步的解释说明,可以理解的是,本发明并不限于描述的具体实施方式。
25.在一个实施方案中,基于竞争性免疫分析的定量检测试剂盒包括载体,所述载体上沿样本流动方向依次设置低浓度检测区(lt)和高浓度检测区(ht),其中低浓度检测区包被有相对于靶分析物低亲和力的竞争抗原一,高浓度检测区包被有相对于竞争抗原一高亲和力的竞争抗原二。
26.竞争抗原与靶分析物同时竞争标记抗体形成复合物并在低浓度检测区和/或高浓度检测区产生信号,根据信号值比对校准函数获取样本中靶分析物的浓度信息,标记抗体既可以沿样本流动方向设置在低浓度检测区前端形成标记区,也可以与样本混合后再与竞争抗原反应。
27.所述低亲和力的竞争抗原一是相对于靶分析物而言,高亲和力的竞争抗原二是相对于低亲和力的竞争抗原一而言,即高亲和力的竞争抗原二可以与靶分析物的亲和力相同或相近。
28.校准函数是通过使含有靶分析物系列浓度标准品依次流经低亲和力的竞争抗体一和高亲和力的竞争抗体二测得的剂量反应曲线,以此推算样本中靶分析物的浓度。
29.所述标记抗体可以为被荧光微球标记的抗体,标记抗体与竞争抗体一或竞争抗体二结合形成复合物时在低浓度检测区或高浓度检测区产生可被捕捉的有效信号,当然,也可采用其他信号粒子标记,包括但不限于量子点、胶体金微粒等。
30.所述载体可以选用依靠毛细管力驱动样本流动的微流控芯片或其他移动控制器驱动的样本流动的芯片,还可选用常见的检测试纸条(包括上样区、标记区、检测区、质控区
和废液收集区),在一个实施方案中,所述载体选用微流控芯片,无需外力驱动,将竞争抗原一和竞争抗体二沿样本流动方向依次包被在微通道内,标记抗体可以设置在微通道内位于捕获抗体一的前端,也可以设置在微流控芯片的加样孔内。
31.微流控芯片可以有效克服常规免疫分析时间过长的缺点,并且可以简化分析过程,减少样品和试剂的消耗,非常适合床旁检测或快速检测。
32.具体的,微流控芯片包括微流控基片及压合于微流控基片上的微流控盖片,基片和盖片围合形成微通道,所述微通道一端与盖片上开设的加样孔连通,另一端与废液收集池连通,微流控基片的微通道内沿样本的流动方向依次设有标记区、低浓度检测区(lt)、高浓度检测区(ht)以及质控位区c,标记有荧光微球的标记抗体涂覆在标记区,竞争抗原一包被在低浓度检测区、竞争抗原二包被在高浓度检测区。
33.所述质控位区c按常规设置,例如设置捕获抗体(内参抗体),对应的,在标记区设置被标记的内参抗原,用于确定检测过程是否有效。
34.以检测雌二醇(e2)为例,竞争抗原一和竞争抗原二可以选用雌二醇类似物和/或雌二醇,如图1显示的是应用本发明中的其中一个技术方案检测e2的试剂盒,载体的标记区设置的标记抗体是荧光微球标记的雌二醇单克隆抗体(f-e2 mcab),竞争抗原一为雌三醇(e3),竞争抗原二为与靶分析物一致的e2,e3和e2偶联载体蛋白后分别包被在低浓度检测区和高浓度检测区,c区包被的是能够与内参抗原(bsa-dnp)发生特异性结合的捕获抗体(抗dnp抗体)。
35.所述载体蛋白可以是牛血清白蛋白。
36.标记区同时含有释放剂确保样本中的e2与偶联的蛋白质分离,当然也可以将释放剂与样本混合后再滴加到载体上。释放剂可以是酸性溶液,例如柠檬酸缓冲液,但在检测过程中需要注意酸碱性的调节(选择最适ph值),保证检测过程中各复合反应的顺利发生,释放剂中还可以含有置换剂,例如:达那唑,氢化可的松等。
37.需要注意的是,并不是所有的具有单一抗原表位的化合物都需要释放剂,例如游离态的甲状腺激素(ft3、ft4)。
38.结合样本中可能存在的e2的浓度范围,在应用于检测e2的试剂盒中,所述竞争抗原一和竞争抗原二的包被比例为1:(5~50),优选为1:(10~40),更优选为1:(20-30)。
39.当竞争抗原一为e3,竞争抗原二为e2时,e3的质量浓度为为5~50 ug/ml,优选为10~40ug/ml,更优选为15~30ug/ml;e2的质量浓度为100~500ug/ml,优选为200~400ug/ml,更优选为250~300ug/ml。
40.将待检血清加入加样孔,样本经毛细管作用进入标记区,在释放剂作用下蛋白变性,雌二醇和蛋白分离,并与f-e2 mcab特异性结合,剩余f-e2 mcab以及f-e2 mcab-e2复合物继续沿微通道涌动,依次遇到lt区的bsa-e3和ht区的bsa-e2,形成两种不同的竞争性免疫分析。在lt区待检e2和bsa-e3 竞争限量的f-e2 mcab,在抗体结合能力方面,待检e2显著高于bsa-e3,且优先结合,f-e2 mcab的数量随待检抗原的数量变化波动明显,进而使lt区的信号值波动明显,表现出较高的分析敏感度,非常适合低浓度样本检测;相反,在ht区待检e2和bsa-e2 竞争限量的f-e2 mcab;在抗体结合能力方面,待检e2和bsa-e2类似,利于确保较好检测上限,非常适合高浓度标本检测。通过设置临界点,比对校准函数,准确计算两类标本的结果。
41.另一方面,本发明还提供了一种利用上述任一一个技术方案中的试剂盒进行定量检测的方法,包括至少以下步骤:1)获取校准函数:通过含有靶分析物的系列浓度标准品溶液分别流经试剂盒获取标准品溶液的信号值,以抑制率为纵坐标、标准品溶液浓度为横坐标,获取校准函数,其中lt区的校准函数为t1,ht区的校准函数为t2;2)将可能包含靶分析物的样品与标记抗体混合后依次流经载体的lt区和ht区(若载体上未设置标记区,则样品滴加到载体前需与标记抗体混合),反应结束后利用检测仪器分别获取lt区和ht区的信号值,进而得到lt点的抑制率、ht点的抑制率(检测仪器为常规技术,例如荧光检测仪,与信号抗体携带的信号一致即可);3)将lt点的抑制率与临界点进行比较(临界点是为了保证实验的有效性,一般选取0.3-0.4之间),若大于临界点,则属于低值样本(靶分析物含量低),若小于临界点,则属于高值样本(靶分析物含量高);4)通过比对校准函数确定靶分析物的浓度:若属于低值样本,选择样本在lt区的抑制率与t1比对,获取浓度值;若属于高值样本,选择样本在ht区的抑制率与t2比对,获取浓度值。
42.抑制率的计算属于本领域常规技术手段,在这里不再作进一步的说明。
43.同时,可以理解的是,步骤1可以在制备载体过程根据靶分析物的不同获取并形成标准,即后续利用检测时只需进行2-4步,无需重复进行。
44.上述检测方法能够实现对浓度范围跨度较大的具有单一抗原表位的化合物浓度的准确定量,减少了不必要的稀释,操作简单快捷,提高了检测的准确性。
45.上述技术方案仅体现了本发明技术方案的优选技术方案,本技术领域的技术人员对其中某些部分所可能做出的一些变动均体现了本发明的原理,属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1