与大豆抗疫霉病相关的代谢产物的筛选鉴定方法及应用与流程
文档序号:31637362发布日期:2022-09-24 05:09阅读:706来源:国知局
导航: X技术> 最新专利>测量装置的制造及其应用技术
1.本发明涉及植物病害防治技术领域,具体涉及一种与大豆抗疫霉病相关的代谢产物的筛选鉴定方法及应用。
背景技术:
2.大豆是世界上最重要的经济和油料作物之一。在大豆的生长发育过程中会受到生物胁迫和非生物胁迫等各种因素的影响,因此其产量与品质很难保证,其中由大豆疫霉引起的大豆疫霉根腐病是世界上大多数大豆种植区的主要疾病(tyler,b.m.et al.,2007)。另外在疫霉菌侵染大豆的过程中会分泌对人体或牲畜有害的代谢物,从而导致大豆的品质口感等有所下降甚至无法食用。因此,大豆疫霉根腐病对大豆生产带来了严重威胁,如何抵抗大豆疫霉菌的侵染、保证大豆产量具有十分重要的意义。
3.大豆疫霉菌是一种致病力极强的病原卵菌,在所有发育阶段均会感染大豆植株。受大豆疫霉侵染后的大豆幼苗植株显著症状表现为根茎腐病、立枯病,叶片发黄甚至萎蔫,最终导致大豆幼苗的死亡;遭侵染的大豆成年植株产量会显著降低,甚至会导致部分敏感型的成年植株完全减产。由于大豆疫霉菌有着223种致病类型和复杂的致病变异(schneider,r.et al.,2016),所以大豆疫霉菌很难控制。
4.植物在生长发育的过程中会产生许多结构和功能多种多样的代谢物,这些代谢物对于植物的生长发育、不断变化的环境条件、非生物或生物胁迫的反应中发挥着不同的作用。然而造成这种代谢物多样性情况的原因在很大程度上是由于代谢物进行了化学修饰。越来越多的实验证据表明,代谢物的修饰化是造成植物具有较高适应性的关键组成部分。
5.当植物受病原体侵染时,植物自身会产生大量的代谢物来保护自己免受病原体侵害并维持自身正常生长。一般来说,植物在面对病原体侵染所产生的有毒代谢物时,其自身的解毒系统有两种,一方面是将有毒代谢物进行分隔,液泡隔离、囊泡运输和直接排泄到细胞外;另一方面是将病原体产生的有毒代谢物进行改造转化成无毒形式的代谢物,这也就涉及到代谢物的修饰化。在植物体中,异生代谢物经过糖基、谷胱甘肽、酰基的修饰化即可被转化为无毒的代谢物(bartholomew,d.m.et al.,2002)。例如,植保素作为植物体内存在的一种植物抗毒素,其可以提高植物对真菌的抗性,但是当植保素被糖基化或羟基化后,便会形成无毒的代谢物5-羟基植保素或6-糖基植保素(kliebenstein,d.j.et al.,2004);皂苷是糖基化的类固醇或甾体生物碱,以形成组成性的化学屏障来抵抗多种真菌和细菌病原体对植物的危害,原理是与固醇形成复合物来使细胞溶解,最终便会导致目标生物体的膜完整性丧失,来实现这一作用功能(keukens,e.a.et al.,1995;bilal,o.et al.,2013)。
6.植物体内修饰化的代谢物具有十分重要的作用,不管是植物自发形成的或是经酶催化形成的或者是植物遭真菌及病原体侵染时所产生的,即使没有毒性,也可能对植物体自身存在危害,所以对植物体中修饰化代谢物的检测是必不可少的。但目前在代谢水平上对于大豆与大豆疫霉菌防御反应机制知之甚少,因此,需要去发掘更多的与大豆抗疫霉病相关的代谢物。
技术实现要素:
7.针对上述现有技术,本发明的目的是提供一种与大豆抗疫霉病相关的代谢产物的筛选鉴定方法及应用。本发明通过代谢组学方法从空间和时间两个方向来明确与大豆疫霉病相关的重要代谢产物及代谢物修饰化在大豆抗疫过程中的作用,从而揭示大豆对于大豆疫霉菌疾病应答的生物标记物。
8.为实现上述目的,本发明采用如下技术方案:
9.本发明的第一方面,提供一种与大豆抗疫霉病相关的代谢产物的筛选鉴定方法,包括以下步骤:
10.(1)接入大豆疫霉菌后的大豆代谢物提取;
11.(2)采用uplc-qe-ms对代谢物进行检测与鉴定,获得代谢物数据;
12.(3)对代谢物数据进行分析,确定修饰化基团,匹配修饰化基团的二级离子,根据得分大小筛选具有修饰基团的代谢物。
13.优选的,步骤(1)中,大豆代谢物的提取方法为:以接入大豆疫霉菌后的大豆下胚轴或根部为试验材料,以体积比为2:2:1的甲醇-乙腈-水为提取液,将试验材料与提取液按1g:10ml混合,4℃超声提取5-10min,离心,分离上清液,旋转蒸发浓缩至干,浓缩前每1ml提取液加入100μl甲醇复溶。
14.优选的,步骤(2)中,uplc-qe-ms的检测条件包括:
15.液相条件:
16.色谱柱:c18色谱柱(2.1
×
100,1.9μm);柱温:35℃;流动相a:含有0.1%(体积分数)乙酸的水,流动相b:含有0.1%(体积分数)乙酸的乙腈;洗脱梯度:0-0.5min,a=90%;0.5-7min,a递减至0%;7-8.5min,a=0%;8.5-8.6min,a递增至90%;8.6-10min,a=90%;进样体积:3μl。
17.质谱条件:
18.正离子模式:喷雾电压:3.8kv;鞘气:40;辅助气:10;离子传输管温度:350℃。分辨率:17500;微扫数:1;agc target:2e5;归一化碰撞能量:50。
19.负离子模式:喷雾电压:2.9kv;鞘气:40;辅助气:0;离子传输管温度:350℃。分辨率:17500;微扫数:1;agc target:2e5;归一化碰撞能量:50。
20.本发明在设计液相检测条件时,首先通过水相高的流动相a将样品液中的代谢物吸附到色谱柱上,之后通过高有机相的流动相b将吸附在色谱柱上的样品洗脱,最后再通过流动相a使色谱柱恢复初始状态。另外,为使液相检测条件能够适用于不同种类的样品,本发明对梯度洗脱条件进行了反复的摸索。通过试验发现,采用上述的液相检测条件可以适用于多种样品,能够扫描出更多的质谱峰,使质谱峰的峰形更好。
21.基于本发明的发明构思,通过对质谱条件的优化,使得修饰代谢物中修饰基团和基底代谢物之间的稳定性被打破,同时不破坏修饰基团的结构稳定性,使得修饰基团和修饰代谢物能够扫描产生相同的二级离子。
22.优选的,步骤(3)中,确定的修饰化基团为谷胱甘肽、糖基和/或酰基。
23.优选的,步骤(3)中,将获得的获得代谢物数据导入compound discoverer软件进行分析,根据设定的修饰化基团的化学式与二级离子,利用compound discoverer软件从检测出的所有代谢物中筛选含有修饰基团二级离子的代谢物,根据代谢物中含有设定修饰基
团二级离子的多少进行打分,获得有得分的代谢物集合;
24.将有得分的代谢物集合中各个代谢物的分子量与设定的修饰基团的分子量进行比较,筛选出分子量大于修饰基团分子量的代谢物,组成修饰代谢物集合;
25.将修饰代谢物集合中各个代谢物的化学式及分子量减去修饰基团的化学式及分子量,得到第一目标代谢物集合,即通过加成反应生成其修饰化代谢物的基底代谢物;
26.将修饰代谢物集合中各个代谢物的化学式及分子量减去修饰基团的化学式及分子量,再加上h2o的化学式及分子量,得到第二目标代谢物集合,即通过脱水缩合反应生成其修饰化代谢物的基底代谢物;
27.所述第一目标代谢物集合和第二目标代谢物集合中的化学式作为病原体侵染植物体后产生的代谢物的目标化学式。
28.本发明的第二方面,提供如下(1)-(4)任一项所述的代谢产物作为标志物在抗疫霉病大豆品种选育中的应用;
29.(1)豆异黄酮;
30.(2)异丙基苹果酸;
31.(3)大豆苷元7-o-葡糖苷;
32.(4)金雀异黄素7-o-β-d-葡萄糖苷。
33.本发明的第三方面,提供根皮酚在防治大豆疫霉菌中的应用。上述应用中,利用根皮酚对含有大豆疫霉菌的土壤进行处理,可以提高作物对大豆疫霉菌的抗性。
34.本发明的有益效果:
35.(1)本发明通过代谢组学方法从空间和时间两个方向来明确与大豆疫霉病相关的重要代谢产物及代谢物修饰化在大豆抗疫过程中的作用,从而揭示大豆对于大豆疫霉菌疾病应答的生物标记物。
36.(2)在代谢组学检测方面,本发明利用超高液相色谱-高分辨质谱(uplc-qe-ms)联用技术,将qe的高分辨、高质量准确度与四级杆能力相结合,可在实验中获取更多定性信息,对所取生物样本中的代谢物进行分析,方法准确、简单且高效灵敏。
37.(3)为进一步深入挖掘数据库中比对不上的代谢产物及发现更多与大豆疫霉抗病性相关的代谢物,通过利用修饰基团与修饰代谢物具有相同二级离子的原理,建立了基于代谢组学数据筛选出在抗感疫霉病的大豆品种中具有差异性的修饰化代谢物的方法。通过分析修饰基团与修饰化代谢物在相同离子扫描模式下所产生的二级离子,筛选出含有与修饰基团相同二级离子的修饰化代谢物;然后再根据修饰化代谢物中修饰基团与基底代谢物可能的结合方式,进而分析得出基底代谢物可能的目标化学式和分子量。因此,本发明无需建立标准品二级谱图数据库即可实现对病原体侵染植物体后产生的代谢物进行辅助鉴定。
附图说明
38.图1:大豆茎部疫霉病潜在的关键代谢途径。
39.图2:大豆根部疫霉病潜在的关键代谢途径。
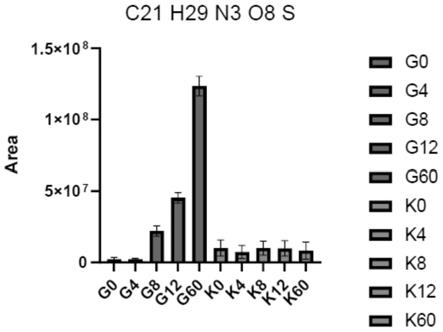
40.图3:大豆疫霉根部侵染受影响的糖基化代谢物;图中,g0、g4、g8、g12、g60分别表示大豆感病品种williams接种大豆疫霉菌0h、4h、8h、12h和60h;k0、k4、k8、k12、k60分别表示大豆抗病品种williams 82接种大豆疫霉菌0h、4h、8h、12h和60h。
41.图4:大豆疫霉茎部侵染受影响的谷胱甘肽化代谢物;图中,g0、g4、g8、g12、g60分别表示大豆感病品种williams接种大豆疫霉菌0h、4h、8h、12h和60h;k0、k4、k8、k12、k60分别表示大豆抗病品种williams 82接种大豆疫霉菌0h、4h、8h、12h和60h。
42.图5:大豆疫霉茎部侵染受影响的糖基化代谢物;图中,g0、g4、g8、g12、g60分别表示大豆感病品种williams接种大豆疫霉菌0h、4h、8h、12h和60h;k0、k4、k8、k12、k60分别表示大豆抗病品种williams 82接种大豆疫霉菌0h、4h、8h、12h和60h。
43.图6:不同处理对大豆生长的影响。
44.图7:谷胱甘肽的二级离子图;圈内为谷胱甘肽和don-gsh共同含有的二级离子。
45.图8:don-gsh二级离子图。
具体实施方式
46.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
47.如前所述,目前在代谢水平上对于大豆与大豆疫霉菌防御反应机制知之甚少,因此,需要去发掘更多的与大豆抗疫霉病相关的代谢物。
48.本发明通过对williams 82、williams大豆品种进行疫霉菌接菌处理,获得不同品种、不同时间段的大豆茎部及根部材料,并分别对不同品种大豆茎部及根部样本进行代谢物提取与测定,比较不同时间段及不同接菌部位生物样本中的代谢物动态变化,找到各接菌时间段及各接菌部位中的差异标志物以及主要代谢途径进行分析;并找出大豆疫霉菌侵入大豆后产生的和抗病相关的修饰化代谢物。
49.病原体侵染植物体后可能会产生小分子毒素类物质,有些抗病植物自身在受病原体侵染时会将毒素类物质经谷胱甘肽、糖基化和酰基化修饰成对植物体无毒的代谢物。但病原体侵染植物体后所产生的小分子毒素类物质未经报道很难对其定性,进而制约了植物抗病性的研究。
50.compound discoverer是thermofisher推出的一款基于orbitrap高分辨率质谱的小分子研究软件。compound discoverer可以基于质谱技术对未知物结构进行解析,目前代谢物鉴定最行之有效的办法是建立标准品谱图数据库,通过谱图对比的方式,可以对代谢物快速准确的鉴定。但是,由于所检索的数据库中存在很少与修饰化相关的代谢物,导致许多含有修饰基团的代谢物不能被真正定性,且通过compound discovere非靶向搜库会花费大量时间,搜索结果并不理想。
51.由于每一种代谢物都有专属于自己的二级质谱图,通过二级质谱图中的子离子信息即可对该代谢物进行定性,有研究介绍糖基化或谷胱甘肽化对于植物与病原体的相互作用方面起着至关重要的作用,但由于网上数据库的局限性,在网上数据库中很难直接匹配到经修饰化的代谢物,尤其是经谷胱甘肽这种大分子修饰基团修饰的代谢物,便建立一种新的方法来对鉴定经修饰化的代谢物。
52.其原理就是由于修饰基团与修饰化代谢物在质谱梯度电离的条件下,会产生相同的二级离子。通过设定修饰基团的二级离子来筛选出经该修饰基团修饰的代谢物。我们根据已有谷胱甘肽与don-gsh(glutathione adduct of don)标准品进行实验验证,谷胱甘肽
与don-gsh的二级质谱图如图7和图8所示,在谷胱甘肽的二级质谱图中有包括84.04498、162.02188、179.04842、215.04802在内的子离子同样存在于don谷胱甘肽的二级质谱图中。
53.因此,我们根据此原理在compound discoverer软件上自定义建立了一种通过确定的修饰基团二级离子,在通过代谢组学检测出的所以代谢物中筛选含有该修饰基团二级离子的代谢物,在compound discoverer软件上会根据代谢物中所含有设定修饰基团二级离子的多少来进行打分,只要是有分数我们都怀疑其代谢物可能就是经设定基团所修饰的。
54.整理完有得分的代谢物我们需要对其进行筛选,找出未经修饰基团修饰过的基础代谢物。由于谷胱甘肽与代谢物结合的方式一般都是加成反应或脱水缩合反应;糖基化与代谢物结合的方式一般都是脱水缩合反应,所以在进行筛选有得分的代谢物时会利用其化学式及分子量减去修饰基团的化学式及分子量,并根据其分子量及化学式找出相应的未经修饰的代谢物,由于compound discoverer自身的数学算法,如果有化学式及分子量都匹配上基础代谢物,我们便认为所找出的基础代谢物即为可以经设定修饰基团修饰成所对应有得分的修饰化代谢物。
55.在本技术的一个实施方案中,给出了与大豆抗疫霉病相关的代谢产物的筛选鉴定方法,包括以下步骤:
56.(1)以体积比为2:2:1的甲醇-乙腈-水为提取液,将待测样品与提取液按1g:10ml混合,4℃超声提取5-10min,离心,分离上清液,旋转蒸发浓缩至干,加入100μl甲醇复溶,进样前通过0.22μm的滤膜过滤后上样。
57.使用高效液相仪与q exactive
tm
组合型四极杆orbitrap质谱仪联用的full ms/dd-ms2扫描模式对样品及空白溶剂(纯甲醇)进行检测,空白溶剂作为对照,目的是消除溶剂中存在的背景峰干扰。
58.液相参数:
59.色谱柱:c18色谱柱(2.1
×
100,1.9μm);柱温:35℃;流动相a:含有0.1%(体积分数)乙酸的水,流动相b:含有0.1%(体积分数)乙酸的乙腈;洗脱梯度:0-0.5min,a=90%;0.5-7min,a递减至0%;7-8.5min,a=0%;8.5-8.6min,a递增至90%;8.6-10min,a=90%;进样体积:3μl。
60.质谱参数:
61.喷雾电压:3.8kv;鞘气:40;辅助气:10;离子传输管温度:350℃。分辨率:17500;微扫数:1;agc target:2e5;归一化碰撞能量:30。
62.(2)检测后的数据直接导入compound discoverer软件进行分析:
63.1)选择谱图进行处理,其中polarity mod参数分正负离子扫描模式进行处理,其他参数保持默认值即可。
64.2)对保留时间峰对齐,将各样本中的相同离子归纳到一起进行分析,允许保留时间最大偏移设定为0.2min,质量精度设为5ppm。
65.3)在主界面(expected compounds)中设定修饰基团的分子式。
66.4)workflow中设定修饰基团的二级离子,在代谢组学检测出的所有代谢物中筛选含有该修饰基团二级离子的代谢物。compound discoverer软件会根据代谢物中所含有设定修饰基团二级离子的多少来进行打分,只要是有分数的代谢物都怀疑其被设定修饰基团
所修饰。
67.在结果界面的class coverage中根据得分大小进行排列,得分越高证明该代谢物含有更多与目标修饰基团相同的子离子。获得有得分的代谢物集合。
68.(3)将有得分的代谢物集合中各个代谢物的分子量与设定的修饰基团的分子量进行比较,筛选出分子量大于修饰基团分子量的代谢物,组成修饰代谢物集合。
69.(4)将修饰代谢物集合中各个代谢物的化学式及分子量减去修饰基团的化学式及分子量,得到第一目标代谢物集合;
70.将修饰代谢物集合中各个代谢物的化学式及分子量减去修饰基团的化学式及分子量,再加上h2o的分子量,得到第二目标代谢物集合;
71.所述第一目标代谢物集合和第二目标代谢物集合中的化学式作为病原体侵染植物体后产生的代谢物的目标化学式。
72.为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
73.本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。未注明详细条件的实验方法是按照常规试验方法或按照供应商所建议的操作说明书进行的。其中:
74.实施例中所使用的大豆材料williams 82、williams,大豆疫霉菌psusar2菌种,公众自申请日起20年内可从申请人处获得,以用于重复本实验。
75.实施例1:与大豆抗疫霉病相关的代谢产物的筛选鉴定
76.1、实验方法:
77.1.1大豆接菌:
78.1.1.1大豆下胚轴接菌:
79.(1)取出苗5天后的williams 82、williams大豆材料,将大豆下胚轴的中部摆在8连管中,并于摆放位置滴加20μl浓度为106/ml大豆疫霉菌psusar2的游动孢子液。
80.(2)根部摆在浸湿的纸巾上,并定期喷壶喷水,覆盖保鲜膜以保湿。
81.(3)接种0、4、8、12、20小时后取材,液氮冷冻后放入﹣80℃冰箱保存,用以大豆疫霉菌代谢组的检测。
82.1.1.2大豆根部接菌:
83.(1)取出苗5天后的williams 82、williams大豆材料,将大豆根部洗净浸泡于浓度为106/ml大豆疫霉菌psusar2的游动孢子液。
84.(2)接种0、4、8、12、20小时后取材,液氮冷冻后放入﹣80℃冰箱保存,用以大豆疫霉菌代谢组的检测。
85.1.2代谢物提取:
86.以体积比为2:2:1的甲醇-乙腈-水为提取液,以大豆疫霉菌侵染后的大豆下胚轴及根部为待测样品。将待测样品与提取液按1g:8ml混合,4℃超声提取10min,13000rpm离心5min,分离上清液,旋转蒸发浓缩至干,加入100μl甲醇复溶,进样前通过0.22μm的滤膜过滤后上样。
87.1.3非靶向代谢组uplc检测使用的液相条件:
88.色谱柱:c18色谱柱(2.1
×
100,1.9μm);柱温:35℃;流动相a:含有0.1%(体积分
数)乙酸的水,流动相b:含有0.1%(体积分数)乙酸的乙腈;洗脱梯度:0-0.5min,a=90%;0.5-7min,a递减至0%;7-8.5min,a=0%;8.5-8.6min,a递增至90%;8.6-10min,a=90%;进样体积:3μl。
89.1.4非靶向代谢组检测使用的质谱条件:
90.正离子模式:喷雾电压:3.8kv;鞘气:40;辅助气:10;离子传输管温度:350℃。分辨率:17500;微扫数:1;agc target:2e5;归一化碰撞能量:50。
91.负离子模式:喷雾电压:2.9kv;鞘气:40;辅助气:0;离子传输管温度:350℃。分辨率:17500;微扫数:1;agc target:2e5;归一化碰撞能量:50。
92.1.5compound discoverer代谢组学流程建立:
93.(1)样品经前处理提取后使用高效液相仪与q exactive
tm
组合型四极杆orbitrap质谱仪联用的full ms/dd-ms2扫描模式对样品及空白溶剂进行检测,检测后的数据导入compound discoverer。
94.(2)将各处理的重复样品进行分组并设为sample,将溶剂样品设为blank供后续处理中排除背景峰,将qc样本设为quality control。
95.(3)主要检测离子形式:[m+h]+1、[m-h]-1、[m-h+hac]-1,误差设定为5ppm分正负离子两种检测模式进行检测。
[0096]
(4)搜索软件自带数据库(mass lists):6549种类黄酮数据库、4400种内源代谢物数据库;网络开源数据库(chemspider):aracyc、biocyc、kegg、plantcyc、lipidmaps;二级谱图数据库:mzcloud。
[0097]
1.6代谢组原数据提取以及分析:
[0098]
使用高效液相仪与q exactive
tm
组合型四极杆orbitrap质谱仪联用仪检测所得原始数据通过compound discoverer软件,根据设定好的实验方法对原始数据进行峰提取、峰对齐、归一化、填补缺失数据、降噪处理等获得符合实验要求的正离子相和负离子相变量:代谢物质荷比(m/z)、保留时间(retention time)、峰面积、预测代谢物名字(formula),可通过扫描的代谢物二级质谱图与二级谱图数据库进行匹配对代谢物进行定性,通过扫描代谢物峰面积对代谢物进行相对定量分析。
[0099]
导出至excel可进行更进一步的分析,确定符合要求的正离子相和负离子相变量后采用主成分分析(pca)、偏最小二乘法-判别分析(pls-da)、正交偏最小二乘法-判别分析(opls-da)3种方法分别对质谱数据进行可信性分析检验,并根据pls模型的vip值(阈值》1)、不同大豆品种间代谢产物峰面积学生氏t检验的p值(阈值《0.05)及所得代谢物峰面积倍性变化,进而对供试次生代谢产物差异进行分析。
[0100]
1.7compound discoverer软件修饰化代谢物检测流程建立:
[0101]
基于利用高效液相仪与q exactive
tm
组合型四极杆orbitrap质谱仪联用非靶向代谢物检测所得原始数据,通过compound discoverer软件来对经过已知化学基团修饰化的未知代谢物进行定性检测,其原理就是由于修饰基团与修饰化代谢物在质谱梯度电离的条件下,会产生相同的二级离子。通过设定修饰基团的二级离子来筛选出经该修饰基团修饰的代谢物。
[0102]
(1)样品经前处理提取后使用高效液相仪与q exactive
tm
组合型四极杆orbitrap质谱仪联用的full ms/dd-ms2扫描模式对样品及空白溶剂进行检测,检测后的数据导入
compound discoverer软件。
[0103]
(2)将各处理的重复样品进行分组并设为sample,将溶剂样品设为blank供后续处理中排除背景峰,将qc样本设为quality control。
[0104]
(3)主要检测离子形式:[m+h]+1、[m-h]-1、[m-h+hac]-1,误差设定为5ppm分正负离子两种检测模式进行检测。
[0105]
(4)产生预期化合物:已知修饰基团化学式及名称(如:glutathione:c
10h17
n3o6s,glucose:c6h
12
o6等)。
[0106]
(5)化合物得分:已知修饰基团的二级离子(m/z)值及正负离子扫描模式。
[0107]
2、实验结果:
[0108]
2.1大豆疫霉抗感品种差异代谢物的分析:
[0109]
通过compound discoverer软件自定义的搜库流程,我们搜索比对了以下数据库:包括6549种类黄酮及4400种内源代谢物在内的软件自带数据库;aracyc、biocyc、kegg、plantcyc及lipidmaps开源的数据库;mzcloud二级谱图数据库。通过搜索这些数据库并对代谢物进行二级质谱信息的匹配,整理得到抗病大豆品种(williams 82)和感病大豆品种(williams)之间的差异代谢物,结果如表1和表2所示。
[0110]
表1:疫霉菌茎部侵染抗性生物标志物
[0111][0112]
表2:疫霉菌根部侵染抗性生物标志物
[0113][0114]
整理出kegg id的潜在生物标志物通过联川生物云平台中的代谢通路富集分析即可得到如图1和图2所示近等基因系的不同大豆品种感染疫霉病后的差异代谢物代谢通路富集分析图。其纵轴表示代谢通路名字,圆圈颜色越深则说明代谢物在相应通路中变化越显著,横轴(rich factor)代表在两组生物中筛选出来的差异代谢物数量占该代谢通路的比例,圆圈大小代表该代谢通路中所含有的两组生物样本间差异代谢物数量。
[0115]
2.2大豆疫霉抗感品种修饰化代谢物筛选:
[0116]
根据建立compound discoverer的修饰化代谢物筛选流程,在有得分的修饰化代谢物里按照其接菌时间的不同找出抗感品种中有趋势的差异代谢物。由于这些修饰化代谢
物一般在数据库里不能直接匹配到,便可以通过对其未经修饰时的代谢物进行定性分析。
[0117]
在大豆根部接菌时检测出的可能为谷胱甘肽修饰化的代谢物有18个,根据其趋势及算法匹配条件,进一步并没有筛选出可能对大豆抗疫霉病具有重要影响的修饰化代谢物。
[0118]
在大豆根部接菌时检测出的可能为糖基化修饰代谢物的有81个,根据其趋势及匹配条件,进一步筛选出的可能对大豆抗疫霉病具有重要影响的修饰化代谢物如图3所示。
[0119]
在大豆茎部接菌时检测出的可能为谷胱甘肽修饰化的代谢物有7个,根据其趋势及匹配条件,进一步筛选出的可能对大豆抗疫霉病具有重要影响的修饰化代谢物如图4所示。
[0120]
在大豆茎部接菌时检测出的可能为糖基化修饰代谢物的有98个,根据其趋势及匹配条件,进一步筛选出的可能对大豆抗疫霉病具有重要影响的修饰化代谢物如图5所示。
[0121]
综上,利用所建立的大豆疫霉病非靶向代谢组学分析方法,对抗性品种williams 82和感病品种williams的接菌后不同时间段(0、4、8、12、60小时)的茎部及根部材料从空间和时间两个维度进行代谢组学分析,鉴定出抗疫霉病品种williams 82和感病品种williams接菌后的差异代谢物,这些代谢物在大豆抗疫霉病方面起着重要作用。
[0122]
基于代谢组学研究,进行修饰化代谢物检测流程分析,对抗性品种williams82和感病品种williams接菌后不同时间段(0、4、8、12、60小时)的茎部及根部材料取材,进行糖基化及谷胱甘肽修饰化代谢产物的筛选鉴定。通过实验流程二次筛选发现:大豆疫霉菌的侵染虽没有检测到小分子毒素代谢物,但在大豆茎部研究中发现c
10h14
o3与谷胱甘肽结合及c
11h12
o4与糖基结合生成不利于大豆抗疫性的物质;在大豆根部研究中发现c6h6o3与糖基结合生成不利于大豆抗疫性的物质;发现一种c9h
11
no4与糖基结合及c
11h15
no4与糖基结合生成有利于大豆抗疫性的物质,筛选出来有变化趋势的修饰化代谢物可供进一步研究与其合成相关的酶或基因,在代谢水平上进一步了解大豆与大豆疫霉菌防御反应机制。
[0123]
实施例2:间苯三酚(根皮酚)与大豆疫霉病抗性的相关性研究
[0124]
根据实施例1得到的结果,c6h6o3与糖基结合生成不利于大豆抗疫性的物质,通过对c6h6o3定性发现其为根皮酚,故检测到的葡萄糖基修饰化代谢物c
12h16
o8为根皮酚-β-d-葡糖甙。
[0125]
为对本发明的结果进行验证,设计了如下试验处理:
[0126]
对照1:用含有大豆疫霉菌的营养土种植大豆;
[0127]
对照2:用添加根皮酚标准品的营养土种植大豆,每100g营养土中添加0.1g根皮酚标准品(麦克林公司≥99%,hplc);
[0128]
对照3:用添加根皮酚标准品的营养土种植大豆,每100g营养土中添加1.0g根皮酚标准品;
[0129]
样品1:用每100g营养土添加1.0g根皮酚标准品并且含有大豆疫霉菌的营养土种植大豆;
[0130]
样品2:用每100g营养土添加0.1g根皮酚标准品并且含有大豆疫霉菌的营养土种植大豆;
[0131]
空白对照:用不添加大豆疫霉菌和根皮酚标准品的营养土种植大豆。
[0132]
各处理组所使用的营养土为同一市售的营养土,所接入的大豆疫霉菌为同一菌
株,接入量相同;各处理组所种植的大豆品种为感病品种williams,各处理组的大豆种植生长条件均保持一致。
[0133]
结果如图6所示,结果表明:根皮酚对大豆疫霉菌具有一定的抗性。
[0134]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:胥倩 王群青 王应昊 刘振 田纪春 王西振
- 技术所有人:山东国仓健生物科技有限公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、邢老师:1.机械设计及理论 2.生物医学材料及器械 3.声发射检测技术。
- 2、王老师:1.数字信号处理 2.传感器技术及应用 3.机电一体化产品开发 4.机械工程测试技术 5.逆向工程技术研究
- 3、王老师:1.机器人 2.嵌入式控制系统开发
- 4、张老师:1.机械设计的应力分析、强度校核的计算机仿真 2.生物反应器研制 3.生物力学
- 5、赵老师:检测与控制技术、机器人技术、机电一体化技术
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....