一种血液外泌体PD-L1含量的分析检测方法及其应用与流程
一种血液外泌体pd-l1含量的分析检测方法及其应用
技术领域
1.本发明属于一种pd-l1含量的检测方法,具体涉及一种血液外泌体pd-l1含量的分析检测方法及其应用。
背景技术:
2.结直肠癌(colorectal cancer,crc)是目前全球最常见且高死亡率的消化道恶性肿瘤之一。现有研究表明,肿瘤细胞的免疫逃逸与crc的发生、转移及复发密切相关,肿瘤细胞可通过激活免疫抑制因子,抑制免疫系统识别并清除肿瘤细胞,导致肿瘤细胞发生免疫逃逸,进而过度增殖。
3.程序性死亡配体-1(programmed death ligand-1,pd-l1)是免疫识别系统中重要的负向调控分子,与程序性死亡受体(programmed death 1,pd-1)结合后,可引起肿瘤细胞周围的浸润性t细胞衰竭或凋亡,导致肿瘤细胞逃过机体的免疫监控,促进肿瘤细胞增殖。目前,以pd-1/pd-l1为靶点的免疫治疗是结直肠癌最为精准和有效的临床治疗手段。因为结直肠癌具有高度异质性,导致不同的患者接受相同的pd-1/pd-l1免疫治疗的预后结果存在显著性差异。有的患者预后结果好,生存期得到改善;有的患者预后结果差,生存期短。
4.虽然通过免疫组织化学(ihc)检测肿瘤组织中pd-l1表达水平对制定结直肠癌患者的pd-1/pd-l1免疫治疗方案至关重要,但是由于肿瘤组织中pd-l1 表达水平无法预测pd-1/pd-l1免疫治疗的预后效果而无法预判哪些患者将从 pd-1/pd-l1免疫治疗获益。
5.临床上采集肿瘤组织样本具有以下缺点:
①
不均匀性和不确定性,无法保证准确采集到代表性肿瘤组织样本。
②
采集组织样本本身容易引起肿瘤组织微环境改变导致肿瘤细胞扩散的风险。而测定血液中pd-l1水平可以完全避免上述采集组织样本的缺陷。相对于组织样本的采集,患者对血样采集的配合度和接受度更高。然而,血液中pd-l1水平较低,需要高灵敏检测技术。特别是患者在接受 pd-1/pd-l1免疫治疗后,其血液中pd-l1水平下降明显。因此,急需开发一种灵敏度高和特异性强的分析检测技术用于结直肠癌患者预后评估、判断是否存在肿瘤细胞扩散转移的风险、为制定精准的pd-1/pd-l1免疫治疗方案提供依据。
6.血液中外泌体是50~150nm的具有类似于细胞膜结构的微球,它们是由细胞分泌进入外周血的具有生物活性的纳米颗粒。目前血液外泌体的分离提取方法主要以超高速梯度离心为主,该方法的主要缺点是:
①
外泌体分离提取时间周期长 (15-36小时);
②
外泌体被血液中白蛋白和转铁蛋白等高丰度蛋白污染并严重影响后续分析。
技术实现要素:
7.本技术的主要目的在于提供一种从血液中高效分离提取外泌体和检测外泌体中pd-l1含量的方法及其应用。
8.为了实现上述目的,本发明提供如下技术方案:
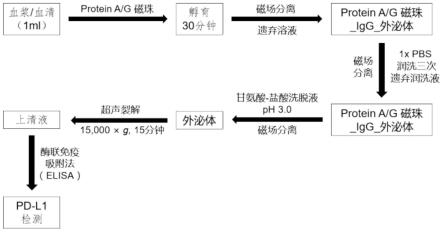
9.一种血液外泌体pd-l1含量的分析检测方法,包括以下步骤:
10.(1)富集分离外泌体:
11.a、将血浆或血清与protein a/g磁珠混合,在2-8℃下静置孵育;
12.b、将步骤a孵育后的混合物在磁场下离心分离,遗弃上清液,使用pbs润洗 protein a/g磁珠,并再次置于磁场下离心分离,遗弃上清液;
13.c、向步骤b所得protein a/g磁珠中加入甘氨酸-盐酸洗脱液,混匀,置于磁场下离心分离,收集上清液-外泌体溶液,备用;
14.(2)裂解外泌体;
15.(3)使用pd-l1 elisa分析检测试剂盒检测步骤(2)所得外泌体裂解物中 pd-l1的含量。
16.本发明所述血液外泌体pd-l1含量的分析检测方法,在保持临床常规血样采集的条件下,通过特异性免疫亲和反应将血液中与结直肠癌相关的外泌体富集分离提取出来。然后使用常规的酶联免疫吸附法(elisa)对血液外泌体中的pd
‑ꢀ
l1进行分析检测。
17.血液外泌体内容物包括dna/rna、蛋白质、脂质类化合物和多糖等生物活性分子。外泌体表面富含与疾病相关的膜蛋白。位于外泌体表面的与结直肠癌疾病密切相关的膜蛋白随外泌体参与外周血循环,由此诱发机体免疫反应而产生大量的igg抗体
‑‑
自抗体(auto-antibody)。这些位于外泌体表面的诱发机体免疫反应的膜蛋白通过亲和反应与其自抗体相结合(抗原-抗体)。因此,利用proteina/g与igg特异性亲和作用的原理,可以通过结合附着于外泌体表面膜蛋白抗原的自抗体从血液中富集分离外泌体。
18.上述一种血液外泌体pd-l1含量的分析检测方法,作为一种优选的实施方案,步骤a中,将1ml血浆或血清与50ul protein a/g磁珠混合孵育30min。
19.protein a/g磁珠为:pierce
tm
蛋白a/g琼脂糖磁珠,货号:78609,thermoscientific。
20.上述一种血液外泌体pd-l1含量的分析检测方法,作为一种优选的实施方案,步骤(b)中,使用300ul、ph为7.4的pbs润洗protein a/g磁珠。
21.上述一种血液外泌体pd-l1含量的分析检测方法,作为一种优选的实施方案,步骤(c)中,甘氨酸-盐酸洗脱液的加入量为50ul,甘氨酸-盐酸洗脱液的ph为 3。
22.若需要对外泌体溶液进行保存,则需向外泌体溶液中加入ph8.5的tris-hcl,使外泌体溶液处于ph为7.0的环境下,然后置于-80℃的环境下保存。
23.上述一种血液外泌体pd-l1含量的分析检测方法,作为一种优选的实施方案,步骤(2)中,裂解外泌体的具体操作为:将装有50ul外泌体溶液的离心管置于冰水中,用超声破碎仪对外泌体进行破碎,并收集上清液,得到外泌体裂解物。
24.本技术所采用pd-l1 elisa分析检测试剂盒购买于泉州市睿信生物科技有限公司。
25.本技术的第二方面,提供一种分析检测所得血液外泌体pd-l1含量在诊断评估结直肠癌方面的应用。
26.上述所述的应用,作为一种优选的实施方案,当血液外泌体pd-l1含量为 387.17
±
66.3时,为无淋巴结转移结直肠癌患者;
27.当血液外泌体pd-l1含量为417.65
±
59.1时,为淋巴结转移结直肠癌患者。
28.本发明的有益效果为:本发明所述血液外泌体pd-l1含量的分析检测方法避免了
现有方法无法富集分离提取与结直肠癌细胞相关pd-l1蛋白和来自血液中其它高丰度蛋白(例如白蛋白和转铁蛋白等)对pd-l1检测的基质干扰的问题,为结直肠癌患者制定pd-1/pd-l1免疫治疗方案提供可靠的科学依据。
29.本发明所述血液外泌体pd-l1含量的分析检测方法能避免血液中其它高丰度蛋白的干扰,精准测量血液中pd-l1的含量,便于精确评估结直肠癌患者接受 pd-1/pd-l1免疫治疗的预后,有效监察患者的治疗过程,准确判断患者是否存在癌细胞转移的风险。
30.本发明所述分析检测方法适用于除结直肠癌以外的其它癌症和重大疾病。
附图说明
31.图1为本发明所述一种血液外泌体pd-l1含量的分析检测方法的流程图。
具体实施方式
32.为了使本技术领域的人员更好地理解本技术方案,下面将结合案例对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分的实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本技术保护的范围。
33.本发明提供了一种血液外泌体pd-l1含量的分析检测方法,其利用protein a/g与igg特异性亲和作用的原理,通过结合附着于外泌体表面膜蛋白抗原的自抗体从血液中富集分离外泌体。具体包括以下步骤:
34.富集分离外泌体:
35.a、将1ml血浆或血清与50ul protein a/g磁珠在2ml离心管内混合(pierce
tm
蛋白a/g琼脂糖磁珠,货号:78609,thermo scientific),在2-8℃下静置孵育 30min;
36.b、将步骤(1)含有孵育后混合物的离心管在磁场下离心分离,遗弃上清液,使用300ul ph为7.4的pbs润洗protein a/g磁珠,并再次置于磁场下离心分离,遗弃上清液;重复使用300ul ph为7.4的pbs润洗protein a/g磁珠,并置于磁场下离心分离,遗弃上清液(重复该操作3-4次);
37.c、向步骤(2)所得protein a/g磁珠中加入ph为3.0的50ul甘氨酸-盐酸洗脱液,混匀,置于磁场下离心分离,收集上清液-外泌体溶液,备用;
38.若收集的上清液-外泌体溶液需要保存时,可将所得上清液-外泌体溶液加入 10ul 1m tris-hcl(ph8.5)的溶液中,使外泌体溶液处于ph 7.0环境下,并将该样本放于-80℃下保存。
39.(1)裂解外泌体;
40.①
将50ul装有外泌体溶液的离心管置于装满冰块的100ml烧杯内,然后将超声破碎仪探针插入1ml离心管深入到外泌体样本溶液中;
41.②
打开超声破碎仪电源,设置工作参数为:40%ampl,持续3秒,间隔7s,共3个循环;
42.③
外泌体破碎全程在冰上进行;将破碎后的外泌体离心管放入可控温离心机(型号:legend micro 21r,thermo scientific),设定温度为4℃,15,000
×
g下离心30分钟,回收上清液得到外泌体裂解物并放于-80℃冰箱内冷冻保存或立即进行elisa分析检测。
43.(3)使用pd-l1 elisa分析检测试剂盒检测步骤(2)所得外泌体裂解物中 pd-l1的含量。严格按照pd-l1 elisa试剂盒说明书进行操作,由试剂盒提供阳性对照和阴性对照。
44.1、本发明所述分析检测血液外泌体pd-l1含量的应用:
45.1.1选取三种人群:健康人群400例,无淋巴结转移的结直肠癌患者200例,淋巴结转移的结直肠癌患者200例。无淋巴结转移结直肠癌患者组、淋巴结转移结直肠癌患者组及健康对照组在年龄和性别构成比、肿瘤直径大小和分化程度、肿瘤临床分期及病理分期等基线资料比较统计学意义上的差异(p》0.05),具有可比性,具体资料如表1所示:
46.表1
[0047][0048][0049]
1.2使用本发明上述血液外泌体pd-l1含量的分析检测方法分别对三种人群的血液外泌体中pd-l1含量进行定量分析检测。
[0050]
应用spss20.0软件对数据进行统计分析,计量资料以(平均值
±
标准偏差) 表示,两组数据差异比较采用t检验;采用卡方检验比较组间数据差异;并采用 cox风险回归模型分析crc预后影响因子。p《0.05为差异显著,具有统计学意义。建立血液外泌体pd-l1含量在
无淋巴结转移结直肠癌患者组、淋巴结转移结直肠癌患者组和健康对照组的平均值,结果如表2所示。
[0051]
表2
[0052][0053]
从表2可以看出:与健康对照组相比,无淋巴结转移结直肠癌组和淋巴结转移结直肠癌组的血液外泌体pd-l1水平均明显升高(p《0.001);且淋巴结转移结直肠癌组的血液外泌体pd-l1水平明显高于无淋巴结转移结直肠癌组 (p《0.001)。无淋巴结转移结直肠癌患者血液外泌体pd-l1含量(387.17
±
66.3) 高于健康人群(223.52
±
54.1),p《0.001;淋巴结转移结直肠癌患者血液外泌体 pd-l1含量(417.65
±
59.1)高于健康人群(223.52
±
54.1),p《0.001。
[0054]
1.3血液外泌体pd-l1含量与结直肠癌临床病例特征的关系:
[0055]
结合结直肠癌患者的临床病理特征,包括:肿瘤直径大小、肿瘤分化程度、肿瘤临床分期和肿瘤病理分期,探究血液外泌体pd-l1含量与结直肠癌患者的临床病理特征是否存在一定的相关性,结果如表3所示。
[0056]
表3
[0057]
[0058]
从表3可以看出:
[0059]
①
结直肠癌患者血液外泌体pd-l1含量与肿瘤直径大小及分化程度不存在统计学分析显著性差异(p》0.05),无相关性;
[0060]
②
结直肠癌患者血液外泌体pd-l1含量与肿瘤临床分期和肿瘤病理分期存在统计学分析显著性差异(p《0.001),相关性显著;
[0061]
③
结直肠癌患者血液外泌体pd-l1含量随着肿瘤临床分期的升高而逐渐升高;
[0062]
④
结直肠癌患者血液外泌体pd-l1含量随着肿瘤病理分期的升高而逐渐升高。
[0063]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1