一种基于CRISPR系统的核酸双指标快速检测试纸条及工作方法与流程
一种基于crispr系统的核酸双指标快速检测试纸条及工作方法
技术领域
1.本发明涉及分子检测技术领域,具体领域为一种核酸双指标快速检测试纸条。
背景技术:
2.crispr分子检测是2017年由博德研究所张锋团队首先开发出来的新型分子检测技术,主要原理是利用cas蛋白接触并结合靶向片段后,本身的无差别反式切割功能被激活,会切割附近一切核酸序列的特点,通过检测探针序列被切割情况从而判读结果的一种检测方法(gootenberg,jonathan,s,et al.nucleic acid detection with crispr-cas13a/c2c2.[j].science,2017.)。
[0003]
2019年,该研究团队将crispr方法和侧向层析试纸结合起来推出了sherlock技术(kellner m j,koob j g,gootenberg j s,et al.sherlock:nucleic acid detection with crispr nucleases[j].nature protocols,2019,14(10))。该方法在系统中引入了两端分别标记生物素(biotin)和异硫氰酸荧光素(fitc)的探针序列。采用的侧向层析试纸条可以检测同时含有biotin和fitc的序列:在近端的条带处包被有可结合biotin的链霉亲和素(streptavidin,sa),在胶体金上标记有抗fitc抗体,另外远端还有一条条带,包被有可与抗fitc抗体结合的二抗。这是一种夹心法的试纸条,当样品中存在同时含有biotin和fitc的序列时,会在近端的条带处形成sa-biotin-探针-fitc-抗fitc抗体-胶体金复合物,从而显色。
[0004]
该研究团队将该夹心法试纸条用竞争法方式使用。样本为阴性时,crispr系统未激活,修饰有biotin和fitc的探针序列不会被切割,探针保持完整,胶体金全部被试纸条近端的sa条带处通过夹心法被完全捕获,不会到达试纸条远端的线。
[0005]
当样本为阳性时,两端分别标记有biotin和fitc的探针序列被切断,从而使部分胶体金越过近端条带到达远端条带,呈现为阳性结果。
[0006]
但是,该试纸条的设计无法进行多指标的联合检测。
技术实现要素:
[0007]
针对上述现有技术中存在的技术问题,本发明提供了一种检测速度快、操作便捷的基于crispr系统的核酸双指标快速检测试纸条及工作方法。
[0008]
目前,crispr核酸检测技术正处于发展期,欧洲、美国以及中国的核酸检测的要求均是双靶标,一个作为内参指标,一个作为检测指标。但是,由于crispr技术是一个信号放大系统,在cas12酶启动后,对于ssdna是一种无差别的切割;cas13启动后,对于ssrna是一种无差别的切割。这样在设计双靶标的时候,只能采用cas12和cas13双系统的策略。而本发明的研发正是为了配合crispr的双系统显色的研发。目前国内外尚未出现配合crispr双系统显色的核酸试纸条。
[0009]
为实现上述目的,本发明提供如下技术方案:
[0010]
一种基于crispr系统的核酸双指标快速检测试纸条,所述试纸条包括双标记结合垫和设置有质控线、第一检测线及第二检测线的硝酸纤维素膜。
[0011]
进一步的,所述双标记结合垫上设置有鼠源抗体-标记载体偶联物和兔源抗体-标记载体偶联物。
[0012]
进一步的,所述鼠源抗体-标记载体偶联物包括鼠抗fitc抗体-标记载体偶联物。
[0013]
进一步的,所述兔源抗体-标记载体偶联物包括兔抗地高辛(digo xigenin,dig)抗体-标记载体偶联物。
[0014]
进一步的,所述标记载体为纳米金、纳米银、纳米碳、彩色微球和荧光微球中的至少一种。
[0015]
进一步的,所述质控线、第二检测线和第一检测线依次固定于硝酸纤维素膜上,所述质控线设置于靠近结合垫的一端,所述质控线包被有sa,所述第一检测线包被有羊抗鼠二抗,所述第二检测线包被有羊驼抗兔抗dig纳米单抗。经过大量实验研究,为增加特异性,发明人研究团队用羊驼免疫兔抗dig一抗,以下表述为羊驼抗兔抗dig纳米单抗。
[0016]
本发明基于crispr系统的核酸双指标快速检测试纸条的工作原理具体为:
[0017]
crispr系统设置有两种cas蛋白(cas12蛋白和cas13蛋白)、两种标记探针,且两种cas蛋白分别设置有不同的可靶向待检核酸分子的引导序列;两种标记探针包括第一标记探针和第二标记探针,标记探针由核酸探针和标记物偶联而成,当第一标记探针接触到其中一个被激活后cas蛋白则第一标记探针被切割,当第二标记探针接触到另一个被激活后的cas蛋白则第二标记探针被切割。第一标记探针为第一核酸探针与biotin、fitc偶联而成,biotin偶联于所述第一核酸探针的一端,fitc偶联于第一核酸探针的另一端。第二标记探针为第二核酸探针与biotin、dig偶联而成,biotin偶联于第二核酸探针的一端,dig偶联于第二核酸探针的另一端。
[0018]
当检测样本中不存在待检测分子时,cas12蛋白和cas13蛋白无法被两种待检测物质激活,双标记探针无法被切割,双标记结合垫上的鼠抗fitc抗体-标记载体偶联物和兔抗dig抗体-标记载体偶联物分别能够识别双标记探针上的fitc和dig并结合形成完整探针标记载体复合物,并通过层析作用在硝酸纤维素膜上跑动,当经过质控线时,完整探针标记载体复合物被质控线上包被的sa捕获,无法继续层析至第一检测线和第二检测线,无法在检测线区域形成可视信号,指示样本中不存在对应的待检测分子。
[0019]
当待检测样本中存在两种待检测分子时,cas12蛋白和cas13蛋白能够被两种待检测物质激活,进而实现对双标记探针的切割,双标记结合垫上的鼠抗fitc抗体-标记载体偶联物和兔抗dig抗体-标记载体偶联物分别能够识别双标记探针上的fitc和dig并结合形成切割探针标记载体复合物,并通过层析作用在硝酸纤维素膜上跑动,当经过第一检测线和第二检测线时,切割探针标记载体复合物分别被第一检测线和第二检测线上包被的羊抗鼠二抗和羊驼抗兔抗dig纳米单抗捕获,逐渐富集至形成可视信号,指示样本中存在对应的待检测分子。
[0020]
与现有技术相比,本发明的有益效果是:
[0021]
(1)本发明通过采用crispr与侧向层析试纸结合的形式,操作便捷,检测速度快,5~15min便可实现待检测分子的可视化检测。
[0022]
(2)本发明通过设置双标记探针、双标记结合垫和质控线、第一检测线和第二检测
线,实现了核酸双指标的同时检测,极大的提升了检测效率。
[0023]
(3)本发明试纸条的胶体金部分,第一胶体金乳胶微球偶联的是兔抗dig的单抗,第二胶体金乳胶微球偶联的为鼠抗fitc的单抗。在正常设计下,2条检测线分别包埋抗鼠和抗兔的2抗即可。但是,由于不同样本的复杂性,非常容易出现抗体交联的现象,出现假阳的非特异结合。为了解决特异性和假阳,本发明研究团队制作了羊驼抗兔抗dig纳米单抗的纳米单抗,从而从根本上解决了非特异结合的问题,避免了假阳现象的出现。
[0024]
(4)本发明试纸条同时增加了质控线的载量,使用更多的探针,更好的体现crispr的信号放大作用。
[0025]
(5)由于同时使用了第一胶体金乳胶微球和第二胶体金乳胶微球,在同时截留2种微球在质控线上,呈现的自然颜色为紫色。当切割fitc—biotin偶联的第二胶体金乳胶微球时,第一检测线为红色,质控线会从紫色逐渐变为蓝色。当切割dig—biotin偶联的第一胶体金乳胶微球时,第二检测线为蓝色,质控线会从紫色逐渐变为红色。当2种探针都被切割的时候,质控线的紫色会逐渐变淡,或者消失。本发明同时提供了2种互相矫正的判读模式,增加判读的准确性和便利性。
附图说明
[0026]
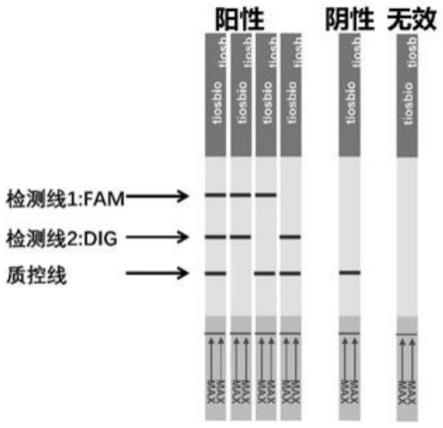
图1为本发明基于crispr系统的核酸双指标快速检测试纸条的显色结果示意图。
[0027]
图2为不同胶体金包被、第一检测线及第二检测线包被抗体的标记及组合方式对阴性对照的显示情况。
[0028]
图3为本发明的基于crispr系统的核酸双指标快速检测试纸条结构示意图。
[0029]
其中,1为样品垫,2为双标记结合垫,3为硝酸纤维素膜,4为吸收垫,5为质控线,6为第一检测线,7为第二检测线,8为biotin,9为fitc,10为dig,11为sa,12为第一胶体金乳胶微球,13为第二胶体金乳胶微球,14为单链核苷酸,15为鼠抗fitc单抗,16为兔抗dig单抗,17为羊驼抗兔抗dig纳米单抗,18为羊抗鼠二抗。
[0030]
图4为使用本发明的试纸条对带有sars-cov-2orf1ab基因和e基因的不同拷贝数假病毒裂解液的上清液的rt raa扩增反应后,产物分别进行crispr/cas12a酶切检测结果。
[0031]
图中,从左到右试纸条1~7分别对应初始扩增体系添加的假病毒裂解液含有1.4
×
106拷贝、1.4
×
105拷贝、1.4
×
104拷贝、1.4
×
103拷贝、1.4
×
102拷贝、1.4
×
101拷贝、1.4
×
100拷贝的sars-cov-2orf1ab基因和e基因分别进行crispr/cas12-rt raa的试纸条检测结果;—1为对应初始扩增体系添加的是未加入假病毒的健康人鼻拭子等体积裂解液上清液的crispr/cas12-rt raa检测结果;—2为对应初始扩增体系添加的是等体积纯净水的crispr/cas12-rt raa检测结果。
[0032]
图5为使用本发明研制的试纸条对带有sars-cov-2orf1ab基因和n基因的不同拷贝数假病毒裂解液的上清液的crispr/cas13a+cas12-rt raa检测结果。
[0033]
图中,从左到右试纸条1~7分别对应扩增体系添加的假病毒裂解液含有6.8
×
106拷贝、6.8
×
105拷贝、6.8
×
104拷贝、6.8
×
103拷贝、6.8
×
102拷贝、6.8
×
101拷贝、6.8
×
100拷贝的sars-cov-2orf1ab基因和n基因进行crispr/cas13a+cas12-rt raa的试纸条检测结果;—1为对应初始扩增体系添加的是未加入假病毒的健康人鼻拭子等体积裂解液上清液的crispr/cas13a+cas12-rt raa检测结果;—2为对应初始扩增体系添加的是等体积纯净
水的crispr/cas13a+cas12-rt raa检测结果。
具体实施方式
[0034]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0035]
实施例1
[0036]
本发明的基于crispr系统的核酸双指标快速检测试纸条,包括双标记结合垫和设置有质控线、第一检测线及第二检测线的硝酸纤维素膜。
[0037]
发明人分别设计了多种抗体包被方式,以筛选胶体金包被抗体、第一检测线及第二检测线包被抗体的最佳标记及组合方式。
[0038]
其中,方式一为,双标记结合垫上设置有鼠源抗体-标记载体偶联物和兔源抗体-标记载体偶联物。鼠源抗体-标记载体偶联物为鼠抗fitc抗体-标记载体偶联物。兔源抗体-标记载体偶联物为兔抗dig抗体-标记载体偶联物。标记载体为纳米金。质控线、第二检测线和第一检测线依次固定于硝酸纤维素膜上,质控线设置于靠近双标记结合垫的一端,质控线包被有sa,第一检测线包被有羊抗鼠二抗,所述第二检测线包被有羊抗兔二抗。
[0039]
其中,方式二为,双标记结合垫上设置有鼠源抗体-标记载体偶联物和兔源抗体-标记载体偶联物。鼠源抗体-标记载体偶联物为鼠抗fitc抗体-标记载体偶联物。兔源抗体-标记载体偶联物为兔抗dig单抗-标记载体偶联物。标记载体为纳米金。质控线、第二检测线和第一检测线依次固定于硝酸纤维素膜上,质控线设置于靠近双标记结合垫的一端,质控线包被有sa,第一检测线包被有羊抗鼠二抗,所述第二检测线包被有羊抗兔二抗。
[0040]
其中,方式三为,双标记结合垫上设置有鼠源抗体-标记载体偶联物和兔源抗体-标记载体偶联物。鼠源抗体-标记载体偶联物为鼠抗fitc抗体-标记载体偶联物。兔源抗体-标记载体偶联物为兔抗dig单抗-标记载体偶联物。标记载体为纳米金。质控线、第二检测线和第一检测线依次固定于硝酸纤维素膜上,质控线设置于靠近双标记结合垫的一端,质控线包被有sa,第一检测线包被有羊抗鼠二抗,所述第二检测线包被有羊驼抗兔抗dig纳米单抗。
[0041]
在50μl超纯水内加入10μm第一标记探针、10μm第二标记探针各0.8μl,制备成阴性对照,制作不同方式的试纸条小样,并使用小样对阴性对照进行检测,预计检测结果呈现方式如图1所示,阴性对照实际检测结果如图2所示,只有方式三的检测情况与设计思路相符,表现最佳。因此,确定基于crispr系统的核酸双指标快速检测试纸条的胶体金包被抗体、第一检测线及第二检测线包被抗体的标记及组合方式为方式三。
[0042]
本发明基于crispr系统的核酸双指标快速检测试纸条如图3所示,包括双标记结合垫2和设置有质控线5、第一检测线6及第二检测线7的硝酸纤维素膜3。
[0043]
双标记结合垫2上设置有鼠源抗体-标记载体偶联物和兔源抗体-标记载体偶联物。鼠源抗体-标记载体偶联物为鼠抗fitc抗体-标记载体偶联物。兔源抗体-标记载体偶联物为兔抗dig单抗-标记载体偶联物。
[0044]
标记载体为纳米金。在其他有益实施例中,也可采用纳米银、纳米碳、彩色微球和
荧光微球等等。
[0045]
质控线5、第二检测线7和第一检测线6依次固定于硝酸纤维素膜3上,质控线5设置于靠近双标记结合垫2的一端,质控线5包被有sa 11,第一检测线6包被有羊抗鼠二抗18,所述第二检测线7包被有羊驼抗兔抗dig纳米单抗17。
[0046]
crispr系统设置有cas12蛋白和cas13蛋白,两种标记探针,且两种cas蛋白分别设置有不同的可靶向待检测分子的引导序列;两种标记探针包括第一标记探针和第二标记探针,标记探针由核酸探针和标记物偶联而成,当第一标记探针接触到其中一个被激活后cas蛋白则第一标记探针被切割,当第二标记探针接触到另一个被激活后的cas蛋白则第二标记探针被切割。第一标记探针为第一核酸探针与biotin 8、fitc 9偶联而成,biotin 8偶联于所述第一核酸探针的一端,fitc 9偶联于第一核酸探针的另一端。第二标记探针为第二核酸探针与biotin 8、dig 10偶联而成,biotin 8偶联于第二核酸探针的一端,dig 10偶联于第二核酸探针的另一端。
[0047]
实施例2
[0048]
使用实施例1中的方式三生产的基于crispr系统的核酸双指标快速检测试纸条。其中,检测试纸条(试纸条1~6)检测判定样本中是否含有sars-cov-2 orf1ab基因或n基因,阴性质控试纸条(试纸条7~9)作为质控,确定操作过程无污染及假阳性。
[0049]
使用yong chen等(yong chen,nan zong,feidi ye,et al.dual-crispr/cas12a-assisted rt-raa for ultrasensitive sars-cov-2detection on automated centrifugal microfluidics.anal.chem.2022,94,27,9603
–
9609.)发表的sars-cov-2病毒crispr/cas12a-rt raa检测引物对混有不同拷贝sars-cov-2orf1ab基因和e基因的假病毒的健康人鼻拭子样本,健康人鼻拭子样本和阴性质控样本进行检测。
[0050]
使用方法具体为:将上海复百澳生物带有sars-cov-2orf1ab基因和e基因的假病毒稀释至2
×
106拷贝/μl,再10倍系列稀释,获得2
×
100拷贝/μl、2
×
101拷贝/μl、2
×
102拷贝/μl、2
×
103拷贝/μl、2
×
104拷贝/μl和2
×
105拷贝/μl的假病毒稀释液为后续核酸免提取的裂解模板。健康人鼻拭子样本,加入不同拷贝的上海复百澳生物带有sars-cov-2orf1ab基因和e基因的假病毒后,用酷闪核酸释放剂(bt0068)进行免提取方式的裂解,吸取34.2μl的裂解液上清液,分别对应1.4
×
100拷贝、1.4
×
101拷贝、1.4
×
102拷贝、1.4
×
103拷贝、1.4
×
104拷贝和1.4
×
105拷贝的假病毒裂解液为后续rt raa的扩增模板。在单一eppendorf管内,通过rt raa的方式对sars-cov-2orf1ab基因(检测线1)或e基因(检测线2)进行扩增,同时设置模板替换为同体积水的阴性对照,作为阴性质控。其中,检测试纸条可判定样本中是否含有sars-cov-2orf1ab基因或e基因,阴性质控试纸条作为质控,可确定操作过程无污染及假阳性。
[0051]
体系中使用的crrna及信号分子均为人工合成,其中,引物序列如seq id no:1-8所示:
[0052]
orf1ab基因rt-raa正向引物1为:
[0053]
5'-gcaataacagttacaccggaagccaatatg-3';
[0054]
orf1ab基因rt-raa反向引物1为:
[0055]
5'-atcacaactacagccataacctttccacat-3';
[0056]
orf1ab基因crrna正向引物:
[0057]
5'-uaauuucuacuaaguguagauguggugcaucguguugucuguac-3'
[0058]
orf1ab基因crrna反向引物:
[0059]
5'-uaauuucuacuaaguguagauuacauacuuaccuuuuaagucac-3'
[0060]
信号分子tag ssdna1:5'-6-fitc-tttatt-biotin-3'
[0061]
e基因rt-raa正向引物为:
[0062]
5'-cggaagagacaggtacgttaatagttaatagc-3';
[0063]
e基因rt-raa反向引物为:
[0064]
5'-agaccagaagatcaggaactctagaagaat-3';
[0065]
e基因crrna正向引物:
[0066]
5'-uaauuucuacuaaguguagaugugguauucuugcuaguuacacu-3'
[0067]
e基因crrna反向引物:
[0068]
5'-uaauuucuacuaaguguagaucaagacucacguuaacaauauug-3'
[0069]
信号分子tag ssdna2:5'-dig-tttatt-biotin-3'
[0070]
rt-raa扩增使用rt raa核酸扩增试剂盒(基础款)(jy0203)进行,单个样品的rt raa扩增反应体系如下:
[0071]
组分用量(μl)基础缓冲液58.8orf1ab或e基因rt-raa正向引物(40μm)1orf1ab或e基因rt-raa反向引物(40μm)1样本裂解液上清液或超纯水34.2以水补足体积至95
[0072]
打开反应单元,在每个0.2ml的eppendorf管加入5μl 280mm的mgac2,充分混匀并离心收集。注意,该步骤不能用涡旋振荡器剧烈振荡混匀。将反应管放置在39℃条件下反应20min。
[0073]
反应结束后,打开反应管吸取4μl产物,加入一个新的0.2ml eppendorf管中,单个样品的crispr/cas12a-rt raa切割反应体系如下:
[0074]
组分用量(μl)基础缓冲液buffer(10x)2orf1ab或e基因rt-raa正向crrna(10μm)0.2orf1ab或e基因rt-raa反向crrna(10μm)0.2rt raa扩增产物4cas12a核酸酶0.4信号分子tag ssdna1或信号分子tag ssdna20.8以水补足体积至20
[0075]
充分混匀并离心收集。注意,该步骤不能用涡旋振荡器剧烈振荡混匀。将反应管放置在39℃条件下反应20min。
[0076]
酶切反应结束后,并将不同信号分子的切割产物混合后,将混合后的切割产物加水补足至50μl,判断检测结果。阴性质控试纸条的检测结果必须为阴性,用于判断操作过程
是否存在污染。鼻拭子样本扩增产物试纸条检测结果可能为阴性或阳性,用于判断样本是否含有sars-cov-2的orf1ab基因和/或e基因。当样本内sars-cov-2拷贝数较低时,可能出现裂解液扩增后,可能仅在检测线1或检测线2显示阳性的情况,此时可重复检测,确保结果的准确性。
[0077]
试验结果如图4所示,所发明的基于crispr系统的核酸双指标快速检测试纸条对不同拷贝数sars-cov-2 orf1ab基因和e基因的假病毒的健康人鼻拭子样本裂解液上清液的扩增,及不同信号分子的crispr/cas12a酶切反应后,可准确检出400拷贝/ml的假病毒。
[0078]
实施例3
[0079]
本实施例使用上海复百奥生物带有sars-cov-2orf1ab基因和n基因的假病毒,利用yangyang sun等(2021)(yangyang sun,lei yu,chengxi liu,et al.one-tube sars-cov-2detection platform based on rt-rpa and crispr/cas12a.j transl med.2021feb 16;19(1):74.)提供的sars-cov-2n基因cas12检测引物,及arizti-sanz j等(2020)(jon arizti-sanz,catherine a freije,alexandra c stanton,et al.streamlined inactivation,amplification,and cas13-based detection of sars-cov-2.nat commun.2020nov 20;11(1):5921.)提供的sars-cov-2orf1ab基因cas13a检测引物和体系进行扩增及切割。
[0080]
体系中使用的crrna及信号分子均为人工合成,其中,引物序列如seq id no:9-15所示:
[0081]
orf1ab基因rt-raa正向引物2为:5'-gaaattaatacgactcactatagggccaaggtaaacctttggaatttggtgccac-3';
[0082]
orf1ab基因rt-raa反向引物2为:5'-actatcatcatctaaccaatcttcttcttg-3';
[0083]
orf1ab基因cas13a crrna为:5'-cucuucuucagguugaagagcagcagaa-3';
[0084]
orf1ab fitc reporter为:5'-6-fitc-uuuuuuuuuuuuuu-biotin-3';
[0085]
n基因rt-raa正向引物为:5'-cagcagtaggggaacttctcctgctagaatgg-3';
[0086]
n基因rt-raa反向引物为:5'-tggcctttaccagacattttgctctcaagctg-3';
[0087]
n基因cas12 crrna为:5'-gggaauuucuacuguuguagaucugcugcuugacagauuga-3';
[0088]
n dig reporter为5'-dig-ttattatt-biotin-3';
[0089]
rt-raa扩增使用rt raa核酸扩增试剂盒(基础款)(jy0203)进行,检测产物使用本试纸条进行检测,单个样品的反应体系如下:
[0090]
组分用量(μl)基础缓冲液58.8orf1ab rt-raa正向引物(20μm)0.6orf1ab rt-raa反向引物(20μm)0.6cas13a酶预混液3orf1ab fitc reporter(10μm)1.6rnase inhibitor(40u/μl)2rnase h(5u/μl)2t7 rna polymerase(50u/μl)2orf1ab cas13a crrna(2μm)0.8
n rt-raa正向引物(10μm)0.6n rt-raa反向引物(10μm)0.6n dig reporter(10μm)1.6cas12酶预混液3n cas12crrna(2μm)0.8样本裂解液上清液或超纯水17以水补足体积至95
[0091]
将上海复百澳生物带有sars-cov-2orf1ab基因和e基因的假病毒稀释至2
×
106拷贝/μl,再10倍系列稀释,获得2
×
100拷贝/μl、2
×
101拷贝/μl、2
×
102拷贝/μl、2
×
103拷贝/μl、2
×
104拷贝/μl和2
×
105拷贝/μl的假病毒稀释液为后续核酸免提取的裂解模板。健康人鼻拭子样本,加入不同拷贝的上海复百澳生物带有sars-cov-2orf1ab基因和e基因的假病毒后,用酷闪核酸释放剂(bt0068)进行免提取方式的裂解,吸取17μl的裂解液上清液,分别对应6.8
×
100拷贝、6.8
×
101拷贝、6.8
×
102拷贝、6.8
×
103拷贝、6.8
×
104拷贝和6.8
×
105拷贝的假病毒裂解液为后续rt raa的扩增模板。在单一eppendorf管内,通过对sars-cov-2orf1ab基因(检测线1)或n基因(检测线2)同时进行rt raa扩增及cas12和cas13a的切割反应,同时设置模板替换为同体积水的阴性对照,作为阴性质控。其中,检测试纸条可判定样本中是否含有sars-cov-2orf1ab基因或n基因,阴性质控试纸条作为质控,可确定操作过程无污染及假阳性。
[0092]
加样顺序为阴性质控样本(样本裂解液上清液替换为同体积的超纯水)、鼻拭子样本裂解液上清液,每个样本添加完毕后均需立即扣好管盖,避免气溶胶污染。将上述反应体系混匀,加入基础反应单元,使冻干粉充分溶解,注意,该步骤不能使用涡旋振荡器剧烈振荡混匀。打开反应单元,在每个0.2ml的eppendorf管加入5μl 280mm的mgac2,充分混匀并离心收集。注意,该步骤不能用涡旋振荡器剧烈振荡混匀。
[0093]
将反应管放置在39℃条件下反应60min。待反应结束后,打开eppendorf管,吸取5μl扩增产物至一新的eppendorf管中,做好标记,稀释15倍后进行检测。
[0094]
试验结果如图5所示,通过对不同浓度及未添加sars-cov-2假病毒的鼻拭子检测结果,本试纸条可准确检测400拷贝/ml的假病毒。
[0095]
通过以上实施例可以看出,本发明方案为一种可同时检测两种不同cas酶切割产物的侧向层析试纸条。该试纸条可以有效进行基于crispr系统的双靶标可视化检测。
[0096]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
[0097]
在缺少本文中所具体公开的任何试剂、限制的情况下,可以实现本文所示和所述的发明。所采用的术语和表达法被用作说明的术语而非限制,并且不希望在这些术语和表达法的使用中排除所示和所述的特征或其部分的任何等同物,而且应该认识到各种改型在本发明的范围内都是可行的。因此应该理解,尽管通过各种实施例和可选的特征具体公开了本发明,但是本文所述的概念的修改和变型可以被本领域普通技术人员所采用,并且认为这些修改和变型落入所附权利要求书限定的本发明的范围之内。
[0098]
本文中所述或记载的文章、专利、专利申请以及所有其他文献和以电子方式可得
的信息的内容在某种程度上全文包括在此以作参考,就如同每个单独的出版物被具体和单独指出以作参考一样。申请人保留把来自任何这种文章、专利、专利申请或其他文献的任何及所有材料和信息结合入本技术中的权利。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1