一种病毒抗原检测试纸的金标记垫及其检测试纸的制备方法与流程
1.本发明涉及检测试剂领域,尤其涉及一种病毒抗原检测试纸的金标记垫及其检测试纸的制备方法。
背景技术:
2.传统新型冠状病毒抗原检测试纸多使用3种探针进行检测,
①
胶体金,制备成本低廉,偶联方式简单,物理吸附连接,原料使用量相对较大,原料利用率相对较低;
②
乳胶微球,微球制备工艺成熟,微球颗粒较大,颗粒之间容易吸附,粒径及浓度批间差异较难准确控制,化学键结合,相对较为稳定,信号值较强;
③
荧光微球,多在定量产品使用,其特点同乳胶微球类似,多需要配检测读数仪器。
技术实现要素:
3.本发明的目的在于提供一种将纳米金修饰后通过化学偶联的方式,将待标记的蛋白间接的连接在纳米金上,该方式下,原料的使用量较少,产品特异性高、灵敏度相对较高,产品成本相对较低。
4.为实现上述目的,本发明提供一种病毒抗原检测试纸的金标记垫的制备方法,其特征在于,选用了2-巯基甲基戊二酸作为修饰纳米金的材料。
5.进一步,包括如下步骤,
6.s1.将5-15mm的2-巯基甲基戊二酸、0.05-2%的r2、0.02-0.1mm tcep的混合液,与纳米金混合孵育;
7.优选的,所述r2为peg20000或pvp;混合液为5-15mm的2-巯基甲基戊二酸、0.1%的r2、0.02-0.1mm tcep;混合液与纳米金的体积比为20:1000;孵育为37℃孵育30-150min;
8.s2.离心去上清,重悬后超声静置;
9.优选的,所述离心为10000rpm 10min,重悬用含1%bsa的10mm ph=7.1-7.4pbs,静置为室温静置5-30min;
10.s3.离心去上清,重悬后超声悬浮得到纳米金悬浮液;
11.优选的,所述离心为10000rpm 10min,重悬的悬浮液为50mm mes ph=6.0、0.1%pvp、5/万proclin 300;
12.s4.将上述所得纳米金悬浮液加入mes溶液后超声清洗,离心去上清;
13.优选的,所述mes溶液为50mm mes ph=6.0;纳米金悬浮液和mes溶液的体积比为1:4;
14.s5.加入mes溶液重悬上述所得沉淀,再加入偶联活化剂活化,再离心去上清,用500μl 50mm hepe(ph=7.5)超声悬浮后,加入待偶联的抗体2-8℃过夜;所述待偶联的抗体为兔igg或新型冠状病毒n抗体;
15.优选的,所述mes溶液为50mm mes ph=6.0;所述活化为37℃活化30min或者2-8℃活化6h;hepe溶液为50mm ph=7.5的hepe;
300;
33.铺金液:30mm tris、0.5%peg、5%蔗糖、0.3%casein-na、0.25%t20、5/万proclin300。
34./万是指10-4
克/升:比如4/万浓度的纳米金是指4
×
10-4
克/升的纳米金;5/万proclin300是指5
×
10-4
克/升的proclin 300。以此类推。
35.本发明提供的检测试纸的制备方法为
36.1.金标记垫制备工艺:
37.1)将5-15mm的2-巯基甲基戊二酸、0.1%的r2(peg20000、pvp)、0.02-0.1mm tcep的溶液20μl同1ml 4/万浓度的纳米金混合,37℃孵育30-150min;
38.2)10000rpm 10min去上清,使用10mm pbs(ph=7.1-7.4)、1%bsa溶液超声悬浮后室温静置5-30min;
39.3)10000rpm 10min去上清,使用200μl悬浮液超声悬浮后得到纳米金悬浮溶液2-8℃保存待用。备注:悬浮液使用50mm mes ph=6.0、0.1%pvp、5/万proclin 300;
40.4)取3)纳米金悬浮溶液200μl加入50mm mes ph=6.0 800μl超声清洗,离心去上清;
41.5)加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入待偶联的抗体(兔igg和新型冠状病毒n抗体)。2-8℃过夜;
42.6)过夜后加入10μl 10%bsa室温静置30min,离心去上清,使用200μl保存液悬浮保存。备注:保存液的配方为30mm tris、0.1%pvp、4%蔗糖、0.1%bsa、0.3%casein-na、5/万proclin 300;
43.7)取200μl 6)所得加入铺金液800μl,将其加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。
44.2包被:
45.将t线抗体、c线抗体分别用包被液稀释至0.8mg/ml,(包被液配置:30mm tris-hcl、2%蔗糖、5/万proclin300),使用划膜仪,按照1.0μl/cm的参数要求,划到nc膜上,放入37-45℃烘干箱中烘干4h以上,密封保存待用。
46.3组装:
47.将nc膜、金标记垫、吸水纸等按照吸水纸,nc膜,金标记垫,样本垫的顺序依次组装,然后切成4mm左右大小使用。
48.实施例1病毒抗原检测试纸的金标记垫及其检测试纸的制备实验
49.1.金标记垫的制备:
50.1)将5mm的2-巯基甲基戊二酸、0.1%peg20000、0.02mm tcep的溶液20μl同2ml4/万浓度的纳米金混合,37℃孵育30min;
51.2)10000rpm 10min去上清,使用10mm pbs(ph=7.1-7.4)、1%bsa溶液超声悬浮后室温静置10min.
52.3)10000rpm 10min去上清,使用400μl悬浮液超声悬浮后2-8℃保存待用。备注:悬浮液使用50mm mes ph=6.0、0.1%pvp、5/万proclin 300。
53.4)取3)纳米金悬浮溶液200μl加入50mm mes ph=6.0 800μl超声清洗,离心去上
清。
54.5)
①
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入8μg新型冠状病毒n抗体1,2-8℃过夜。
55.②
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入4μg兔igg,2-8℃过夜。
56.6)过夜后上述
①
和
②
分别加入10μl10%bsa室温静置30min,离心去上清,分别使用200μl保存液悬浮,悬浮后再按照1:1体积比混合保存。备注:保存液使用30mm tris、0.1%pvp、4%蔗糖、0.1%bsa、0.3%casein-na、5/万proclin 300。
57.7)取200μl 6)加入铺金液800μl,将其加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。
58.2.检测试纸的制备
59.将上述制备的金标记垫进行包被,组装即可;
60.其中包被为将t线抗体、c线抗体划到nc膜上后烘干;
61.优选的,所述包被为将t线抗体、c线抗体分别用包被液稀释至0.8mg/ml,使用划膜仪,按照1.0μl/cm的参数要求,划到nc膜上,放入37-45℃烘干箱中烘干4h以上,密封保存待用;更优选的,所述包被液为30mm tris-hcl、2%蔗糖、5/万proclin300;
62.所述组装为按照吸水纸,nc膜,金标记垫,样本垫的顺序依次组装好,然后切成所需试纸大小。
63.实施例2同等灵敏度试剂稳定性实验
64.本发明检测试纸的制备:
65.1)将5mm的2-巯基甲基戊二酸、0.1%peg20000、0.02mm tcep的溶液20μl同2ml4/万浓度的纳米金混合,37℃孵育30min;
66.2)10000rpm 10min去上清,使用10mm pbs(ph=7.1-7.4)、1%bsa溶液超声悬浮后室温静置10min.
67.3)10000rpm 10min去上清,使用400μl悬浮液超声悬浮后2-8℃保存待用。备注:悬浮液使用50mm mes ph=6.0、0.1%pvp、5/万proclin 300。
68.4)取3)纳米金悬浮溶液200μl加入50mm mes ph=6.0 800μl超声清洗,离心去上清。
69.5)
①
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入8μg新型冠状病毒n抗体1,2-8℃过夜。
70.②
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入4μg兔igg,2-8℃过夜。
71.6)过夜后上述
①
和
②
分别加入10μl10%bsa室温静置30min,离心去上清,分别使用200μl保存液悬浮,悬浮后再按照1:1体积比混合保存。备注:保存液使用30mm tris、0.1%pvp、4%蔗糖、0.1%bsa、0.3%casein-na、5/万proclin 300。
72.7)取200μl 6)加入铺金液800μl,将其加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。
73.对照工艺检测试纸的制备:
74.①
将3μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入20μg新型冠状病毒n抗体1,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
②
将7μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入15μg兔igg,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
③
将
①
和
②
混合后加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用)。
75.结果检测:采用本发明检测试和对照工艺检测试纸进行检测,结果见表1和表2。其中表1为37℃下不同天数的稳定性检测结果结果表。表2为45℃下不同天数的稳定性检测结果结果表。
76.表1 37℃下不同天数的稳定性检测结果结果表
[0077][0078]
表2 45℃下不同天数的稳定性检测结果结果表
[0079][0080][0081]
可以看出,在37℃和45℃条件下,本发明的工艺所得检测试纸的稳定性均优于对照工艺所得对照检测试纸。
[0082]
实施例3相同关键物料投料量的活性对比实验
[0083]
本发明检测试纸的制备:
[0084]
1)将15mm的2-巯基甲基戊二酸、0.1%peg20000、0.1mm tcep的溶液20μl同2ml4/万浓度的纳米金混合,37℃孵育30min;
[0085]
2)10000rpm 10min去上清,使用10mm pbs(ph=7.1-7.4)、1%bsa溶液超声悬浮后室温静置10min;
[0086]
3)10000rpm 10min去上清,使用400μl悬浮液超声悬浮后2-8℃保存待用。备注:悬浮液使用50mm mes ph=6.0、0.1%pvp、5/万proclin 300。
[0087]
4)取3)纳米金悬浮溶液200μl加入50mm mes ph=6.0 800μl超声清洗,离心去上清。
[0088]
5)
①
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入8μg新型冠状病毒n抗体1,2-8℃过夜。
[0089]
②
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入4μg兔igg,2-8℃过夜。
[0090]
6)过夜后分别加入10μl10%bsa室温静置30min,离心去上清,分别使用200μl保存液悬浮,悬浮后1:1混合保存。备注:保存液使用30mm tris、0.1%pvp、4%蔗糖、0.1%bsa、0.3%casein-na、5/万proclin 300。
[0091]
7)取200μl 6)加入铺金液800μl,将其加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。
[0092]
对照工艺检测试纸的制备:
[0093]
①
将3μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入8μg新型冠状病毒n抗体1,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
②
将7μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入4μg兔igg,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
③
将
①
和
②
混合后加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。)
[0094]
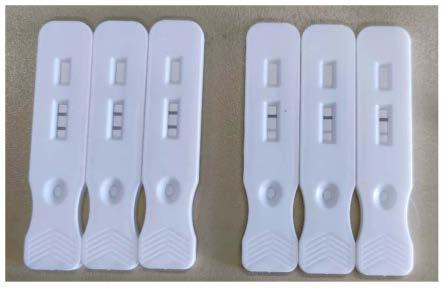
结果检测:采用本发明检测试和对照工艺检测试纸进行检测,结果见表3和图2,图2从左到右依次为,左边三个代表本发明的工艺所得检测试纸的检测结果,右边三个代表对照工艺所得对照检测试纸的检测结果。
[0095]
表3性能对比结果表
[0096][0097]
可以看出,同等原料使用量的情况下,本发明的工艺所得检测试纸的敏感度远优于对照工艺所得对照检测试纸。
[0098]
实施例4同等灵敏度试剂特异性实验
[0099]
本发明检测试纸的制备:
[0100]
1)将5mm的2-巯基甲基戊二酸、0.1%peg20000、0.02mm tcep的溶液20μl同2ml 4/万浓度的纳米金混合,37℃孵育150min;
[0101]
2)10000rpm 10min去上清,使用10mm pbs(ph=7.1-7.4)、1%bsa溶液超声悬浮后室温静置10min.
[0102]
3)10000rpm 10min去上清,使用400μl悬浮液超声悬浮后2-8℃保存待用。备注:悬浮液使用50mm mes ph=6.0、0.1%pvp、5/万proclin 300。
[0103]
4)取3)纳米金悬浮溶液200μl加入50mm mes ph=6.0 800μl超声清洗,离心去上清。
[0104]
5)
①
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入8μg新型冠状病毒n抗体1,2-8℃过夜。
[0105]
②
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入4μg兔igg,2-8℃过夜。
[0106]
6)过夜后分别加入10μl10%bsa室温静置30min,离心去上清,分别使用200μl保存液悬浮,悬浮后1:1混合保存。备注:保存液使用30mm tris、0.1%pvp、4%蔗糖、0.1%bsa、0.3%casein-na、5/万proclin 300。
[0107]
7)取200μl 6)加入铺金液800μl,将其加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。
[0108]
对照工艺检测试纸的制备
[0109]
①
将3μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入20μg新型冠状病毒n抗体1,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
②
将7μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入15μg兔igg,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
③
将
①
和
②
混合后加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。)
[0110]
结果检测:采用本发明检测试和对照工艺检测试纸进行检测,结果见表4。
[0111]
表4结果对比表
[0112][0113]
注:n1-n10是10个阴性样本依次编号。阴性样本中用缓冲液代替样本。
[0114]
结论:从表4的结果可以看出,本案工艺在同等灵敏度的情况下,特异性要远高于对比工艺特异性。
[0115]
实施例5不同连接试剂的比较实验
[0116]
本发明检测试纸的制备:
[0117]
1)将5mm的r1、0.1%peg20000、0.02mm tcep的溶液20μl同2ml 4/万浓度的纳米金混合,37℃孵育150min;
[0118]
2)10000rpm 10min去上清,使用10mm pbs(ph=7.1-7.4)、1%bsa溶液超声悬浮后室温静置10min.
[0119]
3)10000rpm 10min去上清,使用400μl悬浮液超声悬浮后2-8℃保存待用。备注:悬浮液使用50mm mes ph=6.0、0.1%pvp、5/万proclin 300。
[0120]
4)取3)纳米金悬浮溶液200μl加入50mm mes ph=6.0 800μl超声清洗,离心去上清。
[0121]
5)
①
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入8μg新型冠状病毒n抗体1,2-8℃过夜。
[0122]
②
加入500μl 50mm mes ph=6.0的溶液悬浮,加入偶联活化剂,37℃活化30min或者2-8℃活化6h,离心去上清,加入500μl 50mm hepe(ph=7.5)超声悬浮后,加入4μg兔igg,2-8℃过夜。
[0123]
6)过夜后分别加入10μl10%bsa室温静置30min,离心去上清,分别使用200μl保存
液悬浮,悬浮后1:1混合保存。备注:保存液使用30mm tris、0.1%pvp、4%蔗糖、0.1%bsa、0.3%casein-na、5/万proclin 300。
[0124]
7)取200μl 6)加入铺金液800μl,将其加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。
[0125]
对照工艺检测试纸的制备:
[0126]
①
将3μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入20μg新型冠状病毒n抗体1,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
②
将7μl 0.2m k2co3加入到1ml 4/万浓度的纳米金混匀后加入15μg兔igg,反应30min左右,加入10μl 20%bsa 30min,离心去上清,加入0.5ml铺金液超声分散悬浮后保存待用;
③
将
①
和
②
混合后加入到17cm2的玻纤上,铺均匀后,放入37-45℃烘干箱中烘干4h以上,密封保存待用。)
[0127]
备注:r1试剂选择:
①
巯基乙酸;
②
巯基丙酸;
③
巯基丁酸;
④
2-巯基甲基戊二酸;
⑤
(r)-6,8-二巯基辛酸;
⑥
对照工艺。
[0128]
表5结果对比表
[0129]
样本编号
①②③④⑤⑥
低值质控
‑‑
++
±
+-中值质控
±±
+
±
++
±
+++高值质控+++
±
++
±
+++++
±
++
±
n1
‑‑‑‑‑‑
n2
‑‑‑‑‑‑
n3
‑‑‑‑±‑
n4
‑‑‑‑‑±
n5
‑‑‑‑‑‑
n6
‑‑‑‑‑‑
n7
‑‑±‑‑‑
n8
‑‑‑‑‑‑
n9
‑‑‑‑‑‑
n10
‑‑‑‑‑‑
[0130]
注:n1-n10是10个阴性样本依次编号。阴性样本中用缓冲液代替样本。
[0131]
结论:可以看出,采用本发明r1为2-巯基甲基戊二酸的工艺制备得到的检测试纸,其效果比r1为巯基乙酸;巯基丙酸;巯基丁酸,(r)-6,8-二巯基辛酸,及其对照工艺的检测试纸,其性能更具优势。
[0132]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1