一种氧化亚铜纳米酶在检测维生素C中的应用、检测维生素C含量的方法
一种氧化亚铜纳米酶在检测维生素c中的应用、检测维生素c含量的方法
技术领域
1.本发明涉及分析检测技术领域,尤其涉及一种氧化亚铜纳米酶在检测维生素c中的应用、检测维生素c含量的方法。
背景技术:
2.抗坏血酸,又被称为维生素c,是人类体内必需的一种水溶性维生素,在人和动物的日常生活中发挥着极其重要的作用。由于抗坏血酸不能自身合成,所以主要从水果、蔬菜等膳食中汲取。抗坏血酸有l-抗坏血酸和d-抗坏血酸这两种异构体,但仅l-抗坏血酸能发挥生理功效,并且能够进行氧化和还原的转变,即还原型的l-抗坏血酸以及氧化型的脱氢抗坏血酸。抗坏血酸是人体内不可或缺的重要物质,具有较强的还原性,能够参与体内的氧化还原以及各种羟化反应。抗坏血酸能够被当成自由基的清除剂,不但能够参与神经介质以及激素的生物合成,还能够维持骨骼、血管等的正常功能。抗坏血酸还能够有效的防止贫血、败血病等疾病,同时具有提高抵抗力的作用,能够降低心血管疾病的出现,还能促进外伤愈合。食品业常把抗坏血酸用作抗氧化剂、保鲜剂或护色剂等。缺乏抗坏血酸能导致牙龈出血、关节肿胀甚至癌症等疾病。病理过程中,血液里含有的抗坏血酸水平被当作重要指标。因此,快速、准确地检测人血清、食物、药物中抗坏血酸的含量非常有必要。
3.目前,抗坏血酸的检测方法主要为碘量法,采用碘量法时,由于碘易挥发、见光易分解且碘离子易氧化等特点,在每次检测样品之前,都需先用维生素c的标准溶液重新标定i2溶液的浓度,避免产生误差。此外,因维生素c在碱性条件下易被空气中的氧氧化,为确保维生素c尽可能不被氧化,应使其处于酸性条件下,且整个操作过程要迅速,防止还原型抗坏血酸被氧化。而且,由于i2见光易分解及配制i2溶液时未能将其完全溶解,会使i2溶液的浓度有所变化,测定样品溶液时必须同时作空白对照,从滴定值中扣除空白值,尽量减少滴定误差。因此,现有碘量法检测抗坏血酸存在灵敏度低、操作复杂和干扰因素多等问题。
技术实现要素:
4.本发明的目的在于提供一种氧化亚铜纳米酶在检测维生素c中的应用、检测维生素c含量的方法,能够高选择性、高灵敏度检测维生素c含量,且操作简便,无干扰。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种氧化亚铜纳米酶在检测维生素c中的应用。
7.优选的,所述氧化亚铜纳米酶的粒径为100nm。
8.本发明提供了一种利用氧化亚铜纳米酶检测维生素c含量的方法,包括以下步骤:
9.将待测样品、氧化亚铜纳米酶溶液和第一mes缓冲液混合,进行氧化反应,得到脱氢抗坏血酸产物;
10.将所述脱氢抗坏血酸产物、邻苯二胺溶液和第二mes缓冲液混合,进行加成反应,得到荧光产物;
11.将所述荧光产物进行荧光光谱检测,将所得荧光强度数据代入预定的线性方程中,得到待测样品中维生素c的含量,所述线性方程为以抗坏血酸浓度为横坐标、对应荧光强度为纵坐标线性拟合得到线性方程。
12.优选的,所述线性方程的线性范围为(0~4.5)
×
10-4
mol/l。
13.优选的,所述氧化亚铜纳米酶溶液的浓度为0.025~0.1mg/ml;所述第一mes缓冲液和第二mes缓冲液的ph为6.0,浓度独立为0.1~0.2mol/l;所述氧化亚铜纳米酶溶液和第一mes缓冲液的体积比为1:9。
14.优选的,所述氧化反应的温度为25~37℃,时间为5~10min。
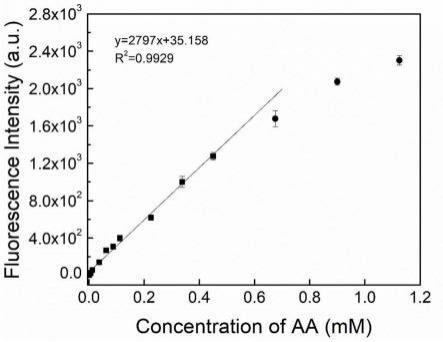
15.优选的,所述邻苯二胺溶液的浓度为2mmol/l;所述邻苯二胺溶液和氧化亚铜纳米酶溶液的体积比为10:1。
16.优选的,所述第二mes缓冲液和邻苯二胺溶液的体积比为5:1。
17.优选的,所述加成反应的温度为25~37℃,时间为10~20min。
18.优选的,所述荧光光谱检测的激发波长为350nm,最大发射波长为425nm。
19.本发明提供了一种氧化亚铜纳米酶在检测维生素c中的应用。本发明首次实现氧化亚铜纳米酶催化维生素c氧化,形成脱氢抗坏血酸(dhaa),便于后续利用dhaa与邻苯二胺(opda)反应生成荧光产物,从而实现维生素c含量的检测。
20.本发明提供了一种利用氧化亚铜纳米酶检测维生素c含量的方法,本发明首次将氧化亚铜纳米酶用于催化抗坏血酸,证明氧化亚铜纳米酶具有类抗坏血酸氧化酶活性,从而实现氧化亚铜纳米酶在温和条件下催化抗坏血酸形成dhaa,然后利用dhaa与opda反应生成荧光产物dfq(喹喔啉衍生物),便于利用荧光检测法实现维生素c的含量检测。与碘量法相比,本发明能够实现荧光法检测维生素c,因而具有高度的选择性和灵敏度,同时具有线性范围宽、检测限低和误差较小等优势,可以应用于实际产品中维生素c含量的测定,为食品工业生产中维生素c检测提供了新思路。
21.本发明的检测方法通过氧化亚铜纳米酶在温和条件下催化抗坏血酸形成dhaa,然后利用dhaa与opda反应生成荧光产物dfq(喹喔啉衍生物),从而利用荧光检测法实现维生素c的含量检测,采用荧光光谱仪进行测量,无需碘量法中滴定操作,可以简化操作,改善了碘量法的操作繁琐、干扰性大等弊端;同时避免了碘量法受溶液中各种还原性物质干扰的问题,本发明的方法对vc具有更高的特异性,准确性更高。
附图说明
22.图1为实施例1建立的标准曲线图;
23.图2为实施例1~2中采用氧化亚铜纳米酶体系(cne体系)和对比例1中碘量法对饮料中vc含量的检测结果(a)以及cne体系和碘量法对vc泡腾片中vc含量的检测结果(b);
24.图3为氧化亚铜纳米酶体系(cne体系)存在外来物质时在425nm的荧光强度比较图。
具体实施方式
25.本发明提供了一种氧化亚铜纳米酶在检测维生素c中的应用。
26.在本发明中,所述氧化亚铜纳米酶即为氧化亚铜纳米粒子,所述氧化亚铜纳米酶
的粒径优选为100nm。本发明对所述氧化亚铜纳米酶(cne)的来源没有特殊的限定,本领域熟知的市售商品均可。
27.本发明提供了一种利用氧化亚铜纳米酶检测维生素c含量的方法,包括以下步骤:
28.将待测样品、氧化亚铜纳米酶溶液和第一mes缓冲液混合,进行氧化反应,得到脱氢抗坏血酸产物;
29.将所述脱氢抗坏血酸产物、邻苯二胺溶液和第二mes缓冲液混合,进行加成反应,得到荧光产物;
30.将所述荧光产物进行荧光光谱检测,将所得荧光强度数据代入预定的线性方程中,得到待测样品中维生素c的含量,所述线性方程为以抗坏血酸浓度为横坐标、对应荧光强度为纵坐标线性拟合得到线性方程。
31.在本发明中,若无特殊说明,所需原料或试剂均为本领域技术人员熟知的市售商品。
32.本发明将待测样品、氧化亚铜纳米酶溶液和第一mes缓冲液混合,进行氧化反应,得到脱氢抗坏血酸产物。
33.本发明对所述待测样品的种类没有特殊的限定,本领域熟知的含有维生素c的样品均可。在本发明的实施例中,所述待测样品具体为水溶c100、尖叫运动饮料、美年达、纯悦矿泉水和nfc橙汁。
34.在本发明中,所述待测样品以溶液的形式使用,所述待测样品的溶液中溶质的总浓度优选为0.2mg/ml,所述待测样品的溶液与氧化亚铜纳米酶溶液的体积比优选为10:1。
35.在本发明中,所述氧化亚铜纳米酶溶液的浓度优选为0.025~0.1mg/ml,更优选为0.05mg/ml。
36.在本发明中,所述第一mes缓冲液的ph优选为6.0,浓度独立优选为0.1~0.2mol/l,更优选为0.2mol/l;所述氧化亚铜纳米酶溶液和第一mes缓冲液的体积比优选为1:9。本发明对所述第一mes缓冲液的组成和来源没有特殊的限定,本领域熟知的满足上述条件的市售商品即可。
37.本发明对所述含维生素c待测样品溶液、氧化亚铜纳米酶溶液和第一mes缓冲液混合的过程没有特殊的限定,按照本领域熟知的过程将物料混合均匀即可。
38.在本发明中,所述氧化反应的温度优选为25~37℃,时间优选为5~10min;在所述氧化反应过程中,氧化亚铜纳米酶(cne)具有类抗坏血酸氧化酶活性,催化抗坏血酸形成脱氢抗坏血酸(dhaa)。
39.完成所述氧化反应后,本发明优选不进行其他处理,直接将所得产物溶液进行后续反应。
40.得到脱氢抗坏血酸产物后,本发明将所述脱氢抗坏血酸产物、邻苯二胺溶液和第二mes缓冲液混合,进行加成反应,得到荧光产物。
41.在本发明中,所述第二mes缓冲液的ph优选为6.0,浓度优选为0.1~0.2mmol/lol/l,更优选为200mmol/l;本发明对所述第二mes缓冲液的组成和来源没有特殊的限定,本领域熟知的满足上述条件的市售商品即可。
42.在本发明中,所述邻苯二胺溶液的浓度优选为2mmol/l;所述邻苯二胺溶液和氧化亚铜纳米酶溶液的体积比优选为10:1;所述第二mes缓冲液和邻苯二胺溶液的体积比优选
为5:1。
43.本发明对所述脱氢抗坏血酸产物、邻苯二胺溶液和第二mes缓冲液混合的过程没有特殊的限定,按照本领域熟知的过程将物料混合均匀即可。
44.在本发明中,所述加成反应的温度优选为25~37℃,时间优选为10~20min;在所述加成反应过程中,脱氢抗坏血酸(dhaa)与邻苯二胺(opda)反应生成荧光产物dfq(喹喔啉衍生物)。
45.在本发明中,所述氧化反应和加成反应的反应过程为:
[0046][0047]
得到荧光产物后,本发明将所述荧光产物进行荧光光谱检测,将所得荧光强度数据代入预定的线性方程中,得到待测样品中维生素c的含量,所述线性方程为以抗坏血酸浓度为横坐标、对应荧光强度为纵坐标线性拟合得到线性方程。
[0048]
在本发明中,所述荧光光谱检测的激发波长优选为350nm,最大发射波长优选为425nm;本发明对所述荧光光谱检测的具体过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0049]
本发明对所述建立线性方程的过程没有特殊的限定,按照本领域熟知的过程进行即可。在本发明的实施例中,所述线性方程的建立过程具体为:将500μl不同浓度的维生素c溶液(0,1.2μm,6.25μm,12.5μm,37.5μm,62.5μm,87.5μm,112.5μm,225μm,337.5μm,450μm,675μm,900μm,1125μm)和cne(氧化亚铜纳米酶)溶液(0.05mg/ml,50μl)加入到mes缓冲液(ph 6.0,200mmol/l,450μl)中,混合均匀,在37℃条件下反应5min后,加入2.5mlmes缓冲液和邻苯二胺溶液(2mmol/l,500μl),混合均匀,在37℃条件下,反应20min,得到产物溶液;利用荧光光谱仪将激发波长设置为350nm,最大发射波长设置为425nm,观察并记录产物溶液的荧光光谱,利用425nm的荧光强度,以维生素c浓度为横坐标,荧光强度为纵坐标建立标准曲线。
[0050]
在本发明中,所提及的含维生素c待测样品溶液、维生素c溶液、mes缓冲液和邻苯二胺溶液所用溶剂均优选为超纯水。本发明对所述含维生素c待测样品溶液、维生素c溶液、mes缓冲液和邻苯二胺溶液的配制过程没有特殊的限定,按照本领域熟知的过程获得所需浓度的溶液即可。
[0051]
本发明对将所得荧光强度数据代入所述线性方程计算维生素c含量的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0052]
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0053]
实施例1
[0054]
将500μl不同浓度的抗坏血酸水溶液(0,1.2μm,6.25μm,12.5μm,37.5μm,62.5μm,87.5μm,112.5μm,225μm,337.5μm,450μm,675μm,900μm,1125μm)和cne水溶液(0.05mg/ml,
50μl)加入到mes缓冲液(ph 6,200mmol/l,450μl)中,混合均匀,在37℃条件下反应5min之后,加入2.5ml mes缓冲液和邻苯二胺水溶液(2mmol/l,500μl),混合均匀,在37℃的条件下,反应20min,得到产物溶液;利用荧光光谱仪将激发波长设置为350nm,最大发射波长设置为425nm,观察并记录反应溶液的荧光光谱,利用425nm的荧光强度,以维生素c浓度为横坐标,荧光强度为纵坐标建立标准曲线,得到线性方程;所得标准曲线如图1所示,线性方程为y=22380.59x+35.153;
[0055]
待测样品:含有vc的饮料:水溶c100、尖叫运动饮料(scream)、美年达(mirinda)、纯悦矿泉水(chunyue)和nfc橙汁,哇哈哈纯净水(water)作为对照;
[0056]
将不同饮料稀释至溶质的总浓度为0.2mg/ml,向500μl饮料样品溶液中加入氧化亚铜纳米酶水溶液(0.05mg/ml,50μl),加入到mes缓冲液(ph6,200mmol/l,450μl)中,混合均匀,在37℃条件下反应5min后,加入2.5mlmes缓冲液和邻苯二胺水溶液(2mmol/l,500μl),混合均匀,在37℃条件下,反应20min,得到反应产物溶液;
[0057]
将荧光光谱仪将激发波长设置为350nm,最大发射波长设置为425nm,观察并记录反应产物溶液的荧光光谱,检测425nm处的荧光强度,将所得荧光强度代入上述线性方程,计算得到不同待测样品中维生素c的含量。
[0058]
图1的结果表明,抗坏血酸浓度在0~4.5
×
10-4
mol/l范围内展现出良好的线性关系,说明线性范围宽,并且检测上限为4.5
×
10-4
mol/l,通过信噪比3倍原则计算得到检测下限为3.2
×
10-6
mol/l,说明该方法检测限很低,rsd为1.1%,说明该方法误差较小。
[0059]
实施例2
[0060]
将vc泡腾片溶于水后,稀释至溶质的总浓度为0.2mg/ml,向500μl所得vc泡腾片溶液中加入cne水溶液(0.05mg/ml,50μl),加入到mes缓冲液(ph 6,200mmol/l,450μl)中,混合均匀,在37℃条件下反应5min后,加入2.5ml mes缓冲液和邻苯二胺水溶液(2mmol/l,500μl),混合均匀,在37℃条件下,反应20min,得到产物溶液;利用荧光光谱仪将激发波长设置为350nm,最大发射波长设置为425nm,观察并记录产物溶液的荧光光谱,测试425nm处的荧光强度,根据实施例1获得的标准曲线计算vc泡腾片中的vc含量。
[0061]
对比例1
[0062]
碘量法(lodometry)检测不同饮料以及vc泡腾片中维生素c含量,哇哈哈纯净水(water)作为对照:
[0063]
淀粉指示液(ρ=5g/l)的配制:将0.5g可溶性淀粉与5ml超纯水混合搅拌,使其变为糊状,倒入95ml沸水里,进行煮沸,反应2min,待其降至室温之后取上清液;利用蒸馏水对烧杯反复冲洗三次,放入1滴10wt%的盐酸进行微沸反应3min;
[0064]
取0.2g不同的饮料样品放入碘量瓶内,放入100ml煮沸过的冷水,添加乙酸溶液进行混合,待样品溶解,放入刚配制的淀粉指示溶液1ml,然后用碘标准滴定溶液滴定,滴定到溶液呈蓝色,并且颜色保持不变。同时做空白试验,不放入饮料样品,其余的步骤不变。读取并记录消耗的碘标准溶液的体积,对样品中vc的含量进行计算,计算公式见式1:
[0065]
[0066]
式1中,ω1代表vc(以c6h8o6计)的质量分数,数值以%表示;v代表样品消耗碘标准滴定溶液的体积数值,单位为毫升(ml);v0代表空白试验消耗的碘标准滴定溶液的体积数值,单位为毫升(ml);c代表碘标准溶液浓度的准确数值,单位为摩尔每升(mol/l);m代表试样质量,单位为克(g);0.08806代表每1ml的1mol/l的碘标准溶液相当于0.08806g的vc。
[0067]
检测结果比较
[0068]
图2为实施例1~2中采用氧化亚铜纳米酶体系(cne体系)和对比例1中碘量法对不同饮料中vc含量的检测结果(a)以及cne体系和碘量法对vc泡腾片中vc含量的检测结果(b),图2对应的抗坏血酸含量数据见表1和表2。
[0069]
表1 cne体系和碘量法(lodometry)检测不同饮料中的vc含量比较
[0070][0071]
表2 cne体系和碘量法检测vc泡腾片中的vc含量比较
[0072][0073]
由表1~2可知,与碘量法相比,利用本发明的cne体系能够便捷快速地完成vc检测;而且,采用cne体系检测得到的维生素c含量与用碘量法的结果一致,证明本发明检测方法的可靠性。
[0074]
方法特异性检测
[0075]
选取葡萄糖、蔗糖、麦芽糖、柠檬酸、果糖、半胱氨酸、谷胱甘肽、尿酸与vc进行特异性检测,将葡萄糖、蔗糖、麦芽糖、柠檬酸、果糖、半胱氨酸、谷胱甘肽、尿酸与维生素c溶于水,使得混合液中葡萄糖、蔗糖、麦芽糖、柠檬酸、果糖、半胱氨酸、谷胱甘肽、尿酸的浓度均为0.125mmol/l,vc的浓度为1.25mmol/l;将所得混合液作为待测样品溶液,按照实施例1的方法进行测定,并采用实施例1的标准曲线进行vc含量测试,所得结果见图3。
[0076]
图3为氧化亚铜纳米酶体系(cne体系)存在外来物质时在425nm的荧光强度比较图,(1)半胱氨酸(2)谷胱甘肽(3)葡萄糖(4)蔗糖(5)麦芽糖(6)果糖(7)柠檬酸(8)尿酸(9)vc(1~8:0.125mmol/l;9:1.25mmol/l)。由图3可知,虽然vc(1.25mmol/l)比葡萄糖、蔗糖、麦芽糖、柠檬酸、果糖、半胱氨酸、谷胱甘肽和尿酸的浓度(0.125mmol/l)高10倍,但这些化合物信号非常低,而能够看到vc有非常明显信号,表明常见的干扰物质不能影响cne体系对维生素c含量的检测。
[0077]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人
员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1