一种酶修饰电化学电极及其制备方法与超薄镀酶装置
1.本发明属于技术领域,涉及一种酶修饰电化学电极,尤其涉及一种酶修饰电化学电极及其制备方法与超薄镀酶装置。
背景技术:
2.酶基电化学电极是当前生命科学研究中针对电化学惰性物质进行检测分析的重要工具。借助在电极表面修饰的特异性酶涂层,可催化惰性底物产生具有电化学活性的产物,具有电化学活性的产物可作为报告分子在酶基电化学电极表面发生电化学反应并产生信号,从而获得与惰性底物相关的浓度变化信息。
3.传统酶基电化学电极的酶涂层修饰方法是将生物酶与交联剂均匀混合后通过浸润等方式涂覆至电极表面。首先,这一方法对使用者的操作能力要求较低,但酶的消耗量较大导致电极的制作成本较高,尤其是针对如谷氨酸氧化酶等单价本已较高的酶而言。其次,常用的交联剂材料(如戊二醛等)对生物酶具有一定毒性,在修饰过程中往往会影响酶分子的活性,影响电极的敏感性。另外,传统的酶涂层修饰方法耗时较长,为了将生物酶稳固的修饰于电极表面,需要反复地把电极浸入含酶液滴中,直到电极表面的可见酶涂层不会在因浸入含酶液滴时溶解为止,通常需要重复20次以上,一个电极的修饰耗时通常在5~15分钟。另外,在传统的酶涂层修饰实际操作中,随着操作时间变长,含有生物酶和交联剂的液滴的粘稠度不断增大,导致涂覆于电极表面的酶量不可控,难以实现电化学电极底物敏感化的均一性,影响电极的品控。最后,基于传统的酶涂层修饰方式,在电化学电极表面形成的酶涂层厚度通常在2μm以上,2μm以上的厚度一方面限制了此类酶基电极在微观至纳观水平记录场景下的应用,另一方面,较厚的酶涂层也导致电极对底物的检测响应较慢。
4.cn101196487a公开了一种电沉积壳聚糖-离子液体-酶复合膜制备修饰电极的方法,制备修饰时将电极作为阴极置入含壳聚糖、离子液体和酶的酸性溶液中,通电进行电沉积,壳聚糖、离子液体和酶附着在阴电极表面,得到修饰电极。但是,该电沉积壳聚糖-离子液体-酶复合膜制备修饰电极的方法制备的厚度较大,限制了修饰电极在微观至纳观水平记录场景下的应用,且对惰性底物的检测响应较慢。
5.cn111172571a公开了一种电沉积制备有机-无机杂化纳米花的方法,涉及酶固定化技术领域。本发明将稀土硝酸盐水溶液与生物酶和硝酸盐混合,得到混合液;所述稀土硝酸盐中的稀土离子为la、ce、pr、nd、sm、eu、gd、tb、dy、ho、er、yb和y离子中的一种或几种;所述生物酶为α-淀粉酶、辣根过氧化物酶或漆酶;然后采用三电极体系对所得混合液进行电沉积,在工作电极表面沉积得到电沉积薄膜;再将电沉积薄膜依次进行洗涤和干燥,得到有机-无机杂化纳米花。但是,该电沉积制备有机-无机杂化纳米花的方法采用较为复杂的三电极体系,操作过程较为复杂。
6.cn102175736a公开了一种检测杂色曲霉素的酶电极及其制备方法,以及以其为基底电极固定黄曲霉毒素氧化酶组装的用于检测杂色曲霉素的生物传感器。在金电极表面先自组装上l-半胱氨酸功能膜,再插入到杂合普鲁士蓝电沉积工作液中,采用恒电位法即可
制备普鲁士蓝杂合电极。采用碳纳米管作为电子传递体,将其均匀分散在壳聚糖溶液中,作为包埋黄曲霉毒素氧化酶的载体,再将壳聚糖-黄曲霉毒素氧化酶-碳纳米管混合膜组装到杂合普鲁士蓝修饰电极表面,就制成了用于检测杂色曲霉素的生物传感器。但是,该检测杂色曲霉素的酶电极的制备方法复杂且制造成本较高,不适宜大规模推广使用。
7.目前公开的酶修饰电化学电极及其制备方法都有一定的缺陷,存在着制备成本较高、操作时间较长、基体电极表面的酶含量不可控、对惰性底物的相应较慢、难以在微米及纳米级的场景下应用。因此,开发设计一种新型的酶修饰电化学电极及其制备方法与超薄镀酶装置至关重要。
技术实现要素:
8.针对现有技术存在的不足,本发明的目的在于提供一种酶修饰电化学电极及其制备方法与超薄镀酶装置,本发明所述酶修饰电化学电极的酶耗量较低,生产成本较低,利于大规模推广使用;所述酶修饰电化学电极的酶镀层厚度为纳米级,对底物的响应快,响应延迟时间为微秒级;所述酶修饰电化学电极的酶镀层对基体电极的尺寸改变很小,有利于酶修饰电化学电极在微米级与纳米级场景下的使用;所述酶修饰电化学电极的寿命较长且易保存。
9.为达此目的,本发明采用以下技术方案:
10.第一方面,本发明提供了一种酶修饰电化学电极,所述酶修饰电化学电极包括基体电极及基体电极表面的酶镀层;
11.所述酶镀层的厚度为10nm~300nm,所述酶修饰电化学电极对惰性底物的检测范围为0.01μmol/l~50mmol/l。
12.本发明限定了酶镀层的厚度为10nm~300nm,例如可以是10nm、20nm、30nm、50nm、80nm、100nm、120nm、150nm、200nm或300nm,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
13.本发明限定了酶修饰电化学电极对惰性底物的检测范围为0.01μmol/l~50mmol/l,例如可以是0.1μmol/l、0.2μmol/l、0.5μmol/l、1μmol/l、5μmol/l、10μmol/l、20μmol/l、50μmol/l、80μmol/l、0.1mmol/l、0.2mmol/l、0.3mmol/l、0.4mmol/l、0.5mmol/l、0.6mmol/l、0.7mmol/l、0.8mmol/l、0.9mmol/l、1mmol/l、1.2mmol/l、1.5mmol/l、1.7mmol/l、2mmol/l、3mmol/l、5mmol/l、7mmol/l、10mmol/l、12mmol/l、15mmol/l、17mmol/l、20mmol/l、22mmol/l、25mmol/l、30mmol/l、35mmol/l、40mmol/l、45mmol/l或50mmol/l,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
14.本发明所述惰性底物包括谷氨酸、葡萄糖、乙醇、天门冬氨酸、丙酮酸、赖氨酸、乳酸或乙酰胆碱中的任意一种或至少两种的组合,典型但非限制性的组合包括谷氨酸与葡萄糖的组合,乙醇与天门冬氨酸的组合,天门冬氨酸与丙酮酸的组合,丙酮酸与赖氨酸的组合,乳酸与乙酰胆碱的组合,葡萄糖与乳酸的组合,乳酸与乙酰胆碱的组合,谷氨酸、葡萄糖与乳酸的组合,或谷氨酸、葡萄糖、乳酸与乙酰胆碱的组合。
15.本发明所述酶修饰电化学电极的酶耗量较低,生产成本较低,利于大规模推广使用;所述酶修饰电化学电极的酶镀层厚度为纳米级,对底物的响应快,响应延迟时间为微秒级;所述酶修饰电化学电极的酶镀层对基体电极的尺寸改变很小,有利于酶修饰电化学电
极在微米级与纳米级场景下的使用;所述酶修饰电化学电极的寿命较长且易保存。
16.作为本发明一种优选的技术方案,所述酶镀层的厚度为100nm~300nm,例如可以是100nm、110nm、120nm、130nm、140nm、150nm、160nm、170nm、180nm、190nm、200nm、220nm、240nm、260nm、280nm或300nm,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
17.优选地,所述酶修饰电化学电极对惰性底物的检测范围为0.01μmol/l~100μmol/l,例如可以是0.01μmol/l、0.02μmol/l、0.05μmol/l、0.1μmol/l、0.5μmol/l、0.1μmol/l、0.5μmol/l、10μmol/l、15μmol/l、20μmol/l、30μmol/l、40μmol/l、50μmol/l、60μmol/l、70μmol/l、80μmol/l、90μmol/l或100μmol/l,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
18.第二方面,本发明提供了一种如第一方面所述酶修饰电化学电极的制备方法,所述制备方法包括:
19.以基体电极为工作电极,与辅助电极构成二电极体系,在含酶溶液中进行电沉积,得到酶修饰电化学电极。
20.本发明采用电镀的方法替代了涂覆操作,所述酶修饰电化学电极的制备方法的操作简单,无需进行反复涂覆操作,减少了操作时间,电极表面修饰的酶量可控且制备过程中的耗酶量较低。
21.作为本发明一种优选的技术方案,所述基体电极包括铂电极、金电极、铂的合金电极、金的合金电极或玻碳电极中的任意一种或至少两种的组合,典型但非限制性的组合包括铂电极与金电极的组合,金电极与铂的合金电极的组合,铂的合金电极与金的合金电极的组合,金电极与玻碳电极的组合,铂电极与玻碳电极的组合,或铂电极、金电极与玻碳电极的组合。
22.优选地,所述辅助电极的材质包括铂、金或银中的任意一种或至少两种的组合,典型但非限制性的组合包括铂与金的组合,金与银的组合,铂与银的组合。
23.作为本发明一种优选的技术方案,所述含酶溶液由酶溶液与壳聚糖溶液混合得到。
24.本技术中壳聚糖溶液会影响酶修饰电化学电极对惰性底物的响应时间及酶镀层与基体电极之间的结合力,这是由于壳聚糖是一种碱性多糖,其结构中含有较多的游离氨基,使其具有较好的生物相容性和生物安全性,因此对酶分子的催化性能具有较好的保护效果;壳聚糖与酶分子在电极表面所形成的聚合产物厚度较薄,但其质地均匀、表面平滑且无明显空隙,适于酶促反应的快速、稳定地进行。
25.优选地,所述酶溶液的溶质包括谷氨酸氧化酶、葡萄糖氧化酶、乳酸氧化酶或乙酰胆碱酶中的任意一种或至少两种的组合,典型但非限制性的组合包括谷氨酸氧化酶与葡萄糖氧化酶的组合,葡萄糖氧化酶与乳酸氧化酶的组合,乳酸氧化酶与乙酰胆碱酶的组合,谷氨酸氧化酶、葡萄糖氧化酶与乳酸氧化酶的组合,或谷氨酸氧化酶、葡萄糖氧化酶、乳酸氧化酶与乙酰胆碱酶的组合。
26.优选地,所述酶溶液与壳聚糖溶液的体积比为(0.8~1.2):1,例如可以是0.8:1、0.85:1、0.9:1、0.95:1、1:1、1.05:1、1.1:1、1.15:1或1.2:1,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
27.本技术中酶溶液与壳聚糖溶液的体积比会影响酶修饰电化学电极对惰性底物的响应时间及酶镀层与基体电极之间的结合力;当酶溶液与壳聚糖溶液的体积比偏低时,会导致响应时间变长,结合力增强,这是由于酶分子占比较低减弱了酶反应效率,而壳聚糖占比较高增强了修饰层与电极表面的结合;当酶溶液与壳聚糖溶液的体积比偏高时,会导致响应时间变短,结合力减弱,这是由于酶分子占比较高增强了酶反应效率,而壳聚糖占比较低减弱了修饰层与电极表面的结合。
28.优选地,所述酶溶液的浓度为10unit/ml~500unit/ml,例如可以是10unit/ml、20unit/ml、30unit/ml、50unit/ml、70unit/ml、100unit/ml、120unit/ml、150unit/ml、170unit/ml、200unit/ml、250unit/ml、300unit/ml、350unit/ml、400unit/ml、450unit/ml或500unit/ml,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
29.优选地,所述壳聚糖溶液的质量浓度为0.5%w/v~2.0%w/v,例如可以是0.5%w/v、0.6%w/v、0.7%w/v、0.8%w/v、0.9%w/v、1%w/v、1.1%w/v、1.2%w/v、1.3%w/v、1.4%w/v、1.5%w/v、1.6%w/v、1.7%w/v、1.8%w/v、1.9%w/v或2%w/v,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
30.优选地,所述壳聚糖溶液的ph为5.0~6.0,例如可以是5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9或6.0,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
31.作为本发明一种优选的技术方案,所述电沉积为恒电位电沉积,所述恒电位电沉积的电位为-0.18v~-0.13v,例如可以是-0.18v、-0.17v、-0.16v、-0.15v、-0.14v或-0.13v,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
32.优选地,所述工作电极浸泡在含酶溶液中的面积为40μm~800000μm2,例如可以是40μm2、50μm2、60μm2、70μm2、80μm2、100μm2、200μm2、500μm2、1000μm2、2000μm2、5000μm2、7000μm2、10000μm2、20000μm2、30000μm2、40000μm2、50000μm2、60000μm2、70000μm2、80000μm2、100000μm2、300000μm2或800000μm2,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
33.优选地,所述电沉积的时间为10s~500s,例如可以是10s、11s、12s、15s、18s、20s、25s、28s、30s、35s、40s、50s、80s、100s、150s、200s、250s、300s、350s、400s、450s或500s,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
34.作为本发明一种优选的技术方案,示例性地,所述制备方法包括:
35.以基体电极为工作电极,与辅助电极构成二电极体系,在浓度为10unit/ml~500unit/ml的酶溶液与浓度为0.5%w/v~2.0%w/v、ph为5.0~6.0的壳聚糖溶液的混合溶液中进行恒电位电沉积,得到酶修饰电化学电极;
36.酶溶液与壳聚糖溶液的体积比为(0.8~1.2):1,工作电极浸泡在混合溶液中的面积为40μm2~80000μm2,恒电位电沉积的电位为-0.18v~-0.13v,时间为10s~500s。
37.第三方面,本发明提供了一种基于第二方面所述制备方法的超薄镀酶装置,所述超薄镀酶装置包括镀酶池及与镀酶池活动连接的镀酶池控制件;
38.所述镀酶池控制件控制镀酶池在三维方向上移动。
39.本发明所述镀酶池控制件控制镀酶池移动的精度为3μm~10μm,例如可以是3μm、4μm、5μm、6μm、7μm、8μm、9μm或10μm,但并不仅限于所列举的数值,该数值范围内其他未列举
的数值同样适用。
40.作为本发明一种优选的技术方案,所述镀酶池包括保护壳,所述保护壳内设置有辅助电极槽,所述辅助电极槽内设置有含酶溶液,所述辅助电极槽上连接有辅助电极连接线。
41.本发明所述保护壳的材质包括绝缘材料,例如可以是聚丙烯塑料,但并不仅限于聚丙烯塑料,其他未列举的绝缘材料同样适用。
42.本发明所述辅助电极连接线包括表面覆盖有绝缘层的金属导线,例如可以是覆盖有绝缘层的铜单线,但并不仅限于铜导线,其他未列举的金属导线同样适用。
43.优选地,所述辅助电极槽的材质包括铂、金或银中的任意一种或至少两种的组合,例如可以是铂与金的组合,金与银的组合,或铂、金与银的组合。
44.作为本发明一种优选的技术方案,所述超薄镀酶装置还包括底板,所述镀酶池控制件固定设置于底板上。
45.优选地,所述底板包括磁性金属板。
46.本发明所述磁性金属板能够吸附在基台上,便于电沉积的进行及电沉积之后超薄镀酶装置的拆卸。
47.作为本发明一种优选的技术方案,所述底板上还设置有工作电极控制件,工作电极的一端固定设置于工作电极控制件上,另一端置于镀酶池内;所述工作电极控制件控制工作电极在三维方向上移动。
48.本发明所述工作电极控制件包括工作电极固定槽,工作电极的一端固定于工作电极固定槽内。
49.本发明所述工作电极控制件同时控制1~10个工作电极,例如可以是1个、1个、2个、3个、4个、5个、6个、7个、8个、9个或10个,但并不仅限于所列举的数值,该数值范围内其他未列举的数值同样适用。
50.优选地,所述工作电极控制件的材质包括海绵、橡胶或泡沫塑料中的任意一种或至少两种的组合,典型但非限制性的组合海绵与橡胶的组合,橡胶与泡沫塑料的组合,或海绵、橡胶与泡沫塑料的组合。
51.相对于现有技术,本发明具有以下有益效果:
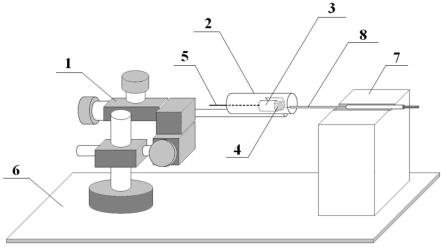
52.(1)本发明所述酶修饰电化学电极的酶耗量较低,生产成本较低,利于大规模推广使用;
53.(2)本发明所述酶修饰电化学电极的酶镀层厚度为纳米级,对底物的响应快,响应延迟时间为微秒级;
54.(3)本发明所述酶修饰电化学电极的酶镀层对基体电极的尺寸改变很小,有利于酶修饰电化学电极在微米级与纳米级场景下的使用;
55.(4)本发明所述酶修饰电化学电极的寿命较长且易保存;
56.(5)本发明采用电镀的方法替代了涂覆操作,所述酶修饰电化学电极的制备方法的操作简单,无需进行反复涂覆操作,减少了操作时间,电极表面修饰的酶量可控。
附图说明
57.图1为本发明一个具体实施方式提供的超薄镀酶装置的结构示意图。
58.其中,1-镀酶池控制件;2-保护壳;3-辅助电极槽;4-含酶溶液;5-辅助电极连接线;6-底板;7-工作电极固定槽;8-工作电极。
具体实施方式
59.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
60.在一个具体实施方式中,如图1所示,本发明提供了一种超薄镀酶装置,所述超薄镀酶装置包括镀酶池及与镀酶池活动连接的镀酶池控制件1;
61.所述镀酶池控制件1控制镀酶池在三维方向上移动。
62.本发明所述镀酶池控制件1控制镀酶池移动的精度为3μm~10μm。
63.进一步地,所述镀酶池包括保护壳2,所述保护壳2内设置有辅助电极槽3,所述辅助电极槽3内设置有含酶溶液4,所述辅助电极槽3上连接有辅助电极连接线5。
64.本发明所述保护壳2的材质包括绝缘材料,例如可以是聚丙烯塑料,但并不仅限于聚丙烯塑料,其他未列举的绝缘材料同样适用。
65.本发明所述辅助电极连接线5包括表面覆盖有绝缘层的金属导线,例如可以是覆盖有绝缘层的铜单线,但并不仅限于铜导线,其他未列举的金属导线同样适用。
66.进一步地,所述辅助电极槽3的材质包括铂、金或银中的任意一种或至少两种的组合。
67.进一步地,所述超薄镀酶装置还包括底板6,所述镀酶池控制件1固定设置于底板6上。
68.进一步地,所述底板6包括磁性金属板。
69.本发明所述磁性金属板能够吸附在基台上,便于电沉积的进行及电沉积之后超薄镀酶装置的拆卸。
70.进一步地,所述底板6上还设置有工作电极控制件,工作电极8的一端固定设置于工作电极控制件上,另一端置于镀酶池内;所述工作电极控制件控制工作电极8在三维方向上移动。
71.本发明所述工作电极控制件包括工作电极固定槽7,工作电极8的一端固定于工作电极固定槽7内。
72.本发明所述工作电极控制件同时控制1~10个工作电极8。
73.进一步地,所述工作电极控制件的材质包括海绵、橡胶或泡沫塑料中的任意一种或至少两种的组合。
74.实施例1
75.本实施例提供了一种谷氨酸氧化酶修饰电化学电极,所述谷氨酸氧化酶修饰电化学电极包括铂电极及铂电极表面的谷氨酸氧化酶镀层;
76.所述谷氨酸氧化酶镀层的厚度为300nm,所述谷氨酸氧化酶修饰电化学电极对谷氨酸的检测范围为0.01μmol/l~100μmol/l。
77.本实施例提供了所述谷氨酸氧化酶修饰电化学电极的制备方法,所述制备方法包括:
78.以铂电极为工作电极,与铂辅助电极构成二电极体系,在浓度为33unit/ml的谷氨
酸氧化酶溶液与质量浓度为1%w/v、ph为5.5的壳聚糖溶液的混合溶液中进行恒电位电沉积,得到谷氨酸氧化酶修饰电化学电极;
79.谷氨酸氧化酶溶液与壳聚糖溶液的体积比为0.9:1,铂电极浸泡在混合溶液中的面积为40μm2,恒电位电沉积的电位为-0.15v,时间为500s。
80.实施例2
81.本实施例提供了一种葡萄糖氧化酶修饰电化学电极,所述葡萄糖氧化酶修饰电化学电极包括铂电极及铂电极表面的葡萄糖氧化酶镀层;
82.所述葡萄糖氧化酶镀层的厚度为80nm,所述葡萄糖氧化酶修饰电化学电极对惰性底物的检测范围为1mmol/l~25mmol/l。
83.本实施例提供了所述葡萄糖氧化酶修饰电化学电极的制备方法,所述制备方法包括:
84.以铂电极为工作电极,与铂辅助电极构成二电极体系,在浓度为100unit/ml的葡萄糖氧化酶溶液与质量浓度为0.8%w/v、ph为5.2的壳聚糖溶液的混合溶液中进行恒电位电沉积,得到葡萄糖氧化酶修饰电化学电极;
85.葡萄糖氧化酶溶液与壳聚糖溶液的体积比为1.1:1,铂电极浸泡在混合溶液中的面积为200μm2,恒电位电沉积的电位为-0.16v,时间为50s。
86.实施例3
87.本实施例提供了一种乳酸氧化酶修饰电化学电极,所述乳酸氧化酶修饰电化学电极包括玻碳电极及玻碳电极表面的乳酸氧化酶镀层;
88.所述乳酸氧化酶镀层的厚度为100nm,所述乳酸氧化酶修饰电化学电极对惰性底物的检测范围为10μmol/l~10mmol/l。
89.本实施例提供了所述乳酸氧化酶修饰电化学电极的制备方法,所述制备方法包括:
90.以玻碳电极为工作电极,与金辅助电极构成二电极体系,在浓度为100unit/ml的乳酸氧化酶溶液与质量浓度为1.2%w/v、ph为5.7的壳聚糖溶液的混合溶液中进行恒电位电沉积,得到酶修饰电化学电极;
91.乳酸氧化酶溶液与壳聚糖溶液的体积比为1:1,玻碳电极浸泡在混合溶液中的面积为800000μm2,恒电位电沉积的电位为-0.13v,时间为100s。
92.实施例4
93.本实施例提供了一种谷氨酸氧化酶修饰电化学电极,所述谷氨酸氧化酶修饰电化学电极包括金电极及金电极表面的谷氨酸氧化酶镀层;
94.所述谷氨酸氧化酶镀层的厚度为10nm,所述谷氨酸氧化酶修饰电化学电极对惰性底物的检测范围为1mmol/l~50mmol/l。
95.本实施例提供了所述谷氨酸氧化酶修饰电化学电极的制备方法,所述制备方法包括:
96.以金电极为工作电极,与铂辅助电极构成二电极体系,在浓度为10unit/ml的谷氨酸氧化酶溶液与浓度为2%w/v、ph为6.0的壳聚糖溶液的混合溶液中进行恒电位电沉积,得到酶修饰电化学电极;
97.谷氨酸氧化酶溶液与壳聚糖溶液的体积比为1.2:1,金电极浸泡在混合溶液中的
面积为200μm2,恒电位电沉积的电位为-0.18v,时间为10s。
98.实施例5
99.本实施例提供了一种谷氨酸氧化酶修饰电化学电极的制备方法,除将壳聚糖溶液替换为同等体积的谷氨酸氧化酶溶液外,其余均与实施例1相同。
100.实施例6
101.本实施例提供了一种谷氨酸氧化酶修饰电化学电极的制备方法,除谷氨酸氧化酶溶液与壳聚糖溶液的体积比为0.6:1外,其余均与实施例1相同。
102.实施例7
103.本实施例提供了一种谷氨酸氧化酶修饰电化学电极,除谷氨酸氧化酶溶液与壳聚糖溶液的体积比为1.4:1外,其余均与实施例1相同。
104.对实施例1与实施例4~7中谷氨酸氧化酶修饰电化学电极对2μmol/l谷氨酸进行响应时间的测试,对实施例2中葡萄糖氧化酶修饰电化学电极对1mmol/l葡萄糖进行响应时间的测试,对实施例3中乳酸氧化酶修饰电化学电极对1mmol/l乳酸进行响应时间的测试,响应时间的测试方法为:电化学安培法,即采用三电极系统,工作电极为待测电化学电极,ag/agcl电极为参比电极,铂电极为对电极;待测电化学电极的工作电压为0.6~0.8v;测试于24~26℃下进行,将三个电极插入盛有ph为7.2~7.4的20ml磷酸缓冲溶液的反应池中,反应池的容积为100ml,溶液经300~500rpm转速的磁力搅拌,向该溶液中滴加适量测试母液并观测电化学电流响应,计算滴加测试母液至电流响应达其最大值90%时的时间间隔,作为响应时间的数值。
105.对实施例1~7中的酶修饰电化学电极的保存期进行测试,得到的保存期如表1所示,保存期的测试方法为:电化学电极日常避光保存于4℃冰箱内;测试方法同响应时间的测试方法,通过向该溶液中滴加适量测试母液观测电化学电极的电流响应,从而比较不同保存期的电化学电极的响应(以不低于初始响应的80%为合格标准)。
106.表1
[0107][0108][0109]
由表1可知:
[0110]
(1)以实施例1~4得到的酶修饰电化学电极对惰性底物具有较小的响应时间且保存期较长,本发明所述酶修饰电化学电极的酶耗量较低,生产成本较低,利于大规模推广使用;所述酶修饰电化学电极的酶镀层厚度为纳米级,对底物的响应快,响应延迟时间为微秒级;所述酶修饰电化学电极的酶镀层对基体电极的尺寸改变很小,有利于酶修饰电化学电极在微米级与纳米级场景下的使用;所述酶修饰电化学电极的寿命较长且易保存;
[0111]
(2)通过实施例1与实施例5的对比可知,壳聚糖溶液会影响酶修饰电化学电极对惰性底物的响应时间及酶镀层与基体电极之间的结合力,这是由于壳聚糖是一种碱性多糖,其结构中含有较多的游离氨基,使其具有较好的生物相容性和生物安全性,因此对酶分子的催化性能具有较好的保护效果;壳聚糖与酶分子在电极表面所形成的聚合产物厚度较薄,但其质地均匀、表面平滑且无明显空隙,适于酶促反应的快速、稳定地进行;
[0112]
(3)通过实施例1与实施例6和7的对比可知,酶溶液与壳聚糖溶液的体积比会影响酶修饰电化学电极对惰性底物的响应时间及酶镀层与基体电极之间的结合力;当酶溶液与壳聚糖溶液的体积比偏低时,会导致响应时间变长,结合力增强,这是由于酶分子占比较低减弱了酶反应效率,而壳聚糖占比较高增强了修饰层与电极表面的结合;当酶溶液与壳聚糖溶液的体积比偏高时,会导致响应时间变短,结合力减弱,这是由于酶分子占比较高增强了酶反应效率,而壳聚糖占比较低减弱了修饰层与电极表面的结合;
[0113]
综上所述,本发明所述酶修饰电化学电极的酶耗量较低,生产成本较低,利于大规模推广使用;所述酶修饰电化学电极的酶镀层厚度为纳米级,对底物的响应快,响应延迟时间为微秒级;所述酶修饰电化学电极的酶镀层对基体电极的尺寸改变很小,有利于酶修饰电化学电极在微米级与纳米级场景下的使用;所述酶修饰电化学电极的酶镀层与基体电极之间的结合力更强,不易脱落,所述酶修饰电化学电极的寿命较长且易保存;本发明采用电镀的方法替代了涂覆操作,所述酶修饰电化学电极的制备方法的操作简单,无需进行反复涂覆操作,减少了操作时间,电极表面修饰的酶量可控。
[0114]
以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1