1.本发明属于材料学、分析化学、细胞生物学及受体药理学等技术领域,涉及一种高稳定性、可重复使用的高稳定性细胞膜键合磁性碳球仿生复合材料及其制备方法和应用。
背景技术:2.中药药效物质基础的阐明是中药现代化的重要内容。中药的化学成分非常复杂,通过传统色谱方法分离并进行活性筛选得到的大部分是常量和少量的成分,对微量、痕量成分研究不足,有些微量成分具有很强的药理活性,在研究中被漏筛。如何快速鉴别中药复方中的活性成分(尤其是微量、痕量成分)是本领域一个亟待解决的重要问题。
3.细胞膜垂钓技术是近年来用于中药(复方)活性成分筛选的前沿热点技术。该技术的主要原理是以磁性颗粒作为细胞膜固载基质,通过膜受体与目标物间的亲和作用选择性萃取药物活性成分,再用醋酸溶液洗脱,从而实现中药药效物质的快速分离分析(chem.commun.,2018,54,13427-13430)。相比于细胞膜色谱法,细胞膜垂钓技术无需装柱和柱平衡过程,具有简便快速、对设备要求低的优点;同时,该技术作为一种固相萃取方法,可以对特异性成分进行预富集,因此更有利于中药微量、痕量活性成分的快速分离分析。
4.目前细胞膜垂钓技术所用的固载基质主要是fe3o4磁性纳米颗粒及其镶嵌的复合材料(如碳纳米管和石墨烯),然而fe3o4纳米颗粒的化学稳定性不足:一方面暴露在空气中时易于被氧气氧化(angew.chem.int.ed.2007,46,1222-1244),同时也易于受到酸性洗脱液的腐蚀(colloid.surface.a 2021,616,126333),导致其表面性质的改变和磁性的降低,十分不利于细胞膜复合材料的重复使用和稳定分析。另一方面,目前磁性基质主要通过非共价键(如物理吸附等)的方式对细胞膜进行固载,固载基质和细胞膜间相互作用较弱,导致细胞膜容易在萃取、洗脱等过程中脱落(chem.eng.j.2019,364,269-279),从而使得细胞膜复合材料的稳定性进一步降低、重复利用率较低、重复使用效果较差。
技术实现要素:5.本发明的目的在于解决现有技术问题,提供一种高稳定性、可重复使用的细胞膜键合磁性碳球仿生复合材料及其制备方法和应用。通过简单的水热碳化法在fe3o4纳米磁球表面覆盖一层水热炭,能显著提高磁球的抗氧化能力、耐酸性、亲水性和细胞膜结合量,同时还可以提供更具反应活性的羧基与细胞膜氨基进行酰胺化固载,综合提高细胞膜复合材料的稳定性和重复使用性,为药物的开发提供了新技术手段。
6.本发明解决其技术问题所采用的技术方案是:
7.本发明的目的之一是提供一种高稳定性细胞膜键合磁性碳球复合材料,所述复合材料是由磁性碳球表面羧基经羧基活化试剂活化后得到活化磁性碳球,随后与细胞膜进行反应,制备得到高稳定性细胞膜键合磁性碳球。
8.通过采用所述技术方案,采用羧基活化试剂对磁性碳球表面的羧基进行活化,活化后的磁性碳球与细胞膜携带的游离氨基进行酰胺缩合反应,即由细胞膜与具有活化酯基
磁性碳球共价键连接,从而制备得到目标的高稳定性细胞膜键合磁性碳球复合材料;因所述复合材料中的细胞膜与磁性碳球之间是通过化学键连接,因此具有优秀的负载细胞膜而不易脱落的优势,从而具有高稳定性,并具有高循环使用的性能。
9.优选的,所述磁性碳球的平均粒径为120-350nm,由磁球和葡萄糖经水热反应制备得到,其中,磁球为fe3o4磁性纳米粒子;更优选的,所述磁球和葡萄糖质量比为0.1~0.5:0.5~2;更优选的,反应温度不低于200℃,反应时间不低于10h。
10.更优选的,所述磁球粒径为100-280nm,是由铁盐经溶剂热反应合成得到fe3o4磁性纳米粒子;更优选的,所述铁盐为六水合氯化铁;更优选的,所述磁球是由六水合氯化铁、柠檬酸钠、乙酸钠以乙二醇为溶剂经溶剂热反应制得。更优选的,所述的六水合氯化铁、柠檬酸钠、乙酸钠的投料质量比为0.5~2.5:0.25~1.5:1~4,溶剂的投料量为20-70ml;更优选的,反应温度不低于200℃,反应时间不低于10h。
11.优选的,所述羧基活化试剂为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基丁二酰亚胺(nhs)的至少一种,更优选为edc和nhs的混合物。
12.更优选的,磁性碳球、edc、nhs的质量比为(1-5):(2-12):(4-24);更优选的,所述活化磁性碳球是由10-50mg磁性碳球与20-120mg edc和40-240mg nhs在0.01-0.1mol/l mes缓冲液中进行活化得到的。
13.优选的,所述的细胞数量与磁性碳球的比例为1
×
107~1.2
×
108个细胞/5-50mg磁性碳球;更优选的,所述细胞膜为mc3t3-e1细胞的细胞膜。
14.本发明的另一目的是提供一种上述任一所述的高稳定性细胞膜键合磁性碳球复合材料的制备方法,包括以下步骤:
15.(1)采用水热法制备得到磁球,并与葡萄糖经水热反应制备得到磁性碳球;
16.(2)磁性碳球经羧基活化试剂活化后得到活化磁性碳球;
17.(3)细胞经破碎分离得到细胞膜,细胞膜与活化磁性碳球反应制备得到高稳定性细胞膜键合磁性碳球复合材料。
18.优选的,所述步骤(1)中,采用六水合氯化铁与柠檬酸钠充分溶解于乙二醇中,50℃水浴加热搅拌条件下加入乙酸钠,待完全溶解后放入水热反应釜中,反应温度不低于200℃,时间不低于10小时,制得磁性纳米颗粒,即为磁球;更优选制得材料经水和乙醇清洗数次。
19.优选的,所述步骤(1)中,将磁球分散在超纯水中,加入葡萄糖,机械搅拌至葡萄糖颗粒完全溶解,放入水热反应釜中,反应温度不低于200℃,时间不低于10小时,制得磁性碳球,更优选制得材料经水和乙醇清洗数次。
20.优选的,所述步骤(2)中,将磁性碳球分散于mes缓冲液中,加入edc和nhs活化羧基,制得活化羧基后的活化磁性碳球。
21.优选的,所述步骤(3)中,培养细胞并收集细胞,充分分散在pbs溶液中,置于超声波细胞破碎仪中,冰水浴条件下585w,工作2s,停止5s,时间15min,进行破碎,通过差数离心分离得到细胞膜。更优选的,细胞为mc3t3-e1细胞。
22.优选的,所述步骤(3)中,细胞膜充分分散于pbs溶液中得到细胞膜悬浮液,将活化磁性碳球重悬于细胞膜悬浮液中,超声,摇床缓慢振摇不低于12h,磁铁分离,pbs缓冲液润洗数次,得到高稳定性细胞膜键合磁性碳球复合材料。更优选摇床温度为4℃左右。
23.本发明的又一目的是提供一种上述任一高稳定性细胞膜键合磁性碳球复合材料的应用,所述高稳定性细胞膜键合磁性碳球复合材料作为固相萃取材料应用于中药、中药复方等天然产物的各类活性物质(如黄酮类、萜类、苷类、木质素类等)检测、筛选或提取技术中,更优选作为细胞膜垂钓技术中的固相萃取材料。
24.进一步的,在用于筛选药物的抗骨质疏松及潜在抗骨质疏松的成分时,由于抗骨质疏松及潜在抗骨质疏松的成分可特异性结合mc3t3-e1细胞膜蛋白,可用于药物抗骨质疏松及潜在抗骨质疏松组分的筛选,对于先导药物筛选具有重要意义。
25.本发明的再一目的是提供一种中药有效成分的筛选方法,包括以下的步骤:
26.1)取上述的高稳定性细胞膜键合磁性碳球复合材料,加入中药提取液,37℃水浴恒温振荡5-60min,磁铁分离材料,超纯水洗涤;
27.2)用洗脱剂洗脱所述的复合材料及其结合物质,洗脱液去除溶剂后的物质进行分析,筛选有效成分群。
28.优选的,所述的中药为复方中药,更优选为三子丸。更优选的,步骤1)中复合材料的加入量为2-20mg复合材料/1ml中药提取液;更优选的,步骤2)中洗脱剂为1%-20%乙酸溶液;更优选的,步骤2)中分析方法为物质复溶于甲醇,经0.22μm滤膜过滤后注入分析仪器中进行分析。
29.与现有技术相比,本发明的有益效果是:现有磁性细胞膜载体材料稳定性较差,长期放置容易被空气氧化,且在酸性洗脱液中易被腐蚀,同时与细胞膜的结合能力较弱,造成磁性载体-细胞膜复合材料的稳定稳定性较差、难以多次重复使用,不利于细胞膜垂钓技术的实际应用。本发明提供的高稳定性磁性碳球仿生材料由表面带有活性酯基的水热碳包裹磁性粒子制得,因此本发明提供的细胞膜键合磁性碳球材料在保持磁性纳米颗粒原有的易分离的基础上,在磁球表面引入水热碳层,不仅显著提高了载体材料自身的化学稳定性和亲水性,而且增加了材料与细胞膜结合的强度,综合提高了细胞膜仿生材料的稳定性和可重复使用性,为药物的开发提供了新的技术手段。本发明对于药物的安全性评价和新药先导化合物的发现具有重要意义。
附图说明
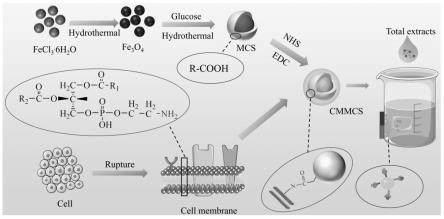
30.图1为本发明细胞膜键合磁性碳球仿生材料的一种制备流程示意图;
31.图2fe3o4磁球(mns)和磁性碳球(mhcns)的磁响应时间随静置时间变化对比图;
32.图3mns和mhcns的水分散性随时间的变化对比图;
33.图4mns和mhcns的耐酸性测试(ph=1)对比图;
34.图5mns(a)、mhcns(b)和细胞膜键合磁性碳球(cm-mhcns)(c)的扫描电镜图;
35.图6mns、mhcns和cm-mhcns的红外光谱图;
36.图7cm/mns、cm/mhcns和cm-mhcns的细胞膜结合量随时间的稳定性变化对比图;
37.图8cm/mns、cm/mhcns和cm-mhcns对蛇床子素结合量随使用次数的变化对比图;
38.图9三子丸中药复方原液(a)及cm-mhcns萃取液(b)的色谱图。
具体实施方式
39.下面通过具体实施例,并结合附图,对本发明的技术方案作进一步的具体说明。
40.本发明提供了一种高稳定性细胞膜键合磁性碳球材料及其制备方法。通过磁性粒子、葡萄糖的水热反应制得磁性碳球并活化,同时对达到技术要求的贴壁生长的细胞通过消化、破碎、差速离心制备得到细胞膜,将活化后的磁性碳球与细胞膜充分混合,利用磁性碳球携带的活化基团与细胞膜游离基团共价连接将细胞膜包裹在磁性碳球表面,得到高稳定性、可循环使用的细胞膜键合磁性碳球复合材料。本发明的细胞膜键合磁性碳球能够显著提高材料的使用寿命,为药物开发提供了新的技术手段,具有重要意义。
41.本发明所述的细胞膜键合磁性碳球复合材料的制备方法包含以下操作:
42.1)磁性碳球的制备
43.六水合氯化铁与柠檬酸钠超声溶解于乙二醇中,加入乙酸钠磁力搅拌至完全溶解,200℃下水热反应10h制得磁性纳米颗粒。对所得磁性纳米颗粒用超纯水和无水乙醇清洗数次,最终分散于超纯水中。取上述磁性纳米颗粒悬浮液,加入无水葡萄糖,机械搅拌使葡萄糖完全溶解,200℃下水热反应10h制得磁性碳球,利用重力沉降法去除未包裹磁性纳米颗粒的碳球,再用超纯水和无水乙醇洗涤数次后烘干。优选的,所述的六水合氯化铁、柠檬酸钠、乙酸钠的投料质量比为0.5~2.5:0.25~1.5:1~4,溶剂乙二醇的投料量为20-70ml;所述磁球和葡萄糖质量比为0.1~0.5:0.5~2。
44.所述的磁性碳球的制备方法是作为本发明的磁性碳球的来源的一种体现,但不局限于本发明的制备方法所获得的磁性碳球,与本发明的磁性碳球所具有的特征相似(即表面具有可供活化的羧基等官能团)的磁性碳球均可以作为本发明所述的磁性碳球。
45.2)磁性碳球的活化
46.取磁性碳球,分散在mes缓冲液中,加入edc和nhs,超声,37℃水浴恒温摇床振荡。优选的,磁性碳球、edc、nhs的质量比为(1-5):(2-12):(4-24);mes缓冲液为0.01-0.1mol/l mes缓冲液。
47.3)细胞膜的制备
48.培养细胞,细胞计数约为6
×
107个,去除培养基,pbs润洗数次,0.25%胰酶消化,4℃条件下离心收集细胞,pbs重悬,浓度约为3~12
×
107/ml。置于细胞超声破碎仪中将细胞破碎,冰水浴条件下585w,工作2s,停止5s,时间15min,进行破碎,1000
×
g转速4℃条件下离心10-15min,取上清,15000
×
g 4℃条件下离心10-20min,沉淀即为细胞膜,重悬于pbs中。
49.4)细胞膜键合磁性碳球的制备
50.将活化后的磁性碳球重悬于细胞膜悬浮液中,超声10min,4℃下摇床缓慢振荡12h,利用磁性碳球活化酯基与细胞膜膜蛋白携带氨基共价键连接,使细胞膜与磁性碳球充分包裹。
51.本发明通过上述制备方法制备得到了一种高稳定性细胞膜键合磁性碳球复合材料,所述复合材料具有高稳定性和高循环利用性,可以重复利用。同时,本发明还提供了一种将上述高稳定性细胞膜键合磁性碳球复合材料作为固相萃取材料应用于药物提取的应用方法,对于药物领域的研究发展和疾病领域的治疗等具有重大意义。
52.下面结合具体的实施例对本发明做进一步的详细说明,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。所述是对本发明的解释而不是限定。
53.实施例1
54.骨质疏松是由于多种原因导致的骨密度和骨质量下降,骨微结构破坏,造成骨脆
性增加,从而容易发生骨折的全身性骨病。究其细胞层面病因,通常是由于破骨细胞骨吸收作用大于成骨细胞骨形成作用。本发明制备的mc3t3-e1细胞膜键合磁性碳球材料可以稳定、高效的筛选药物中作用于mc3t3-e1细胞的有效成分,对治疗骨质疏松症具有重要意义。
55.本实施例中所述的mc3t3-e1细胞膜键合磁性碳球的制备及在筛选三子丸抗骨质疏松药效成分中的应用,包含以下操作:
56.1)磁性碳球的制备
57.称取1.8g六水合氯化铁与0.36g柠檬酸钠超声溶解于50ml乙二醇中,在50℃条件下加入2.4g乙酸钠磁力搅拌30min,完全溶解,200℃下水热反应10h制得0.51g粒径为189nm的磁性纳米粒子(即磁球,见附图5a)。所得磁性纳米粒子分别用超纯水和无水乙醇各清洗三次,最终分散于20ml超纯水中。取上述10ml磁性纳米粒子悬浮液,加入1.8g无水葡萄糖,机械搅拌30min使葡萄糖完全溶解,200℃下水热反应10h制得磁性碳球,利用重力沉降法去除未包裹磁性粒子的碳球,再用超纯水和无水乙醇洗涤三次,烘干,得到0.63g平均粒径为195nm的磁性碳球(见图5b)。通过sem可观察到磁性碳球的表面粗糙程度显著大于磁球。通过图6的红外光谱图可观察到磁性碳球表面出现了fe3o4磁球所不具有的c=o(1702cm-1
处吸收峰)和c-o基团(1330cm-1
处吸收峰),表明磁球经过与葡萄糖的反应后于表面生产水热碳层。这些表面基团(如羧基等)为后续的活化及细胞膜共价键合修饰奠定了基础。
58.分别取5mg制备的fe3o4磁球(磁性纳米粒子)和磁性碳球,超声30min使其分别分散于10ml去离子水中,配制为0.5mg/ml的磁球悬浮液和磁性碳球悬浮液,4℃空气中静置,可发现静置5天和10天后,磁性碳球的磁响应时间无明显变化,而磁球的磁响应时间从初始14s显著增大为27s和38s,表明磁球的磁性显著降低(见图2)。
59.重复上述操作,观察14h和48h后悬浮液的沉降情况(见图3),发现磁性碳球的沉降速度显著低于磁球,具有更好的分散性,表明其更强的亲水性。
60.再分别取10ml 0.5mg/ml磁球的悬浮液和磁性碳球的悬浮液,调节溶液ph=1,静置3天后发现磁性碳球的磁响应时间无明显变化,溶液澄清,而磁球则无法完全分离,保持磁场5min,仍有颗粒分散于溶液中,溶液呈棕色(见图4),表明磁性碳球能耐受强酸腐蚀,而磁球不能。测试结果表明相比磁球,磁性碳球具有更好的磁稳定性、亲水性(水分散性)及耐酸性,适合进一步制备稳定的仿生复合材料。
61.2)磁性碳球的活化
62.取上述烘干的20mg磁性碳球,分散在20ml 0.1m的mes缓冲液中,加入80mg edc,120mg nhs,超声15s,37℃水浴恒温摇床振荡15min,超纯水洗涤三次,将产物分散于3ml pbs中。
63.3)细胞膜的制备
64.本发明选取mc3t3-e1细胞制备mc3t3-e1细胞膜键合磁性碳球。取mc3t3-e1细胞,对其细胞计数为6
×
107个时,去除培养基,pbs润洗3次,加入0.25%胰酶将贴壁生长的mc3t3-e1细胞消化下来,1000rpm/min4℃条件下离心5min收集细胞,2ml pbs重悬。置于细胞超声破碎仪中将mc3t3-e1细胞破碎,1000
×
g转速4℃条件下离心10min,取上清,15000
×
g 4℃条件下离心10min,沉淀即为mc3t3-e1细胞膜,重悬于3ml pbs中。
65.4)细胞膜键合磁性碳球的制备
66.将步骤2)活化后的磁性碳球悬浮液与步骤3)所得细胞膜悬浮液混合,超声分散
10min,4℃摇床条件下过夜,一般过夜时间为12h,利用磁性碳球活化基团与细胞膜进行化学键连接,使细胞膜与磁性碳球之间充分键合,使得细胞膜稳固包裹于磁性碳球上,得到本发明所述的目标高稳定性细胞膜键合磁性碳球复合材料。所得复合材料的sem图见附图5c,平均粒径为199nm,与磁球和磁性碳球相比,其表面粗糙度显著下降,表面光滑。结合附图6,相对于磁性碳球mhcns,复合材料cm-mhcns表面c-h和c-o基团的红外吸收峰显著增强,fe-o基团吸收峰显著减小,且新出现了酯基(1743cm-1
)吸收峰。这些结果表明细胞膜已成功键合到磁性碳球表面。
67.5)利用高稳定性细胞膜键合磁性碳球复合材料筛选中药提取液中目标成分
68.37℃恒温条件下,将步骤4)制备的高稳定性细胞膜键合磁性碳球复合材料孵育在10ml三子丸提取液中,振荡孵育15min。磁铁分离,15%醋酸洗脱液洗脱5次,每次2min。合并洗脱液,旋蒸,复溶于0.5ml甲醇,经0.22μm滤膜过滤后,注入分析仪器中,筛选有效成分群;
69.其中,三子丸提取液的配制:取菟丝子、五味子、蛇床子三味中药各5g,85℃条件下,100ml 90%乙醇冷凝回流2h重复两次,合并两次滤液,旋蒸复溶于10ml超纯水中。
70.色谱条件:
71.液相:waters acquity uplc h-class超高效液相色谱
72.流动相:a:0.1%甲酸,b:乙腈
73.流速:0.2ml/min
74.色谱柱:acquity uplcbehc18 1.7μm
75.样品:a:mc3t3-e1细胞膜键合磁性碳球特异性结合三子丸提取液后洗脱成分;b:三子丸提取液
76.柱温:35℃
77.检测波长:270nm
78.检测结果如图9所示:本发明制备的mc3t3-e1细胞膜键合磁性碳球材料从三子丸提取液(样品a)中共分离鉴别出19种,其中代表性成分13种,明显高于三子丸提取液(样品b)的分离鉴别效果。
79.筛选结果
80.本发明制备的mc3t3-e1细胞膜键合磁性碳球材料从三子丸提取液中筛选出代表性成分13种,经过超高效液相色谱分析和质谱鉴定,分别为金丝桃苷r1、β-谷甾醇r2、槲皮素r3、山奈酚r4、佛手柑内酯r5、欧前胡内酯r6、芹菜素r7、香叶木素r8、欧前胡素r9、蛇床子素r10、五味子醇甲r11、五味子甲素r12、五味子乙素r13。上述13种成分均已被文献报道具有抗骨质疏松作用。
81.测试例1
82.为测试细胞膜键合磁性碳球复合材料(cm-mhcns)的稳定性,制备fe3o4磁球吸附细胞膜复合材料(cm/mns)和磁性碳球吸附细胞膜复合材料(cm/mhcns)作为对比。cm/mns制备及相关参数如实施例一步骤1)、3)和4),所不同的是将步骤4)“活化后的磁性碳球”替换为“fe3o4磁球”。cm/mhcns制备及相关参数如实施例一步骤1)、3)和4),所不同的是将步骤4)“活化后的磁性碳球”替换为“磁性碳球”。然后将上述三种复合材料4℃静置于5ml pbs中,通过蛋白检测试剂盒检测复合材料上剩余蛋白的相对含量(mg/g)随静置天数的变化,所得结果如图7所示。cm-mhcns固载的膜蛋白(细胞膜)量显著高于cm/mns和cm/mhcns,且随时间
变化不大,6天后仍有80.6%的初始蛋白量,而cm/mns和cm/mhcns的膜蛋白固载量随时间延长而大幅度下降,6天后仅相当于初始值的42.3%和19.7%,表明本发明制备的细胞膜键合磁性碳球复合材料具有优秀的稳定性。
83.测试例2
84.以蛇床子素作为阳性药考察cm-mhcns的重复使用性。将实施例一中制备的cm-mhcns平均分为7份,37℃恒温条件下,分别孵育在10ml80mg/l蛇床子素溶液中,振荡孵育15min。磁铁分离,8%醋酸洗脱液洗脱3次,每次2min。合并洗脱液,旋蒸,复溶于0.5ml甲醇,经0.22μm滤膜过滤后,注入分析仪器中,分析所得蛇床子素的量。样品1、2、3、4、5、6、7分别进行上述实验步骤1次、2次、3次、4次、5次、6次、7次后,通过高效液相色谱分别测试1-7次样品的蛇床子素结合量。将测试例1制备的cm/mns和cm/mhcns作为对照,也同样分别均分为7份,重复上述步骤,获得三种复合材料的蛇床子素结合量随重复实验次数的变化(见图8)。结果显示cm-mhcns的蛇床子素结合量显著高于cm/mns和cm/mhcns,且经过7次重复使用后,仍保留了82.6%的初始结合量,而此时cm/mns和cm/mhcns只有对应初始结合量的35.5%和16.8%,表明本发明所得细胞膜键合磁性碳球具有优秀的重复使用性,进一步表面其具有优秀的稳定性。
85.上述结果表明本发明所制备的mc3t3-e1细胞膜键合磁性碳球能够识别三子丸提取液中抗骨质疏松成分,且使用寿命较长,稳定性良好,可重复使用。
86.以上所述,仅是本发明的较佳实例方案,并非对本发明做任何限制,凡是根据本发明技术实质对以上实施所作的任何简单修改、变更以及等效结构变换,均仍属于本发明技术方案的保护范围内。
