一种中药复方组合物的质量检测方法与流程
1.本发明属于中药制剂领域,涉及一种中药复方组合物的质量检测方法。
背景技术:
[0002]“治未病”是中医治则学说的基本法则,它的定义是采取适当的预防或治疗手段,防止疾病发生、发展的方法。“治未病”思想与中医学中的阴阳、五行、精气学说一样,都源于古代哲学思想,首见于《黄帝内经》中《素问
·
四气调神大论》:“是故圣人不治已病治未病,不治已乱治未乱,此之谓也。夫病已成而后药之,乱已成而后治之,譬犹渴而穿井,斗而铸锥,不亦晚乎”,从而奠定了中医“治未病”理论的基础。
[0003]
中医“治未病”理论是中医预防医学的精髓,涵盖“未病先防、既病防变、病愈防复”三个方面。从整体观念出发,中医“治未病”的中心思想就是“与其救疗于有疾之后,不若摄养于无疾之先”,随着医学模式转变,提出疾病防治重心前移,重点落实到“防”字上。中医“治未病”,以扶助正气、增强体质为目的的防治理念,以对外适应自然变化、对内促进机体抗病能力为治疗原则,重视从功能和整体的变化上把握生命活动,未病先防、即病防变。这不仅符合机体的生命活动规律,而且有可能成为降低现代社会疑难杂症发病率的重要方法,充分体现了中医“天人合一”和整体观念。
[0004]
随着社会经济的快速发展和人民生活水平的大幅提高,虽然医疗体制在不断改革,医疗水平在不断提高、国家医疗投入也在不断增加,但仍赶不上疾病的发展,赶不上群众看病的实际需求。针对目前的现状,国家开始重视治未病这一中医传统理论。“健康中国2030”规划纲要中特别强调到2030年,发挥中医药在治未病中的主导作用、在重大疾病治疗中的协同作用,提高中医药应急救治和重大传染病防治能力。可见,治未病这一传统中医的理论已重新引起人们关注。
[0005]
鉴于中药是一个由多种成分构成的复杂体系,且其成分受多个因素影响,如品种、产地、采收、炮制加工等,但中药中多样性、复杂性的成分是其疗效良好、作用广泛、副作用较小的物质基础,该物质基础长期处于一种模糊、难以全面评价的状态;经多味药味的配伍煎煮后,复方的质量更是无法用明确、有效、合理的指标进行评价,然而中药复方治疗效果与其质量有着直接关系,中药复方质量不良会直接导致治疗效果的不佳,这需要对中药复方进行质量控制以保证疗效的稳定性、可控性。中药质量的控制需要能对全部药效成分进行监控,建立的质量控制体系才能保证用药的有效性、可控性、安全性。因此,建立中医药基础理论特色的现代质量管控体系,解决中药分析的难题,改进现有质量控制方法是当今研究的热点。
技术实现要素:
[0006]
本发明所要解决的技术问题是针对现有技术的不足,提供一种中药复方组合物的质量检测方法,该质量检测方法准确度高、灵敏度高,实现了对药品质量的有效控制,对控制中药复方组合物的质量和保证临床疗效具有重要意义。
[0007]
为了解决上述技术问题,本发明公开了一种中药复方组合物的质量检测方法。
[0008]
其中,质量检测方法由性状、鉴别、检查、含量测定和微生物限度检查组成,其中鉴别是对黄芪和麦冬的鉴别,含量测定是用高效液相色谱法对中药复方组合物颗粒中毛蕊异黄酮葡萄糖苷的含量测定。
[0009]
具体地,所述的性状,本品为黄棕色至棕褐色颗粒,味甘酸微苦。
[0010]
优选地,所述的鉴别包括如下黄芪的鉴别和麦冬的鉴别。
[0011]
进一步地,所述的黄芪的鉴别包括如下步骤:
[0012]
供试品溶液的制备:取中药复方组合物颗粒,研磨,加水溶解,用饱和正丁醇提取,得到正丁醇提取液;随后将正丁醇提取液用氨试液洗涤,水浴蒸干正丁醇,得到的固体加入甲醇溶解,即得;
[0013]
阴性样品溶液的制备:取黄芪阴性样品颗粒,研磨,加水溶解,用饱和正丁醇提取,得到正丁醇提取液;随后将正丁醇提取液用氨试液洗涤,水浴蒸干正丁醇,得到的固体加入甲醇溶解,即得;
[0014]
对照品溶液的制备:取黄芪甲苷,加入甲醇溶解,即得;
[0015]
鉴别:照薄层色谱法试验,分别吸取供试品溶液、阴性样品溶液和对照品溶液,以三氯甲烷-甲醇-10wt%氢氧化钠溶液为展开剂展开,取出,晾干,喷以硫酸乙醇溶液,加热至斑点显色清晰,置于紫外光灯下检视。
[0016]
其中,所述的氨试液,具体的配置方法为将400ml 25wt%~28wt%的浓氨水加水定容至1000ml即得。
[0017]
进一步地,所述的麦冬的鉴别包括如下步骤:
[0018]
供试品溶液的制备:取中药复方组合物颗粒,研磨,加水溶解,再加入盐酸溶液,加热回流,冷却,用乙醚提取,得到乙醚提取液,挥干乙醚,得到的固体加入氯仿溶解,即得;
[0019]
阴性样品溶液的制备:取麦冬阴性样品颗粒,研磨,加水溶解,再加入盐酸溶液,加热回流,冷却,用乙醚提取,得到乙醚提取液,挥干乙醚,得到的固体加入氯仿溶解,即得;
[0020]
对照品溶液的制备:取麦冬对照药材,加水煎煮,滤过,滤液浓缩后加入盐酸溶液,再向体系中加水溶解,再加入盐酸溶液,加热回流,冷却,用乙醚提取,得到乙醚提取液,挥干乙醚,得到的固体加入氯仿溶解,即得;
[0021]
鉴别:照薄层色谱法试验,分别吸取供试品溶液、阴性样品溶液和对照品溶液,以三氯甲烷-丙酮为展开剂展开,取出,晾干,喷以硫酸乙醇溶液,加热至斑点显色清晰,在日光下检视。
[0022]
其中,所述的盐酸溶液的浓度为8wt%。
[0023]
优选地,所述的检查包括粒度、水分、溶化性和装量差异。
[0024]
具体地,所述的粒度,照中华人民共和国药典2020版四部0982双筛分法检查。
[0025]
其中,所述的双筛分法中规定不能通过一号筛与能通过五号筛的总和不得超过15%。
[0026]
具体地,所述的水分,照中华人民共和国药典2020版四部0832烘干法检查。
[0027]
其中,所述的烘干法中规定水分不得超过8.0%。
[0028]
具体地,所述的溶化性,照中华人民共和国药典2020版四部0104颗粒剂可溶颗粒检查法检查。
[0029]
其中,所述的可溶颗粒检查法中规定应全部溶化或轻微浑浊。
[0030]
具体地,所述的装量差异,照中华人民共和国药典2020版四部0104颗粒剂装量差异方法检查。
[0031]
其中,所述的装量差异方法中规定每袋装量与标示装量相比较,超出装量差异限度(
±
5%)的颗粒剂不得多于2袋,并不得有1袋超出装量差异限度(
±
5%)1倍。
[0032]
优选地,所述的高效液相色谱法对中药复方组合物颗粒中毛蕊异黄酮葡萄糖苷的含量测定包括如下步骤:
[0033]
供试品溶液的制备:取中药复方组合物颗粒,加入甲醇,超声,定容,摇匀,过滤膜,即得;
[0034]
阴性样品溶液的制备:取黄芪阴性样品颗粒,加入甲醇,超声,定容,摇匀,过滤膜,即得;
[0035]
对照品溶液的制备:取毛蕊异黄酮葡萄糖苷,加入甲醇,超声,定容,摇匀,过滤膜,即得;
[0036]
色谱条件:色谱柱:agilent porshell 120sb-aq c18,规格4.6mm
×
100mm,2.7μm;流动相:流动相a相为0.2%磷酸水溶液,流动相b相为乙腈,流动相a相与流动相b相的体积比为80:20,等梯度洗脱;柱温:30℃;流速:1.0ml/min;检测波长:260nm;进样量:10μl;采集时间为20min;
[0037]
测定法:分别吸取供试品溶液、阴性样品溶液和对照品溶液,注入高效液相色谱仪,测定并计算。
[0038]
具体地,所述的微生物限度检查,照中华人民共和国药典2020版1105微生物计数法和1106控制菌检查法检查。
[0039]
具体地,所述的中药复方组合物包括如下质量份的原料药组成:黄芪8~15份、金银花6~15份、薄荷2~8份、紫苏叶4~14份、防风2~10份、麦冬5~15份、陈皮2~10份、焦六神曲6~15份、甘草1~6份;所述的中药复方组合物的制备方法,称取黄芪、金银花、薄荷、紫苏叶、防风、麦冬、陈皮、焦六神曲、甘草,加水煎煮,滤过,滤液进行第一减压浓缩至60℃相对密度为1.05~1.14,静置离心,滤液进行第二减压浓缩至60℃相对密度为1.15~1.22后加入常规辅料,得到浓缩液;称取常规辅料置于流化床中,设置进风温度为100℃,以100~150r/min的速率进浓缩液,雾化压力外0.2mpa,雾化压力内0.3mpa,60℃干燥1~1.5h,即得中药复方组合物颗粒。
[0040]
其中,常规辅料的用量根据成品的固含物以及成品量进行调节。
[0041]
其中,所述的中药复方组合物功能主治益气养阴固表、疏风清热解毒、理气和胃健脾。用于预防和治疗上呼吸道感染及流行性感冒等属温病初起、邪郁肺卫者,症见发热、乏力、纳差、肌肉酸痛、鼻塞流涕、咳嗽、咽干咽痛、苔薄黄或腻等,同时可以增强体质,提高机体免疫力。
[0042]
其中,本发明所述的中药复方组合物的中药配伍原理为:
[0043]
方中以黄芪为君,益气固表,托邪外出;风热外侵,邪正相争,郁于肌表,上犯咽喉,证见发热、肌肉酸痛、鼻塞流涕、咽痛咳嗽、脉浮数,故以金银花、薄荷为臣,疏风清热解毒;加紫苏叶、防风为佐,疏风解表透邪以助金银花、薄荷解表清热之力,且防风得黄芪祛邪而不伤正,黄芪得防风固表而不敛邪。温热之邪,易伤津液,则见咽干、口渴,故以麦冬养阴生
津;气虚不运,胃口不开,则见纳差、苔腻或黄,故加陈皮、焦六神曲理气和胃健脾,以助化源之本;甘草益气解毒,此皆为使药。全方合用,补中寓散,有安内攘外之妙,共奏益气养阴固表、疏风清热解毒、理气和胃健脾之功效,使卫外得固,邪热得解,其病自愈。
[0044]
具体地,在黄芪的鉴别中,所述的展开剂三氯甲烷-甲醇-10wt%氢氧化钠溶液的体积比为13:7:2;所述的紫外光灯,波长为366nm。
[0045]
其中,在黄芪的鉴别中,所述的硫酸乙醇溶液,溶剂为乙醇,溶质为硫酸,硫酸的浓度为10wt%。
[0046]
具体地,在麦冬的鉴别中,所述的加热回流,加热回流温度为100℃,加热回流时间为1h;所述的展开剂三氯甲烷-丙酮的体积比为8:2。
[0047]
其中,在麦冬的鉴别中,所述的硫酸乙醇溶液,溶剂为乙醇,溶质为硫酸,硫酸的浓度为10wt%。
[0048]
具体地,所述的黄芪阴性样品颗粒为所述的中药复方组合物中除黄芪以外的组分按照所述的中药复方组合物的制备方法制备得到。
[0049]
具体地,所述的麦冬阴性样品颗粒为所述的中药复方组合物中除麦冬以外的组分按照所述的中药复方组合物的制备方法制备得到。
[0050]
具体地,在毛蕊异黄酮葡萄糖苷的含量测定中,所述的计算为外标法。
[0051]
有益效果:
[0052]
(1)本发明所述的中药复方组合物的质量检测方法,通过测定毛蕊异黄酮葡萄糖苷的含量,进一步提高了对所述的中药复方组合物质量监控的全面性和可靠性;通过对供试品溶液、阴性样品溶液和对照品溶液进行提取处理,选择合适的流动相和梯度洗脱程序,使得检测方法准确可靠,专属性强,线性关系、精密度、回收率满足要求,操作简单方便。
[0053]
(2)本发明所述的中药复方组合物的质量检测方法,通过对中药复方组合物颗粒用水溶解后,正丁醇提取,氨试液洗涤,甲醇溶解制得供试品溶液,并以三氯甲烷-甲醇-10wt%氢氧化钠溶液为展开剂对供试品溶液进行展开,实现中药复方组合物中黄芪的鉴别;通过对中药复方组合物颗粒用水溶解后,乙醚提取,氯仿溶解制得供试品溶液,并以三氯甲烷-丙酮为展开剂对供试品溶液进行展开,实现中药复方组合物中麦冬的鉴别,使得对所述的中药复方组合物的质量检测更全面,更完善的表征了药物的有效活性组分及其质量,有利于对活性成分的全面监控,进一步保证了所述的中药复方组合物的稳定性、一致性和可控性,并确保了所述的中药复方组合物的安全性和有效性。
附图说明
[0054]
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
[0055]
图1为黄芪的点板薄层色谱图,其中1为黄芪甲苷对照品,2为供试品,3为黄芪阴性样品;
[0056]
图2为青岛海洋化工的硅胶g板点板薄层色谱图,其中1为黄芪甲苷对照品,2为供试品,3为黄芪阴性样品;
[0057]
图3为安徽良臣硅源材料的硅胶g板点板薄层色谱图,其中1为黄芪甲苷对照品,2为供试品,3为黄芪阴性样品;
[0058]
图4为在10℃下点板薄层色谱图,其中1为黄芪甲苷对照品,2为供试品,3为黄芪阴性样品;
[0059]
图5为在25℃下点板薄层色谱图,其中1为黄芪甲苷对照品,2为供试品,3为黄芪阴性样品;
[0060]
图6为在32%湿度下点板薄层色谱图,其中1为黄芪甲苷对照品,2为供试品,3为黄芪阴性样品;
[0061]
图7为在72%湿度下点板薄层色谱图,其中1为黄芪甲苷对照品,2为供试品,3为黄芪阴性样品;
[0062]
图8为麦冬的点板薄层色谱图,其中1为供试品,2为麦冬对照品,3为麦冬阴性样品;
[0063]
图9为青岛海洋化工的硅胶g板点板薄层色谱图,其中1为供试品,2为麦冬对照品,3为麦冬阴性样品;
[0064]
图10为安徽良臣硅源材料的硅胶g板点板薄层色谱图,其中1为供试品,2为麦冬对照品,3为麦冬阴性样品;
[0065]
图11为在10℃下点板薄层色谱图,其中1为供试品,2为麦冬对照品,3为麦冬阴性样品;
[0066]
图12为在25℃下点板薄层色谱图,其中1为供试品,2为麦冬对照品,3为麦冬阴性样品;
[0067]
图13为在32%湿度下点板薄层色谱图,其中1为供试品,2为麦冬对照品,3为麦冬阴性样品;
[0068]
图14为在72%湿度下点板薄层色谱图,其中1为供试品,2为麦冬对照品,3为麦冬阴性样品;
[0069]
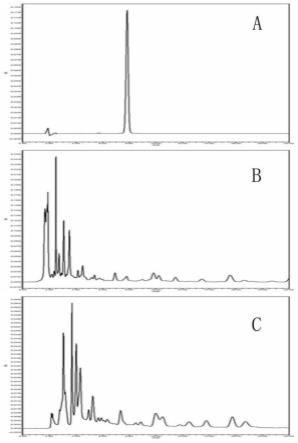
图15为中药复方组合物专属性图,其中a为毛蕊异黄酮葡萄糖苷对照品色谱图,b为供试品色谱图,c为黄芪阴性样品;
[0070]
图16为毛蕊异黄酮葡萄糖苷含量测定标准曲线线性图。
具体实施方式
[0071]
下面将结合实施例对本发明的实施方案进行详细描述,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所述试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0072]
1以下实施例用到的材料、试剂与药材如下:
[0073]
1.1实验材料
[0074]
硅胶板(批号:20210329,青岛海洋化工的硅胶g板)/(批号:20210320,安徽良臣硅源材料的硅胶g板)。
[0075]
1.2实验试剂和药材
[0076]
氨试液制备:将400ml 25wt%~28wt%的浓氨水加水定容至1000ml,即得。
[0077]
在研究本发明中药复方组合物制剂质量标准时,采用的对照品均为《中华人民共和国药典》2020年版四部通则8061所收载,并购自中国药品生物制品检定所,根据国家药品监督管理局颁布的“中药新药质量标准用对照品研究的技术要求”中规定,可直接按类别釆
用,现说明如下:
[0078]
黄芪甲苷对照品(批号:110781-201717,中国食品药品检定研究院),麦冬对照药材(批号:121013-201711,中国食品药品检定研究院),毛蕊异黄酮葡萄糖苷对照品(批号:111920-201907,中国食品药品检定研究院)。
[0079]
实施例1
[0080]
一种中药复方组合物,包括如下重量份数的组分:黄芪10份,金银花12份,薄荷4份,紫苏叶12份,防风4份,麦冬8份,陈皮4份,焦六神曲10份,甘草3份。
[0081]
制备方法:以上饮片,加水煎煮2次,第一次加10倍量水,浸泡0.8h,煎煮1.2h,滤过;第二次加12倍量水,煎煮1.2h,滤过,合并两次滤液,减压浓缩(真空度-0.08~-0.04mpa,温度70~80℃)至相对密度约1.08~1.12(60℃),静置,直管式高速离心机离心(转速:16000r/min,流量:4~6l/min),继续减压浓缩(真空度-0.08~-0.04mpa,温度70~80℃)至相对密度约1.15~1.22(60℃),趁热加入甜菊糖苷0.1份。取糊精24份,置流化床中,设置进风温度为100℃,当物料温度升至50℃时,开始进液,进液速度控制在100~150r/min,雾化压力外0.2mpa,雾化压力内0.3mpa,喷雾结束,60℃继续干燥1.2h,即得中药复方组合物颗粒。
[0082]
实施例2
[0083]
一种黄芪阴性样品,包括如下重量份数的组分:金银花12份,薄荷4份,紫苏叶12份,防风4份,麦冬8份,陈皮4份,焦六神曲10份,甘草3份。
[0084]
制备方法:以上饮片,加水煎煮2次,第一次加10倍量水,浸泡0.8h,煎煮1.2h,滤过;第二次加12倍量水,煎煮1.2h,滤过,合并两次滤液,减压浓缩(真空度-0.08~-0.04mpa,温度70~80℃)至相对密度约1.08~1.12(60℃),静置,直管式高速离心机离心(转速:16000r/min,流量:4~6l/min),继续减压浓缩(真空度-0.08~-0.04mpa,温度70~80℃)至相对密度约1.15~1.22(60℃),趁热加入甜菊糖苷0.1份。取糊精24份,置流化床中,设置进风温度为100℃,当物料温度升至50℃时,开始进液,进液速度控制在100~150r/min,雾化压力外0.2mpa,雾化压力内0.3mpa,喷雾结束,60℃继续干燥1.2h,即得黄芪阴性样品颗粒。
[0085]
实施例3
[0086]
一种麦冬阴性样品,包括如下重量份数的组分:黄芪10份,金银花12份,薄荷4份,紫苏叶12份,防风4份,陈皮4份,焦六神曲10份,甘草3份。
[0087]
制备方法:以上饮片,加水煎煮2次,第一次加10倍量水,浸泡0.8h,煎煮1.2h,滤过;第二次加12倍量水,煎煮1.2h,滤过,合并两次滤液,减压浓缩(真空度-0.08~-0.04mpa,温度70~80℃)至相对密度约1.08~1.12(60℃),静置,直管式高速离心机离心(转速:16000r/min,流量:4~6l/min),继续减压浓缩(真空度-0.08~-0.04mpa,温度70~80℃)至相对密度约1.15~1.22(60℃),趁热加入甜菊糖苷0.1份。取糊精24份,置流化床中,设置进风温度为100℃,当物料温度升至50℃时,开始进液,进液速度控制在100~150r/min,雾化压力外0.2mpa,雾化压力内0.3mpa,喷雾结束,60℃继续干燥1.2h,即得麦冬阴性样品颗粒。
[0088]
实施例4
[0089]
1性状的研究
[0090]
根据小试样品结果拟定,三批中试样品(批号20210101、20210102和20210103)均与拟定结果描述一致,列入质量控制方法正文,本品为黄棕色至棕褐色颗粒,味甘酸微苦。
[0091]
2黄芪鉴别方法的研究
[0092]
2.1中药复方组合物中黄芪的薄层色谱法鉴别
[0093]
供试品溶液的制备:称取实施例1制备的中药复方组合物颗粒,研磨,称取粉末8g,加水溶解,用饱和正丁醇振摇提取两次,每次20ml,分层,合并有机相正丁醇溶液,用氨试液洗涤2次,分层,弃去水相,有机相正丁醇溶液水浴蒸干,残渣加1ml甲醇溶解,即得。
[0094]
阴性样品溶液的制备:称取实施例2制备的黄芪阴性样品颗粒,研磨,称取粉末8g,加水溶解,用饱和正丁醇振摇提取两次,每次20ml,分层,合并有机相正丁醇溶液,用氨试液洗涤2次,分层,弃去水相,有机相正丁醇溶液水浴蒸干,残渣加1ml甲醇溶解,即得。
[0095]
对照品溶液的制备:称取黄芪甲苷11.40mg,加入甲醇溶解,制成浓度为0.456mg/ml的对照品溶液。
[0096]
点样:分别吸取上述三种溶液各10μl,分别点于同一硅胶g薄层板上。
[0097]
展开剂:(1)以三氯甲烷-甲醇-水(13:7:2)为展开剂展开,分离度较差,斑点不清晰。
[0098]
(2)以三氯甲烷-甲醇-10%氢氧化钠(13:7:2)为展开剂展开,取出,晾干,喷以10wt%硫酸乙醇溶液,加热至斑点显色清晰,置于紫外光灯(366nm)下检视,结果见图1。此方法分离度较好,斑点较清晰,因此以此方法作为黄芪的薄层色谱鉴别,并进行耐用性试验。
[0099]
2.2中药复方组合物中黄芪的薄层色谱法鉴别方法的耐用性考察
[0100]
(1)不同薄层板考察
[0101]
分别取供试品溶液、阴性样品溶液和对照品溶液各10μl,分别点于青岛海洋化工的硅胶g板(批号:20210329),再分别取上述三种溶液各10μl点于安徽良臣硅源材料的硅胶g板(批号:20210320),在同一温湿度条件下,以三氯甲烷-甲醇-10%氢氧化钠(13:7:2)为展开剂展开,取出,晾干,喷以10wt%硫酸乙醇溶液,加热至斑点显色清晰,置于紫外光灯(366nm)下检视,结果见图2和图3,分离清晰,证明该方法对不同的薄层板适应性良好。
[0102]
(2)不同温度考察
[0103]
分别考察在10℃和25℃下,采用上述方法进行黄芪薄层色谱法鉴别的展开情况,结果见图4和图5,两温度下色谱图无明显差异,故该方法对温度的适应性良好。
[0104]
(3)不同湿度考察
[0105]
分别考察32%湿度和72%湿度下,采用上述方法进行黄芪薄层色谱法鉴别的展开情况,结果见图6和图7,两湿度下色谱图无明显差异,因此该方法对湿度的适应性良好。
[0106]
3麦冬鉴别方法的研究
[0107]
3.1中药复方组合物中麦冬的薄层色谱法鉴别
[0108]
供试品溶液的制备:称取实施例1制备的中药复方组合物颗粒,研磨,称取粉末8g,加水溶解,再加入3ml 8wt%盐酸溶液,在100℃下加热回流1h,冷却,用乙醚提取两次,每次20ml,分层,合并有机相乙醚提取液,挥干乙醚,得到的固体加入氯仿1ml溶解,即得。
[0109]
阴性样品溶液的制备:称取实施例3制备的麦冬阴性样品颗粒,研磨,称取粉末8g,加水溶解,再加入3ml 8wt%盐酸溶液,在100℃下加热回流1h,冷却,用乙醚提取两次,每次
20ml,分层,合并有机相乙醚提取液,挥干乙醚,得到的固体加入氯仿1ml溶解,即得。
[0110]
对照品溶液的制备:取麦冬对照药材5g加水50ml,煮沸30min,滤过,滤液浓缩至约20ml,加3ml 8wt%盐酸溶液;随后再向体系中加水40ml溶解,再加入3ml8wt%盐酸溶液,在100℃下加热回流1h,冷却,用乙醚提取两次,每次20ml,分层,合并有机相乙醚提取液,挥干,得到的固体部分加入氯仿1ml溶解,即得。
[0111]
点样:分别吸取上述三种溶液各10μl,分别点于同一硅胶g薄层板上。
[0112]
展开剂:以三氯甲烷-丙酮(8:2)为展开剂展开,取出,晾干,喷以10wt%硫酸乙醇溶液,加热至斑点显色清晰,在日光下检视,结果见图8,分离度较好,斑点较清晰,因此以此方法作为麦冬的薄层鉴别,并进行耐用性试验。
[0113]
3.2中药复方组合物中麦冬的薄层色谱法鉴别方法的耐用性考察
[0114]
(1)不同薄层板考察
[0115]
分别取供试品溶液、阴性样品溶液和对照品溶液各10μl,分别点于青岛海洋化工的硅胶g板(批号:20210329),再取上述三种溶液各10μl点于安徽良臣硅源材料的硅胶g板(批号:20210320),在同一温湿度条件下,以三氯甲烷-丙酮(8:2)为展开剂展开,取出,晾干,喷以10wt%硫酸乙醇溶液,加热至斑点显色清晰,在日光下检视,结果见图9和图10,分离清晰,该方法对不同的薄层板适应性良好。
[0116]
(2)不同温度考察
[0117]
其他条件不变,分别考察10℃和25℃下采用上述方法进行麦冬薄层色谱法鉴别的展开情况,结果见图11和图12,两温度下色谱图无明显差异,因此该方法对温度的适应性良好。
[0118]
(3)不同湿度考察
[0119]
分别考察32%湿度和72%湿度下,采用上述方法进行麦冬薄层色谱法鉴别的展开情况,结果见图13和图14,两湿度下色谱图无明显差异,因此该方法适用于对湿度的适应性良好。
[0120]
4检查
[0121]
4.1粒度
[0122]
照粒度《中华人民共和国药典》2020版四部(通则0982第二法—双筛分法)测定,不能通过一号筛与能通过五号筛的总和不得超过15%,三批中试药品粒度测定见表1。
[0123]
表1三批中试样品粒度测定结果表
[0124][0125]
测定结果表明,三批中试样品的粒度均符合规定。
[0126]
4.2水分
[0127]
照水分测定法(《中华人民共和国药典》2020版四部(通则0832第二法—烘干法)测定,水分不得超过8.0%,三批中试样品水分测定结果见表2。
[0128]
表2三批中试样品水分测定结果表
[0129][0130]
测定结果表明,三批中试样品的水分均符合规定。
[0131]
4.3溶化性
[0132]
照颗粒剂制剂通则(《中华人民共和国药典》2020版通则)“0104颗粒剂”【溶化性】项下“可溶颗粒检查法”检查,应全部溶化或轻微浑浊,三批中试样品溶化性试验结果见表3。
[0133]
表3三批中试样品溶化性检查结果表
[0134][0135]
测定结果表明,三批中试样品的溶化性均符合规定。
[0136]
4.4装量差异
[0137]
照颗粒剂制剂通则(《中华人民共和国药典》2020版四部通则)“0104颗粒剂”【装量差异】项下方法检查,每袋装量与标示装量相比较,超出装量差异限度(
±
5%)的颗粒剂不得多于2袋,并不得有1袋超出装量差异限度(
±
5%)1倍,三批中试样品装量差异检查结果见表4。
[0138]
表4三批中试样品装量差异检查结果
[0139][0140]
结果表明,三批中试样品装量差异检查结果符合规定。
[0141]
5高效液相色谱法测定中药复方组合物颗粒中毛蕊异黄酮葡萄糖苷的含量
[0142]
5.1方法学考察
[0143]
(1)色谱条件
[0144]
色谱柱:agilent porshell 120sb-aq c18(4.6mm
×
100mm,2.7μm);流动相:流动相a相为0.2%磷酸水溶液,流动相b相为乙腈,流动相a相与流动相b相的体积比为80:20,等梯度洗脱;柱温:30℃;流速:1.0ml/min;检测波长:260nm;进样量:10μl;采集时间20min。
[0145]
(2)供试品溶液制备
[0146]
称取实施例1制备的中药复方组合物颗粒1g,精密称定,置10ml容量瓶中,加入适量甲醇,超声15min,放至室温后用甲醇定容至刻度,摇匀,过0.22μm滤膜,即得。
[0147]
(3)阴性样品溶液制备
[0148]
称取实施例2制备的黄芪阴性样品颗粒1g,精密称定,置10ml容量瓶中,加入适量甲醇,超声15min,放至室温后用甲醇定容至刻度,摇匀,过0.22μm滤膜,即得。
[0149]
(4)对照品溶液制备
[0150]
取毛蕊异黄酮葡萄糖苷对照品10mg,精密称定,加入适量甲醇,超声15min,摇匀,
过0.22μm滤膜,制备成每1ml含毛蕊异黄酮葡萄糖苷约1.142mg的对照品溶液。
[0151]
(5)专属性试验
[0152]
分别取供试品溶液、黄芪阴性样品溶液和毛蕊异黄酮葡萄糖苷对照品溶液,按“5.1(1)”项下色谱条件,进样分析,结果见图15,结果表明:毛蕊异黄酮葡萄糖苷在样品中分离度良好,阴性无干扰。
[0153]
(6)标准曲线的绘制
[0154]
取毛蕊异黄酮葡萄糖苷对照品溶液,稀释并配制成含毛蕊异黄酮葡萄糖苷浓度为45.68μg
·
ml-1
的对照品溶液,依次稀释10、20、25、50、100倍,吸取适量,按“5.1(1)”项下色谱条件进行测定。以峰面积值(y)为纵坐标、对照品浓度(x)为横坐标绘制标准曲线,结果见表5。结果表明:毛蕊异黄酮葡萄糖苷回归方程y=30839x+2960.4(r2=0.9999),在0.4568~45.68μg
·
ml-1
浓度范围下线性关系良好,毛蕊异黄酮葡萄糖苷含量测定标准曲线线性图见图16。
[0155]
表5线性结果试验表
[0156][0157][0158]
(7)精密度试验
[0159]
取含毛蕊异黄酮葡萄糖苷28.15μg
·
ml-1
对照品溶液,按“5.1(1)”项下色谱条件进行测定,连续进样6次,记录峰面积值,结果见表6。结果表明:rsd=0.17%,小于3%,仪器精密度良好。
[0160]
表6精密度试验结果表
[0161][0162]
(8)重复性试验
[0163]
同一批号(20210103)中药复方组合物颗粒,取0.3g,共6份,精密称定,按“5.1(2)”项下方法制备供试品溶液,分别进样,记录峰面积值,见表7。结果表明:重复性rsd=1.33%,小于3%,样品重复性良好。
[0164]
表7重复性试验结果表
[0165][0166]
(9)稳定性实验
[0167]
取“(8)重复性试验”中的同一供试品溶液,于0、2、4、8、12、24h分别进样,计算峰面积值,结果见表8。结果表明:稳定性rsd=2.61%,小于3%,样品在24h时间内稳定性良好。
[0168]
表8稳定性试验结果表
[0169][0170][0171]
(10)加样回收试验
[0172]
称取已知含量的中药复方组合物颗粒(批号20210103)0.2g,精密称定,共6份,分别加入精密量取的含毛蕊异黄酮葡萄糖苷28.15μg
·
ml-1
的对照品溶液1ml,置10ml容量瓶中,加入适量甲醇,超声15min,放至室温后用甲醇定容至刻度,摇匀,过0.22μm滤膜,得到的溶液,分别进样,记录峰面积值,计算加样回收率,结果见表9。
[0173]
表9加样回收试验表
[0174][0175]
5.2三批中试样品中毛蕊异黄酮葡萄糖苷的含量测定
[0176]
表10中试样品中毛蕊异黄酮葡萄糖苷的含量测定数据表
[0177][0178]
6微生物限度检查
[0179]
供试液的制备:称取实施例1制备的中药复方组合物颗粒10g,加胰酪大豆胨液体培养基至100ml,振摇均匀,作为0.1g/ml供试液,备用。
[0180]
6.1需氧菌、霉菌及酵母菌计数
[0181]
6.1.1需氧菌计数
[0182]
6.1.1.1细菌数测定:
[0183]
吸取0.1g/ml供试液1ml于无菌平皿中,平行制备2个平皿,立即倾注15~20ml温度不超过45℃胰酪大豆胨琼脂培养基,混匀,凝固,30~35℃倒置培养3天,计数。
[0184]
6.1.1.2阴性对照:
[0185]
取同批次配制的胰酪大豆胨液体培养基1ml,置无菌平皿中,平行制备2个平板,立即倾注15~20ml温度不超过45℃胰酪大豆胨琼脂培养基,混匀,凝固,30~35℃倒置培养3天,不得有菌生长。
[0186]
6.1.2霉菌及酵母菌计数
[0187]
6.1.2.1霉菌及酵母菌计数测定:
[0188]
吸取0.1g/ml供试液于1ml平皿中,平行制备2个平皿,立即倾注15~20ml温度不超过45℃沙氏葡萄糖琼脂培养基,混匀,凝固,20~25℃倒置培养5天,计数。
[0189]
6.1.2.2阴性对照:
[0190]
取同批次配制的胰酪大豆胨液体培养基1ml,置无菌平皿中,平行制备2个平板,立即倾注15~20ml温度不超过45℃沙氏葡萄糖琼脂培养基,混匀,凝固,20~25℃倒置培养5天,不得有菌生长。
[0191]
6.2控制菌检查
[0192]
大肠埃希菌检查:取0.1g/ml供试液10ml,加入100ml胰酪大豆胨液体培养基中,经30~35℃培养24小时后,若有菌生长,再取此培养液1ml于100ml的麦康凯液体培养基中于42~44℃培养48小时,划线接种于麦康凯琼脂培养基平板上以确定是否染菌。
[0193]
阴性对照:取同批次配制的胰酪大豆胨液体培养基10ml,按样品检查,不得有菌生长,具体实验结果见表11。
[0194]
表11中药复方组合物中微生物限度检查结果
[0195]
[0196]
微生物限度检查结果表明,三批中试样品的微生物限度符合要求。
[0197]
实施例5:利用碳粒廓清法测定吞噬指数及吞噬系数以观察中药复方组合物对小鼠单核巨噬细胞吞噬功能的影响。
[0198]
一种中药复方组合物对小鼠单核巨噬细胞吞噬功能的影响如下:
[0199]
1材料
[0200]
1.1实验用药物及试剂
[0201]
中药复方组合物:按照实施例1的方法由江苏省中医院制剂部制备。
[0202]
感冒浸膏:根据参考文献cn981247695中的处方,感冒浸膏的组分包括苏叶120g,薄荷120g,藿香120g,防风120g,荆芥120g,苍术120g,黄芪120g,双花144g,甘草36g,常规煎煮制备得到感冒浸膏,由江苏省中医院制剂部制备。
[0203]
盐酸左旋咪唑片:桂林南药,批号:zx200802
[0204]
碳酸钠:上海韶远试剂有限公司,批号:r20090512
[0205]
印度墨汁:雷根生物批号:0413a22
[0206]
玉屏风口服液:江苏聚荣制药集团有限公司,批号:21081801
[0207]
2实验方法
[0208]
取健康icr小鼠70只,体重18~22g,随机分成7组,每组10只。
[0209]
(1)生理盐水组:等量生理盐水,0.2ml/10g;
[0210]
(2)盐酸左旋咪唑组(相当于人用中剂量组):40mg/kg,即0.2ml/10g(配成的溶液是2mg/ml);
[0211]
(3)玉屏风组(相当于人用中剂量组):9.1ml/kg,即0.091ml/10g;
[0212]
(4)中药复方组合物低剂量组:7.28g生药/kg,即0.2ml/10g(配成的溶液是0.364g生药/ml);
[0213]
(5)中药复方组合物中剂量组:14.56g生药/kg,即0.2ml/10g(配成的溶液是0.728g生药/ml);
[0214]
(6)中药复方组合物高剂量组:29.12g生药/kg,即0.2ml/10g(配成的溶液是1.456g生药/ml);
[0215]
(7)感冒浸膏(相当于低剂量组):3.64g浸膏/kg,即0.2ml/10g(配成的溶液是14.56g浸膏配成80ml)。
[0216]
以上各组按照上述剂量灌胃给药,每天灌胃1次,连续10天,末次给药后1h,每只小鼠尾静脉注射用生理盐水稀释成5倍的印度墨汁0.1ml/10g鼠重,与注射后1min及12min分别从眼眶后静脉丛取血20ul,立即注入2ml 0.1%na2co3溶液中摇匀,680nm处测吸光度值,随后处死小鼠取肝脾称重,计算吞噬指数k及吞噬系数α。
[0217]
其中,吞噬指数k及吞噬系数α分别按下列公式计算:
[0218]
k=(lgc1~lgc2)/(t2~t1)
[0219][0220]
c:血中碳粒浓度(以吸光度值直接表示)
[0221]
t:时间
[0222]
w:体重
[0223]
wls:肝脾合重
[0224]
3结果
[0225]
表12中药复方组合物对小鼠单核巨噬细胞吞噬功能的影响
[0226][0227][0228]
与生理盐水组比较,
*
为p<0.05,
**
为p<0.01。
[0229]
4结论
[0230]
(1)α值:生理盐水组最低,中药复方组合物高剂量、中剂量组均高于玉屏风组(相当于中剂量)、左旋咪唑组(相当于中剂量),中药复方组合物低剂量组高于左旋咪唑组、感冒浸膏组(相当于低剂量);其中,中药复方组合物中剂量组大于中药复方组合物高剂量组、中药复方组合物低剂量组。
[0231]
k值:生理盐水组最低,中药复方组合物中剂量、高剂量均高于玉屏风组、左旋咪唑组,低剂量组高于左旋咪唑组、感冒浸膏组。其中,中药复方组合物中剂量组大于高剂量组、低剂量组。
[0232]
(2)其中k值和α值:
[0233]
中药复方组合物低剂量组、感冒浸膏组、左旋咪唑组与生理盐水组相比,α值具有统计学差异。
[0234]
玉屏风组、中药复方组合物高剂量、中药复方组合物中剂量与生理盐水组相比,α值具有显著性差异。
[0235]
玉屏风组、中药复方组合物高剂量组与生理盐水组相比,k值具有统计学差异。
[0236]
中药复方组合物中剂量组与生理盐水组相比,k值具有显著性差异。
[0237]
巨噬细胞吞噬活性是机体最重要的抗感染防御能力之一。中药复方组合物中剂量组对巨噬细胞吞噬活性有显著的促进作用,因此对机体上呼吸道感染可起到一定的防御作用。
[0238]
实施例6:观察防感颗粒对二硝基氯苯(dncb)所致小鼠耳迟发型超敏反应的影响
[0239]
一种中药复方组合物对小鼠dncb诱导的迟发型超敏反应的影响如下:
[0240]
1材料
[0241]
1.1实验用药物及试剂
[0242]
中药复方组合物:按照实施例1的方法由江苏省中医院制剂部提供。
[0243]
盐酸左旋咪唑片:桂林南药,批号:zx200802
[0244]
玉屏风口服液:江苏聚荣制药集团有限公司批号:21081801
[0245]
感冒浸膏:根据参考文献cn981247695中的处方,感冒浸膏的组分包括苏叶120g,薄荷120g,藿香120g,防风120g,荆芥120g,苍术120g,黄芪120g,双花144g,甘草36g,常规煎煮制备得到感冒浸膏,由江苏省中医院制剂部制备。
[0246]
二硝基氯苯:厂家:麦克林,批号:c13229208
[0247]
丙酮:上海久亿化学试剂有限公司,批号:2016032901
[0248]
2实验方法及结果
[0249]
取健康icr小鼠70只,体重18~22g,随机分成7组,每组10只。
[0250]
(1)生理盐水组:等量生理盐水,0.2ml/10g;
[0251]
(2)盐酸左旋咪唑组(相当于人用中剂量组):40mg/kg,即0.2ml/10g(配成的溶液是2mg/ml);
[0252]
(3)玉屏风组(相当于人用中剂量组):9.1ml/kg,即0.091ml/10g;
[0253]
(4)中药复方组合物低剂量组:7.28g生药/kg,即0.2ml/10g(配成的溶液是0.364g生药/ml);
[0254]
(5)中药复方组合物中剂量组:14.56g生药/kg,即0.2ml/10g(配成的溶液是0.728g生药/ml);
[0255]
(6)中药复方组合物高剂量组:29.12g生药/kg,即0.2ml/10g(配成的溶液是1.456g生药/ml);
[0256]
(7)感冒浸膏(相当于中剂量组):7.28g浸膏/kg,即0.2ml/10g(配成的溶液是29.12g浸膏配成80ml)。
[0257]
以上各组按照上述剂量灌胃给药,连续给药10天。于给药5天后,脱去小鼠腹部皮肤毛,面积约1cm2,并均匀涂布1%dncb丙酮溶液50ul致敏,次日同法强化一次。末次给药后,30min后,各组小鼠右耳两面均匀涂布1%dncb丙酮溶液20ul攻击,20小时后,小鼠拉颈处死,剪下小鼠左右两耳,用直径为8mm的打孔器打下同部位左右耳片,称重,以小鼠左右耳片重量差的mg数作为小鼠耳迟发型超敏反应的强度。
[0258]
3结果
[0259]
表13中药复方组合物对小鼠dncb诱导的迟发型超敏反应的影响
[0260] 肿胀度肿胀抑制率生理盐水组0.0049
±
0.0013—玉屏风组0.0024
±
0.0006
**
52.41%感冒浸膏0.0031
±
0.0008
**
36.96%左旋组0.0024
±
0.0005
**
50.89%中药复方组合物高剂量0.0033
±
0.0013
*
32.41%中药复方组合物中剂量0.0017
±
0.0006
**
65.32%
※※
中药复方组合物低剂量0.0034
±
0.0015
*
31.65%
[0261]
与生理盐水组比较,
*
为p<0.05,
**
为p<0.01;与感冒浸膏组比,
※※
为p<0.01。
[0262]
4结论
[0263]
各组肿胀度均低于生理盐水组,与生理盐水组比较,玉屏风组、感冒浸膏组、左旋组和中药复方组合物中剂量组均有显著性差异,中药复方组合物高剂量组、中药复方组合
物低剂量组有统计学差异(p<0.05)。中药复方组合物中剂量组的肿胀抑制率高于感冒浸膏组,两组数据相比,具有显著性差异(p<0.01)。
[0264]
结果在致敏前至激发后全程给药的情况下,中药复方组合物组对二硝基氯苯所致小鼠迟发性超敏反应有显著抑制作用,且中药复方组合物中剂量组的抑制率显著高于感冒浸膏组。
[0265]
迟发型超敏反应是小分子半抗原二硝基氯苯涂于皮肤上,可透过上皮而与角蛋白及胶原蛋白结合成为全抗原,并刺激t淋巴细胞转化为致敏淋巴细胞,再分布于全身皮肤内。实验结果表明,中药复方组合物组对二硝基氯苯所致小鼠迟发性超敏反应有显著抑制作用,说明药物或者通过抑制半抗原与胶原蛋白结合成全抗原,或者通过抑制t淋巴细胞转为致敏淋巴细胞的,或者通过抑制致敏淋巴细胞在全身分布,最终抑制全身分布的致敏淋巴细胞的数量,发挥免疫调节作用而减少超敏反应发生的程度。而上呼吸道感染多数情况血中淋巴细胞上升,并伴随淋巴细胞上升而有一系列感冒症状,药物可通过调节免疫作用,也或可能会调节上呼吸道的免疫分子,从而起到防治上呼吸道感染的作用。
[0266]
本发明提供了一种中药复方组合物的质量检测方法的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1