糖化血红蛋白校准品及其制备方法与应用与流程
1.本发明涉及生物医学领域,尤其涉及糖化血红蛋白校准品及其制备方法与应用。
背景技术:
2.糖化蛋白质中,例如,血液中的糖化血红蛋白(hblac),由于反映了生物中血糖值的过去的情况,因此被作为糖尿病诊断和治疗等的重要指标。
3.糖化血红蛋白(hblac)是血红蛋白的一种形式,其被测量主要用以鉴定一段时间内患者的液体测试样品(例如,通过实例的方式,患者的全血样品)中存在的平均葡萄糖浓度。糖化血红蛋白通过由血红蛋白暴露于血浆葡萄糖而产生的非酶促机制形成。随着葡萄糖的平均量随时间增加,糖化血红蛋白的百分比也增加。这种关系允许糖化血红蛋白充当在血红蛋白样本收集前(通常)两至三个月的时段内,患者的平均血液葡萄糖水平的标志物。对于没有糖尿病的个体,糖化血红蛋白的正常范围小于总血红蛋白计数的约5.6%。大于总血红蛋白水平计数的5.6%和小于总血红蛋白计数的6.4%的糖化血红蛋白水平表明糖尿病风险增加,而大于总血红蛋白计数的约6.4%的糖化血红蛋白水平表明糖尿病风险增加,而大于总血红蛋白计数的6.4%的糖化血红蛋白水平表明存在糖尿病。由于由糖尿病的存在引起的并发症的严重程度,临床上期望将患有这种疾病的患者中的糖化血红蛋白水平管控至小于总血红蛋白计数的约7%。与空腹血浆葡萄糖水平或口服葡萄糖超负载相比,使用糖化血红蛋白作为糖尿病和前驱糖尿病的诊断标准提供了几个优点,包括:(i)更好的总体血糖暴露指数;(ii)增加结构稳定性;和(iii)由例如膳食状态和/或急性压力引起的变异性较小。
4.糖化血红蛋白是一种蛋白分子,其中血红蛋白的β-亚基的n-末端缬氨酸残基已被血液葡萄糖修饰。校准物是具有已知浓度的标准或参考材料,其用于标准化或校准诊断程序和/或仪器。使用对照材料来确保诊断测定程序和/或仪器适当地运行。
5.校准物和/或校准材料通常以预定义的时间间隔运行,并且当诊断测定仪器中存在变化和/或改变时,诸如在仪器服务期间,当试剂批次变化时,或者每当从诊断测定获得的结果看起来有问题和/或超出临床范围时。通过分析校准物和/或校准材料且然后将从测试样品获得的观察值与所述校准品和/或校准材料的已知值进行比较,可以监测和/或计算诊断测定鉴定目标分析物的性能。已知值由校准物和/或校准材料的可接受值的范围和/或上限和/或下限代表。当从进行至少一种诊断测定产生的,从患者的液体测试样品获得的值落在控制限值内时,使用者可以确信从分析方法和/或诊断测定获得的结果正确地发挥功能。然而,当观察到的结果落在控制限值外时,应当提醒使用者获得的分析结果可能不准确。在制备校准物、校准材料和对照时,此类校准物、校准材料和对照在组成上应当尽可能接近于所测定的样本,因为它们用于监测诊断程序和/或仪器的可靠性并使不正确测试结果的报告最少。
6.目前市售的校准品中,几乎都忽略了对于体外糖化的血红蛋白的保护作用,而由于糖化血红蛋白存在会导致易氧化及进一步糖基化的缺陷,市场上现有的校准品复溶后稳
定性差;且现有的冻干技术中,多数使用甘露醇作为赋形剂进行冻干,但是甘露醇在冻干过程中会逐步形成针状结晶物,这种针状结晶物质会刺伤蛋白,使糖化血红蛋白稳定性下降;因此糖化血红蛋白的准确测定需要一个更稳定的校准品。
技术实现要素:
7.有鉴于此,本发明要解决的技术问题在于提供糖化血红蛋白校准品及其制备方法与应用,本发明通过与血红蛋白竞争未完全透析出去的葡萄糖、防止其进一步糖基化,最终提高校准品的稳定性。
8.本发明提供了葡萄糖氧化酶和/或塔格糖在制备糖化血红蛋白校准品中的应用。
9.本发明条件下,葡萄糖氧化酶会迅速消耗校准品中剩余的葡萄糖,使血红蛋白可利用的残留葡萄糖极少、不再与残留的葡萄糖进一步反应,从而起到对血红蛋白的保护作用。本发明使用塔格糖作为赋形剂,其在本发明的体系中在冻干过程中不会刺伤蛋白,而且不会被微生物所利用,使糖化血红蛋白在储存过程中处在稳定的状态,从而提高了糖化血红蛋白的稳定性。
10.本发明复溶稳定性检测数据表明,在校准品中添加甘露醇作为赋形剂时,校准品复溶后会逐步降低;在校准品中将甘露醇更换为塔格糖,仅能在一定程度上保护校准品的稳定性,但由于校准品中残留部分葡萄糖,血红蛋白会进一步糖基化,导致测值不断升高;当将校准品中的甘露醇替换为塔格糖、并且使用葡萄糖氧化酶消耗未完全透析出去的葡萄糖时,校准品的复溶稳定性良好;校准品稳定性达到最佳稳定效果。
11.37℃热稳定性测试数据表明,在校准品中仅添加塔格糖时,仅能保证校准品不会升高;当在校准品中添加葡萄糖氧化酶和塔格糖时,校准品才处在一个完全稳定的状态。
12.4℃实时稳定性测试数据表明,在校准品中添加甘露醇作为赋形剂,校准品测值会持续下降;当校准品中添加塔格糖作为赋形剂,校准品不再呈下降趋势;当校准品中添加葡萄糖氧化酶和塔格糖,校准品的稳定性合格,效果最好。
13.本发明添加的赋形剂包括:二硫苏糖醇、氯化钠、葡萄糖氧化酶和/或塔格糖,可以避免糖化血红蛋白的氧化反应与进一步糖基化反应;先使用葡萄糖氧化酶与血红蛋白竞争葡萄糖,葡萄糖氧化酶会与未完全与血红蛋白反应的葡萄糖迅速发生反应,形成δ-葡萄糖酸内酯,δ-葡萄糖酸内酯以非酶促反应自身水解为葡萄糖酸,血红蛋白可利用的葡萄糖极少,从而保证糖化血红蛋白浓度不会升高,处在一个稳定的状态。在冻干保护液中加入塔格糖,去掉其他的赋形剂,包括但不限于蔗糖、甘露醇、海藻糖等;在冻干液中加入塔格糖而不使用甘露醇等,是考虑到塔格糖在冻干的过程中不会刺伤蛋白,而且塔格糖不会被微生物所利用,从而保证糖化血红蛋白在冻干、储存过程中不会降低。
14.本发明还提供了糖化血红蛋白校准品,所述糖化血红蛋白校准品由以下组分制得:血红蛋白、糖基化反应液、透析液和血红蛋白稀释液;
15.所述糖基化反应液包括水、氯化钠和葡萄糖;
16.所述透析液包括磷酸盐缓冲液、氯化钠和叠氮化钠;
17.所述血红蛋白稀释液包括甘氨酸缓冲液、氯化钠、二硫苏糖醇、乙二胺四乙酸二钠、塔格糖、叠氮化钠和葡萄糖氧化酶。
18.本发明所述的糖化血红蛋白校准品中,所述血红蛋白糖基化反应液包括:水、6g/l
~9g/l氯化钠和浓度分别为50mm、100mm、150mm、300mm、500mm葡萄糖;
19.所述透析液包括:20mm~200mm磷酸盐缓冲液、6~9g/l氯化钠和0.1wt%~5wt%叠氮化钠;
20.所述血红蛋白稀释液包括:20mm~200mm甘氨酸缓冲液、6~9g/l氯化钠、20mm~200mm二硫苏糖醇、0.1mm~10mm乙二胺四乙酸二钠、20mm~200mm塔格糖、0.1%~5%叠氮化钠和5%~15%葡萄糖氧化酶。
21.一些实施例中,本发明所述的糖化血红蛋白校准品中,所述血红蛋白糖基化反应液包括:水、9g/l氯化钠和50mm、100mm、150mm、300mm、500mm葡萄糖;
22.所述透析液包括:200mm磷酸盐缓冲液、9g/l氯化钠和0.5wt%叠氮化钠;
23.所述血红蛋白稀释液包括:200mm甘氨酸缓冲液、9g/l氯化钠、200mm二硫苏糖醇、10mm乙二胺四乙酸二钠、200mm塔格糖、0.5%叠氮化钠和10%葡萄糖氧化酶。
24.一些具体实施例中,本发明所述的糖化血红蛋白校准品中,所述血红蛋白糖基化反应液包括:水、9g/l氯化钠和50mm、100mm、150mm、300mm、500mm葡萄糖;
25.所述透析液包括:200mm磷酸盐缓冲液、9g/l氯化钠和0.5wt%叠氮化钠;
26.所述血红蛋白稀释液包括:200mm甘氨酸缓冲液、9g/l氯化钠、200mm二硫苏糖醇、10mm乙二胺四乙酸二钠、200mm塔格糖、0.5%叠氮化钠和10%葡萄糖氧化酶。本实施例同时添加塔格糖和葡萄糖氧化酶,在本发明提供的体系中,可以保证葡萄糖氧化酶会与未完全与血红蛋白反应的葡萄糖迅速发生反应,形成δ-葡萄糖酸内酯,δ-葡萄糖酸内酯以非酶促反应自身水解为葡萄糖酸,血红蛋白可利用的葡萄糖极少,从而保证糖化血红蛋白浓度不会升高;使用塔格糖作为赋形剂,塔格糖在冻干过程中不会刺伤蛋白,而且塔格糖不会被微生物所利用,使糖化血红蛋白在储存过程中处在一个稳定的状态。从而保证糖化血红蛋白的稳定性。200mm塔格糖和10%葡萄糖氧化酶是达到最佳稳定性的最佳配比,在此浓度下,一是校准品的复溶稳定性检测的偏差最小,证明稳定性最好;二是37℃热稳定性测试中,此浓度下校准品偏差较小,证明在37℃下校准品热稳定性较好;三是在4℃实时稳定性测试中,此浓度下的校准品偏差较小,说明在4℃是时,校准品稳定性较好。
27.本发明所述的糖化血红蛋白校准品中,所述糖化血红蛋白校准品的ph为6~8。
28.本发明还提供了制备所述的糖化血红蛋白校准品的方法,其包括:
29.步骤1:将不同的葡萄糖浓度配制成的糖基化反应液与血红蛋白混合,经糖基化反应制得含有糖化血红蛋白的溶液,离心除去沉淀,留取上清液a1,a2,a3,a4,a5;
30.步骤2:将所述上清液a1,a2,a3,a4,a5分别于不同的容器经透析去除葡萄糖,离心取上清液b1,b2,b3,b4,b5;
31.步骤3:将所述上清液b1,b2,b3,b4,b5用血红蛋白稀释液稀释后经冻干、复溶制得所述糖化血红蛋白校准品。
32.本发明所述的方法中,所述步骤1中的反应液包括:水、氯化钠和葡萄糖;所述血红蛋白浓度为每分升反应液中血红蛋白含量为1~40克;所述糖基化的温度为15℃~45℃,时间为1~10天。
33.本发明所述的方法中,所述步骤2中的透析包括使用透析液,所述透析液包括:水、磷酸盐缓冲液、氯化钠和叠氮化钠;所述透析液和上清液的体积比为1000:1;所述透析的温度为1℃~6℃。
34.本发明所述的方法中,所述步骤3中的血红蛋白稀释液包括甘氨酸缓冲液、氯化钠、二硫苏糖醇、乙二胺四乙酸二钠、塔格糖、叠氮化钠和葡萄糖氧化酶;所述冻干包括低温预冻和冷冻干燥的步骤:
35.所述低温预冻条件包括:于-50℃至-90℃,预冻3小时以上将溶液冷冻成型;
36.所述冷冻干燥包括:第一次干燥阶段的升温速度采用3℃~10℃/每小时,持续20~35小时;第二次干燥阶段的升温速度采用20℃~25℃/每小时,持续5~10小时。
37.本发明所述的方法中,所述糖化血红蛋白校准品的浓度包括4.8%、6.8%、8.8%、10.8%和13.8%。
38.本发明描述的糖化血红蛋白校准品制备方法具有较强的稳定性,其中第一个关键点在于使用葡萄糖氧化酶消耗葡萄糖,葡萄糖氧化酶会迅速消耗剩余的葡萄糖,使血红蛋白可利用的残留葡萄糖极少、不再与残留的葡萄糖进一步反应,从而起到保护作用;第二个技术关键点为如何保护被糖基化的血红蛋白不持续衰减;目前市面上统一认为,将糖化血红蛋白校准品制作成冻干粉会较其液态形式稳定,但是无法规避冻干这个过程对糖化血红蛋白带来的衰减;本发明提供了一种新的赋形剂塔格糖,在低温环境下对糖化血红蛋白的保护作用。
39.本发明还提供了校准糖化血红蛋白的检测仪器或程序的方法,其包括使用所述的糖化血红蛋白校准品和/或使用所述的方法制得的糖化血红蛋白校准品对诊断程序和/或仪器进行标准化或校准。
40.本发明基于现存技术中体外将血红蛋白进行糖基化来制备校准品的方法,由于无法确定糖化血红蛋白在经过透析后,多余的葡萄糖是否被完全透析出来了,所以无法保证血红蛋白不会在制备成校准品上市以后仍会进一步进行糖基化反应。本发明对体外糖化的血红蛋白起到了保护作用,克服了糖化血红蛋白的易氧化及进一步糖基化的缺陷,本发明提供的葡萄糖氧化酶会与之前未完全与血红蛋白反应的葡萄糖迅速发生反应形成δ-葡萄糖酸内酯,δ-葡萄糖酸内酯以非酶促反应自身水解为葡萄糖酸,此后血红蛋白可利用的葡萄糖极少,从而保证校准品糖化血红蛋白浓度不会升高;在现有的冻干技术中,多数使用甘露醇作为赋形剂进行冻干,但甘露醇在冻干过程中会逐步形成针状结晶物,这种针状结晶物质会刺伤蛋白,使糖化血红蛋白稳定性下降;本发明使用塔格糖作为赋形剂,其在冻干过程中不会刺伤蛋白,而且不会被微生物所利用,使糖化血红蛋白在储存过程中处在稳定的状态,从而提高了糖化血红蛋白的稳定性;因此本发明提供的校准品复溶后稳定性高、准确性好具有良好的工业生产和临床应用前景。
附图说明
41.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图:
42.图1示实施例1的高效液相色谱;
43.图2示实施例2的高效液相色谱;
44.图3示实施例3的高效液相色谱;
45.图4示糖化血红蛋白校准品的浓度为4.8%的校准品复溶稳定性检测;
46.图5示糖化血红蛋白校准品的浓度为6.8%的校准品复溶稳定性检测;
47.图6示糖化血红蛋白校准品的浓度为8.8%的校准品复溶稳定性检测;
48.图7示糖化血红蛋白校准品的浓度为10.8%的校准品复溶稳定性检测;
49.图8示糖化血红蛋白校准品的浓度为13.8%的校准品复溶稳定性检测;
50.图9示糖化血红蛋白校准品的浓度为4.8%,37℃的校准品热稳定性测试;
51.图10示糖化血红蛋白校准品的浓度为6.8%,37℃的校准品热稳定性测试;
52.图11示糖化血红蛋白校准品的浓度为8.8%,37℃的校准品热稳定性测试;
53.图12示糖化血红蛋白校准品的浓度为10.8%,37℃的校准品热稳定性测试;
54.图13示糖化血红蛋白校准品的浓度为13.8%,37℃的校准品热稳定性测试;
55.图14示糖化血红蛋白校准品的浓度为4.8%,4℃的校准品实时稳定性测试;
56.图15示糖化血红蛋白校准品的浓度为6.8%,4℃的校准品实时稳定性测试;
57.图16示糖化血红蛋白校准品的浓度为8.8%,4℃的校准品实时稳定性测试;
58.图17示糖化血红蛋白校准品的浓度为10.8%,4℃的校准品实时稳定性测试;
59.图18示糖化血红蛋白校准品的浓度为13.8%,4℃的校准品实时稳定性测试。
具体实施方式
60.本发明提供了糖化血红蛋白校准品及其制备方法与应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
61.本发明主要提供了一种稳定糖化血红蛋白方法,通过添加其他物质与血红蛋白竞争未完全透析出去的葡萄糖、防止其进一步糖基化,最终提高校准品的稳定性。
62.首先对葡萄糖和血红蛋白进行15℃~45℃热处理,使血红蛋白进行糖基化反应,离心去沉淀,取上清液;将上清液进行透析;使用二硫苏糖醇、氯化钠、葡萄糖氧化酶和塔格糖,将透析后的血红蛋白上清液进行稀释;添加二硫苏糖醇、氯化钠、葡萄糖氧化酶和塔格糖,从而避免糖化血红蛋白的氧化反应与进一步糖基化反应,且塔格糖不会被微生物所利用,保证糖化血红蛋白的稳定性;
63.1)先在5个不同的反应液中加入血红蛋白,使每分升反应液中血红蛋白含量为1克~40克,在15℃~45℃下糖基化反应1天~10天后,离心除去沉淀,留取上清液,其中所述反应液成分为:
64.反应液1:
65.氯化钠:6~9g/l;
66.葡萄糖:50mm;
67.其中上述溶剂为水。
68.反应液2:
69.氯化钠:6~9g/l;
70.葡萄糖:100mm;
71.其中上述溶剂为水。
72.反应液3:
73.氯化钠:6~9g/l;
74.葡萄糖:150mm;
75.其中上述溶剂为水。
76.反应液4:
77.氯化钠:6~9g/l;
78.葡萄糖:300mm;
79.其中上述溶剂为水。
80.反应液5:
81.氯化钠:6~9g/l;
82.葡萄糖:500mm;
83.其中上述溶剂为水。
84.2)将步骤1)中制备的上清液装入透析袋,置于4℃透析液透析至完全除去葡萄糖,离心取上清液,其中所述透析液成分为:
85.磷酸盐缓冲液:20mm~200mm,ph 7.0~7.5;
86.氯化钠:6g/l~9g/l;
87.叠氮化钠:0.1wt%~5wt%;
88.其中上述溶剂为水。
89.3)将步骤2)中制备的上清液用血红蛋白稀释液进行100:1稀释(血红蛋白稀释液为100,上清液为1),然后进行低温预冻,冷冻干燥,制成冻干粉,最后将冻干粉复溶、分装。其中所述透析液成分为:
90.甘氨酸缓冲液:20mm~200mm,ph 7.0~7.5;
91.氯化钠:6g/l~9g/l;
92.二硫苏糖醇:20mm~200mm;
93.乙二胺四乙酸二钠:0.1mm~10mm;
94.塔格糖:20mm~200mm;
95.叠氮化钠:0.1%~5%;
96.葡萄糖氧化酶:5%~15%。
97.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
98.对比例1
99.糖化血红蛋白校准品,其制备方法为:
100.1)先在反应液中加入血红蛋白,使每分升反应液中血红蛋白含量为1~40克,在15℃~45℃下糖基化反应7天后,离心除去沉淀,留取上清液,其中所述反应液成分为:
101.反应液1:
102.氯化钠:6~9g/l;
103.葡萄糖:50mm;
104.其中上述溶剂为水。
105.反应液2:
106.氯化钠:6~9g/l;
107.葡萄糖:100mm;
108.其中上述溶剂为水。
109.反应液3:
110.氯化钠:6~9g/l;
111.葡萄糖:150mm;
112.其中上述溶剂为水。
113.反应液4:
114.氯化钠:6~9g/l;
115.葡萄糖:300mm;
116.其中上述溶剂为水。
117.反应液5:
118.氯化钠:6~9g/l;
119.葡萄糖:500mm;
120.其中上述溶剂为水。
121.2)将步骤1)中制备的上清液装入透析袋,置于4℃透析液透析至完全除去葡萄糖,离心取上清液,其中所述透析液成分为:
122.磷酸盐缓冲液:200mm,ph 7.5
123.氯化钠:9g/l
124.叠氮化钠:0.5%
125.其中上述溶剂为水;
126.3)将步骤2)中制备的上清液用血红蛋白稀释液进行100:1稀释(血红蛋白稀释液为100,上清液为1),然后进行低温预冻,冷冻干燥,制成冻干粉,最后将冻干粉复溶、分装。其中所述血红蛋白稀释液成分为:
127.甘氨酸缓冲液:200mm,ph 7.5
128.氯化钠:9g/l
129.二硫苏糖醇:200mm
130.乙二胺四乙酸二钠:10mm
131.甘露醇:200mm
132.叠氮化钠:0.5%
133.其中所述低温预冻条件为:
134.在-50℃至-90℃的条件下,预冻3小时以上将溶液冷冻成型。
135.其中所述冷冻干燥条件为:
136.第一次干燥阶段的升温速度采用3℃~10℃每小时,持续20~35小时,第二次干燥阶段的升温速度采用20℃~25℃每小时,持续5~10小时。
137.对比例2
138.将对比例1中赋形剂替换为塔格糖的糖化血红蛋白校准品:
139.1)先在反应液中加入血红蛋白,使每分升反应液中血红蛋白含量为1~40克,在15℃~45℃下糖基化反应1~10天后,离心除去沉淀,留取上清液,其中所述反应液成分为:
140.反应液1:
141.氯化钠:6~9g/l;
142.葡萄糖:50mm;
143.其中上述溶剂为水。
144.反应液2:
145.氯化钠:6~9g/l;
146.葡萄糖:100mm;
147.其中上述溶剂为水。
148.反应液3:
149.氯化钠:6~9g/l;
150.葡萄糖:150mm;
151.其中上述溶剂为水。
152.反应液4:
153.氯化钠:6~9g/l;
154.葡萄糖:300mm;
155.其中上述溶剂为水。
156.反应液5:
157.氯化钠:6~9g/l;
158.葡萄糖:500mm;
159.其中上述溶剂为水。
160.2)将步骤1)中制备的上清液装入透析袋,置于4℃透析液透析至完全除去葡萄糖,离心取上清液,其中所述透析液成分为:
161.磷酸盐缓冲液:200mm,ph 7.5
162.氯化钠:9g/l
163.叠氮化钠:0.5%
164.其中上述溶剂为水;
165.3)将步骤2)中制备的上清液用血红蛋白稀释液进行100:1稀释(血红蛋白稀释液为100,上清液为1),然后进行低温预冻,冷冻干燥,制成冻干粉,最后将冻干粉复溶、分装。其中所述血红蛋白稀释液成分为:
166.甘氨酸缓冲液:200mm,ph 7.5
167.氯化钠:9g/l
168.二硫苏糖醇:200mm
169.乙二胺四乙酸二钠:10mm
170.塔格糖:200mm
171.叠氮化钠:0.5%
172.其中所述低温预冻条件为:
173.在-50℃至-90℃的条件下,预冻3小时以上将溶液冷冻成型。
174.其中所述冷冻干燥条件为:
175.第一次干燥阶段的升温速度采用3℃~10℃每小时,持续20~35小时,第二次干燥阶段的升温速度采用20℃~25℃每小时,持续5~10小时。
176.实施例1
177.将对比例1中赋形剂替换为塔格糖、并添加葡萄糖氧化酶的糖化血红蛋白校准品:
178.1)先在反应液中加入血红蛋白,使每分升反应液中血红蛋白含量为40克,在15℃~45℃下糖基化反应7天后,离心除去沉淀,留取上清液,其中所述反应液成分为:
179.反应液1:
180.氯化钠:6~9g/l;
181.葡萄糖:50mm;
182.其中上述溶剂为水。
183.反应液2:
184.氯化钠:6~9g/l;
185.葡萄糖:100mm;
186.其中上述溶剂为水。
187.反应液3:
188.氯化钠:6~9g/l;
189.葡萄糖:150mm;
190.其中上述溶剂为水。
191.反应液4:
192.氯化钠:6~9g/l;
193.葡萄糖:300mm;
194.其中上述溶剂为水。
195.反应液5:
196.氯化钠:6~9g/l;
197.葡萄糖:500mm;
198.其中上述溶剂为水。
199.2)将步骤1)中制备的上清液装入透析袋,置于4℃透析液透析至完全除去葡萄糖,离心取上清液,其中所述透析液成分为:
200.磷酸盐缓冲液:200mm,ph 7.5
201.氯化钠:9g/l
202.叠氮化钠:0.5%
203.其中上述溶剂为水;
204.3)将步骤2)中制备的上清液用血红蛋白稀释液进行100:1稀释(血红蛋白稀释液为100,上清液为1),然后进行低温预冻,冷冻干燥,制成冻干粉,最后将冻干粉复溶、分装。其中所述血红蛋白稀释液成分为:
205.甘氨酸缓冲液:200mm,ph 7.5
206.氯化钠:9g/l
207.二硫苏糖醇:200mm
208.乙二胺四乙酸二钠:10mm
209.塔格糖:200mm
210.叠氮化钠:0.5%
211.葡萄糖氧化酶:10%
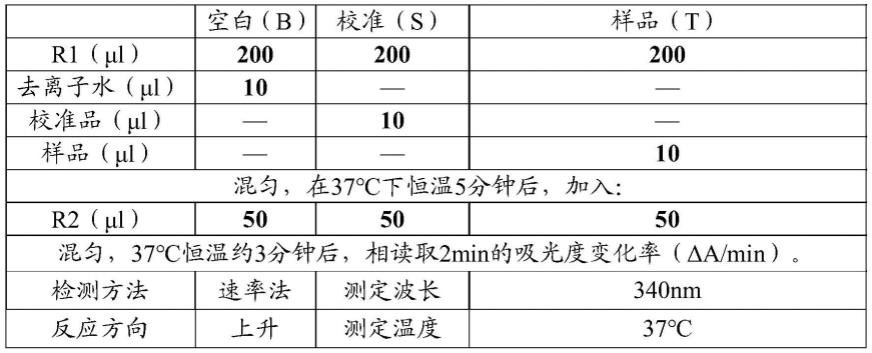
212.其中所述低温预冻条件为:
213.在-50℃至-90℃的条件下,预冻3小时以上将溶液冷冻成型。
214.其中所述冷冻干燥条件为:
215.第一次干燥阶段的升温速度采用3℃~10℃每小时,持续20~35小时,第二次干燥阶段的升温速度采用20℃~25℃每小时,持续5~10小时。
216.实施例2具体操作方法
217.对实施例1和对比例1、2中的检测试剂进行如下检测:
218.①
相关性检测:用以上获得的校准品,与北京安图生物工程有限公司生产的糖化血红蛋白试剂盒在佳能系列生化仪上进行定标:
219.定标方法:取10μl校准品加入到200μl试剂1中,仪器于37℃下孵育5分钟后,再加入50μl试剂2,在340nm处读取吸光度a1,仪器于37℃下孵育5分钟后,在340nm处读取吸光度a2;以该校准品浓度为横坐标,吸光度差值
△
a(
△
a=a2-a1)为纵坐标,制作校准曲线;
220.使用该校准曲线与高效液相色谱法同步检测100例临床全血样本,并进行相关性比较;
221.②
复溶稳定性检测:将冻干校准品做7天复溶稳定性测试。具体操作为:将冻干校准品进行复溶,将复溶后的校准品于2℃~8℃环境下密封保存,分别于第0天、第1天、第3天、第5天、第7天放入,于第8天取出;作7天开瓶稳定性检测;于第8天与4℃保存冻干校准品同时检测;
222.③
37℃热稳定性测试:将冻干校准品做14天热稳定性测试:具体操作为:将冻干校准品直接放置在37℃恒温生化培养箱中,分别于第0、1、3、5、7、9、11、13、14天放入,于第15天取出,作为14天37℃热稳定性检测;于第15天与4℃保存冻干校准品同时检测;
223.④
4℃实时稳定性测试:将冻干校准品做24个月4℃实时稳定性测试。具体操作为:将冻干校准品放置在4℃冰箱中,分别于第1、3、6、9、12、15、18、24个月检测一次,作为24个月4℃实时稳定性测试。
224.表1:检测参数
[0225][0226]
实验结果如下:
[0227]
①
相关性检测
[0228]
用以上获得的校准品,搭配北京安图生物工程有限公司的糖化血红蛋白试剂盒,与高效液相色谱法一起检测100例临床病人样本并进行相关性比较,获得以下的相关性数据:
[0229]
表2
[0230]
[0231]
[0232][0233]
[0234]
以上相关分析表明,对比例1、对比例2、实施例1与高效液相色谱法之间的相关性均较好,说明其测值较为准确。
[0235]
②
复溶稳定性检测
[0236]
表3
[0237][0238]
以上复溶稳定性数据表明,在校准品中添加甘露醇作为赋形剂时,校准品复溶后会逐步降低;在校准品中将甘露醇更换为塔格糖,仅能在一定程度上保护校准品的稳定性,但由于校准品中残留部分葡萄糖,血红蛋白会进一步糖基化,导致测值不断升高;当将校准品中的甘露醇替换为塔格糖、并且使用葡萄糖氧化酶消耗未完全透析出去的葡萄糖时,校准品的复溶稳定性良好;校准品稳定性达到最佳稳定效果。
[0239]
③
37℃热稳定性测试
[0240]
表4
[0241]
[0242][0243]
以上37℃热稳定性测试数据表明,在校准品中仅添加塔格糖时,仅能保证校准品不会升高;当在校准品中添加葡萄糖氧化酶和塔格糖时,校准品才处在一个完全稳定的状态。
[0244]
④
4℃实时稳定性测试
[0245]
表5
[0246]
[0247]
[0248][0249]
以上4℃实时稳定性测试数据表明,在校准品中添加甘露醇作为赋形剂,校准品测值会持续下降;当校准品中添加塔格糖作为赋形剂,校准品不再呈下降趋势;当校准品中添加葡萄糖氧化酶和塔格糖,校准品的稳定性合格。
[0250]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1