一种用于胶体金法检测试纸条的质控线包被溶液、质控线、试纸条及其应用
1.本发明属于侧流层析技术检测领域,特别涉及一种用于胶体金法检测试纸条的质控线包被溶液、质控线、试纸条及其应用。
背景技术:
2.胶体金法侧向层析检测技术以硝酸纤维素膜(nc膜)为载体,当在试纸条一端的样品垫加入待测样品后,在毛细作用下侧向流动,待测物与结合垫上的胶体金结合,再移动到nc膜上,被固定在nc膜上检测线(t线)的抗体或抗原捕获、聚集、并显色。其他未在t线上结合的胶体金则越过t线被质控线(c线)捕获拦截。通过t线和c线的颜色有无和深浅实现待测物的定性和半定量检测。
3.胶体金法侧向层析检测技术主要分为夹心法和竞争法,前者主要通过金标记的抗i与待测物抗原结合后再与t线上的抗ii结合形成“三明治”的夹心结构;后者主要是待测物与金标记的抗i结合,经过t线时不与t线上抗i结合产生竞争抑制作用。然而,两种方法都需要胶体金与c线上的抗i抗结合,以判断本次检测的效果。
4.目前,传统的胶体金法侧向层析检测试纸常采用羊抗鼠、兔抗鼠等作为c线上的捕获蛋白,且针对不同的抗i需要选择合适的抗i抗,存在成本高、不易得且保存条件苛刻等缺点。上述问题大大增加了试纸条的使用成本,因此急需开发一种成本低、适用范围广、能用于胶体金法检测试纸质控线的通用技术。
技术实现要素:
5.本发明为解决上述技术问题提供一种。该技术以水凝胶作为质控线,实现不同尺寸胶体金的捕获,适用于胶体金试纸检测中的夹心法和竞争法,能有效拦截胶体金并显色,涉及的测试方法简单、操作便捷,能广泛应用于胶体金法试纸检测中。
6.为实现上述目的,本发明采用的技术方案为:
7.一种用于胶体金法检测试纸条的质控线包被溶液,所述质控线包被溶液包括水凝胶。
8.优选地,所述水凝胶为天然水凝胶或合成水凝胶。
9.优选地,所述水凝胶包含但不局限于聚丙烯酸水凝胶、聚丙烯酰胺水凝胶、明胶水凝胶、卡拉胶水凝胶、聚乙烯醇水凝胶或聚乙烯醇-海藻酸钠水凝胶中的一种或两种以上的混合。
10.优选地,所述水凝胶为琼脂糖水凝胶。所述水凝胶的质量分数小于40%。
11.优选地,所述琼脂糖水凝胶的质量分数小于10%,优选为1~5%,更优选为1%、2%、3%、4%、5%,最优选为3%。
12.优选地,所述胶体金为无标记物的金纳米颗粒,其尺寸为10~100nm,优选为20~80nm,更优选为20、40、60、80nm。
13.一种用于胶体金法检测试纸条的质控线,所述质控线由以下方法制备:
14.制备水凝胶溶液;
15.移取所述制备得到的水凝胶溶液,将其滴加在层析膜上作为质控线的位置,然后真空干燥,即得到所述质控线。
16.优选地,所述水凝胶溶液为琼脂糖水凝胶溶液,所述制备琼脂糖水凝胶溶液的具体步骤为:将脂糖粉加入到水中,加热至沸腾并保持10~12min,即得到所述琼脂糖水凝胶溶液。
17.优选地,所述质控线上的琼脂糖水凝胶承载量为8~12μl/cm。
18.优先地,所述水凝胶溶液为琼脂糖水凝胶溶液时,干燥条件为:40~60℃下真空干燥,干燥时间为3~5min。
19.一种胶体金法检测试纸条,包括背衬板以及依次在背衬板上的样品垫、结合垫、层析膜和吸水垫;所述层析膜设置有检测线和质控线,所述质控线采用上述的质控线。
20.所述的质控线在胶体金试纸检测中的夹心法和竞争法中的应用。
21.优选地,所述夹心法包括用于检测生物素-亲和素检测体系或新冠病毒检测体系,但不局限于抗原-抗体的检测,还可用于检测核酸、聚糖或凝集素体系。
22.所述竞争法用于主客体体系检测,例如包括葫芦脲-金刚烷胺竞争检测体系。所述主体大环分子为葫芦脲、柱芳烃或环糊精;所述客体分子包括能与主体进行识别的所有分子。
23.优选地,所述应用的具体步骤如下:
24.制备质控线:质控线为能够拦截胶体金的物质,包括抗体、核酸等,本专利中为不同质量分数的天然或人工水凝胶,包括但不局限于琼脂糖水凝胶,聚丙烯酸水凝胶、聚丙烯酰胺水凝胶、明胶水凝胶、卡拉胶水凝胶、聚乙烯醇水凝胶或聚乙烯醇-海藻酸钠水凝胶中的一种或几种。将不同质量(体积),不同种类的原料分别溶在一定体积水中,得到不同浓度(0-50%,wt%)和种类的水凝胶;
25.制备检测线包被溶液:包被溶液为能和分析物特异性结合的生物素、蛋白、核酸或小分子,本专利涉及的范围包括但不局限于为能与亲和素结合的生物素,能和抗原特异性结合的抗体,或能和大环主体分子结合的客体分子;将一定浓度的上述抗体或分子溶于特定的溶液中,再按一定浓度(0-30mg/l)打印在层析膜上,即得;
26.检测线的包被:将上述制得的包被溶液,打印在距离质控线以下3-5mm处,其承载量为0-20μl/cm不等,即得;
27.胶体金标记:被胶体金标记为核酸适配体,亲和素,抗体,大环主体分子等,本专利涉及的范围包括但不局限于亲和素,抗体。将一定浓度的亲和素、抗体分别与一定浓度胶体金混合,孵育一定时间(对于金标记的大环主体分子,则利用共还原方法制得);然后用蛋白回填,尽可能覆盖裸露的金表面,最后富集、分散得到胶体金标记的溶液;
28.金标垫的制备:取一定体积上述胶体金标记的溶液,喷洒在金标垫上,干燥后即得。
29.试纸条的制备:在上述的基础上,在背衬板上一端粘贴上样品垫,样品垫的一端紧密压接金标垫,金标垫的一端紧密压层析膜,层析膜另一端紧密压接吸样垫,即得试纸条;其中,背衬板包括但不限于pvc背衬板;样品垫包括但不局限于未进一步处理或经特殊处理
的玻璃纤维素垫、醋酸纤维素,金标垫包括但不局限于未进一步处理或经特殊处理的玻璃纤维素垫、聚酯,吸样垫包括但不局限于未进一步处理或经特殊处理的纤维素过滤膜;层析膜包括但不限于未进一步处理或经特殊处理的硝化纤维素膜。背衬板、样品垫、金标垫、层析膜、吸样垫的宽度相同,为3-5mm,长度分别为:50-60mm、15-20mm、4-8mm、2-30mm、15-25mm。
30.优选地,所述生物素-亲和素检测体系中,所述质控线包被溶液为琼脂糖水凝胶,浓度优选为3%。
31.优选地,所述生物素-亲和素检测体系中,所述检测线包被溶液为修饰有牛血清蛋白的生物素;优选的,所述生物素浓度为3~5mg/ml,承载量为1~1.5μl/cm。
32.优选地,所述生物素-亲和素检测体系中,结合垫为胶体金标记的链霉亲和素;优选的,胶体金的尺寸为40~50nm,链霉亲和素的浓度为10~20μg/ml。
33.优选地,所述葫芦脲-金刚烷胺竞争检测体系中,结合垫为胶体金标记的葫芦[7]脲。
[0034]
优选地,所述葫芦脲-金刚烷胺竞争检测体系中,所述质控线包被溶液为琼脂糖水凝胶,浓度优选为3%。
[0035]
优选地,所述葫芦脲-金刚烷胺竞争检测体系中,所述检测线为金刚烷乙酸-bsa偶联物,优选的,其浓度为18~22mg/ml。
[0036]
优选地,所述葫芦脲-金刚烷胺竞争检测体系中,展开剂为tris-hcl或pb溶液,优选的,其体积分别为60~80μl。
[0037]
优选地,新冠病毒检测体系中,所述质控线包被溶液为琼脂糖水凝胶,浓度优选为3%。
[0038]
优选的,新冠病毒检测体系中,所述质控线上琼脂糖水凝胶的承载量为8~12μl/cm。
[0039]
优选的,新冠病毒检测体系中,所述质控线上琼脂糖水凝胶的干燥温度为40~60℃真空干燥,干燥时间为3~5min。
[0040]
优选地,新冠病毒检测体系中,所述胶体金溶液为胶体金标记的新冠病毒抗原重组蛋白抗i(15c3),优选的,其抗体浓度为10~20μg/ml。
[0041]
优选地,新冠病毒检测体系中,所述检测线包被溶液为所述抗原对应的抗体溶液,优选的,所述检测线上的包被溶液的承载量为1~2μl/cm,优选的,所述检测线的包被溶液浓度为2mg/ml的所述抗原对应的抗体溶液。
[0042]
优选地,新冠病毒检测体系中,展开剂为含有吐温-20的pbs溶液,优选的,所述展开剂pbs的浓度为10mm,吐温-20的浓度为0.1%(体积分数,v/v)。
[0043]
与现有技术相比,本发明的有益效果为:本发明提供的质控线技术,采用廉价的水凝胶代替质控线常用的羊抗鼠、兔抗鼠等抗体,通过对试纸条质控线的改良,确定最优的水凝胶浓度。所述的质控线通用技术适用于胶体金试纸检测中的夹心法和竞争法,均能有效拦截胶体金并显色。本发明提供的质控线技术,将水凝胶用于试纸检测的质控线不仅大大降低了成本,还具有较好的普适性,能广泛应用于胶体金法试纸检测中。
附图说明
[0044]
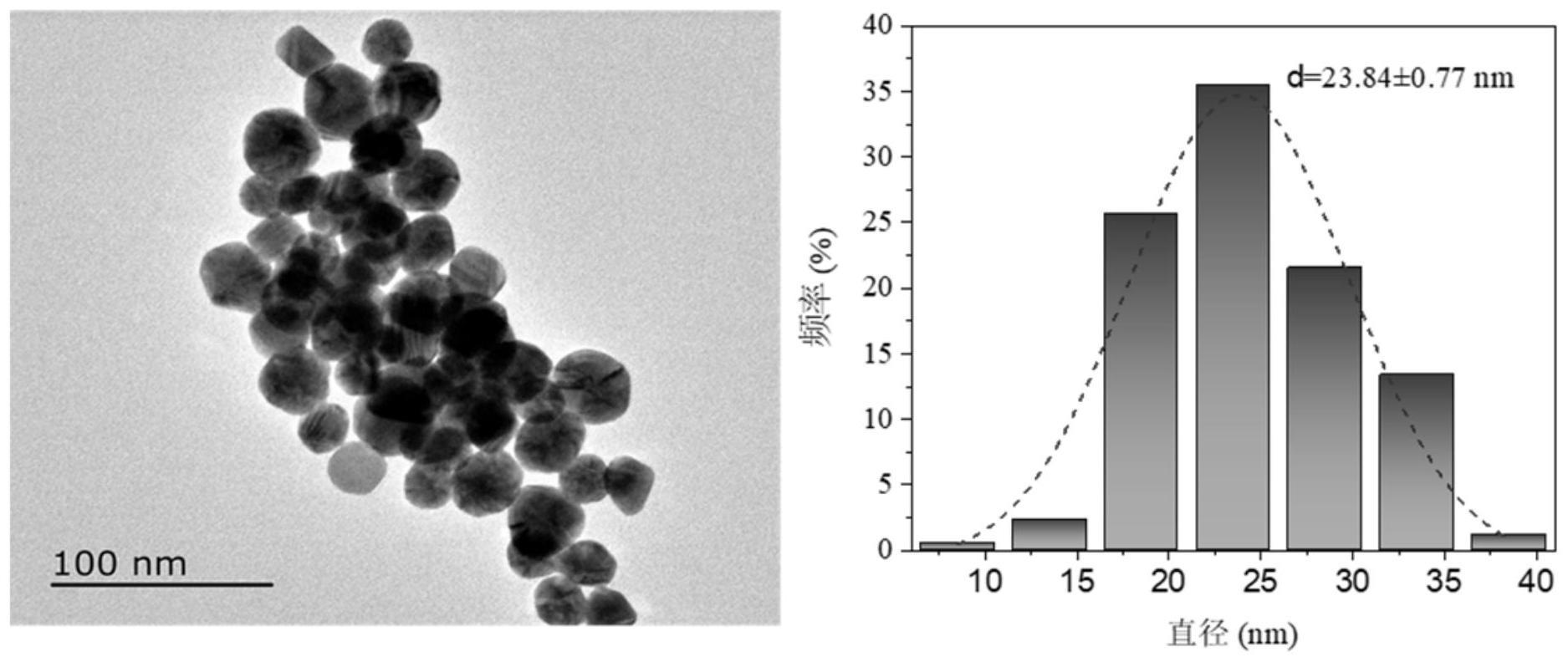
图1为本发明实施例1中所涉及20nm胶体金的tem图和粒径统计图;
[0045]
图2为本发明实施例1中所涉及40nm胶体金的tem图和粒径统计图;
[0046]
图3为本发明实施例1中所涉及60nm胶体金的tem图和粒径统计图;
[0047]
图4为本发明实施例1中所涉及80nm胶体金的tem图和粒径统计图;
[0048]
图5为本发明实施例1中所涉及胶体金的紫外可见吸收光谱;
[0049]
图6为本发明实施例2中不同浓度琼脂糖水凝胶拦截20nm胶体金的检测结果和灰度值;
[0050]
图7为本发明实施例3中不同浓度琼脂糖水凝胶拦截40nm胶体金的检测结果和灰度值;
[0051]
图8为本发明实施例4中不同浓度琼脂糖水凝胶拦截60nm胶体金的检测结果和灰度值;
[0052]
图9为本发明实施例5中不同浓度琼脂糖水凝胶拦截80nm胶体金的检测结果和灰度值;
[0053]
图10为本发明实施例6中不同浓度聚丙烯酸水凝胶作为质控线拦截40nm胶体金的检测结果和灰度值;
[0054]
图11为本发明实施例7中不同浓度聚丙烯酰胺水凝胶作为质控线拦截40nm胶体金的检测结果和灰度值;
[0055]
图12为本发明实施例8中不同浓度明胶水凝胶作为质控线拦截40nm胶体金的检测结果和灰度值;
[0056]
图13为本发明实施例9中不同浓度卡拉胶水凝胶作为质控线拦截40nm胶体金的检测结果和灰度值;
[0057]
图14为本发明实施例10中不同浓度聚乙烯醇水凝胶作为质控线拦截40nm胶体金的检测结果和灰度值;
[0058]
图15为本发明实施例11中不同浓度聚乙烯醇-海藻酸钠水凝胶作为质控线拦截40nm胶体金的检测结果和灰度值;
[0059]
图16为本发明实施例12中试纸条构造示意图、3%琼脂糖水凝胶在生物素-亲和素体系应用中的检测结果;
[0060]
图17为本发明实施例13中所涉及gnp@cb[7]的tem图和粒径统计图;
[0061]
图18为本发明实施例13中试纸条构造示意图、3%琼脂糖水凝胶在主客体竞争检测体系中拦截gnp@cb[7]的结果;
[0062]
图19为本发明实施例13中试纸条构造示意图、3%琼脂糖水凝胶在主客体竞争检测体系中检测金刚烷胺的结果;
[0063]
图20为本发明实施例14中试纸条构造示意图、4%琼脂糖水凝胶在抗原-抗体免疫体系中检测新冠抗原重组蛋白的结果。
具体实施方式
[0064]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限
定本发明。
[0065]
实施例1
[0066]
不同尺寸胶体金的制备
[0067]
1)20nm胶体金溶液的制备:将1ml、25mm的氯金酸溶液加入到150ml、2.2mm的柠檬酸钠溶液中,加热至沸腾,然后自然冷却至90℃,再加入1ml、25mm的氯金酸溶液,反应30min,即得。如图1所示,tem结果表明得到金纳米颗粒(以下简称gnp),粒径统计显示其尺寸在20nm左右。
[0068]
2)40nm胶体金溶液的制备:在所述20nm胶体金溶液中,移除55ml后,剩下的溶液作为种子,向所述种子溶液中加入55ml、2.2mm的柠檬酸纳溶液,加热至沸腾,然后自然冷却至90℃,再加入1ml、25mm的氯金酸溶液,反应30min,即得。如图2所示,tem结果表明得到gnp,粒径统计显示其尺寸在40nm左右。
[0069]
3)60nm胶体金溶液的制备:在所述40nm胶体金溶液中,移除55ml后,剩下的溶液作为种子,向所述种子溶液中加入55ml、2.2mm的柠檬酸纳溶液,加热至沸腾,然后自然冷却至90℃,再加入1ml、25mm的氯金酸溶液,反应30min,即得。如图3所示,tem结果表明得到gnp,粒径统计显示其尺寸在60nm左右。
[0070]
4)80nm胶体金溶液的制备:在所述60nm胶体金溶液中,移除55ml后,剩下的溶液作为种子,向所述种子溶液中加入55ml、2.2mm的柠檬酸纳溶液,加热至沸腾,然后自然冷却至90℃,再加入1ml、25mm的氯金酸溶液,反应30min,即得。如图4所示,tem结果表明得到gnp,粒径统计显示其尺寸在80nm左右。
[0071]
5)不同尺寸胶体金的紫外-可见吸收光谱如图5所示,随着gnp尺寸的增加,紫外-可见吸收光谱的最大吸收峰红移,进一步证明,上述gnp的成功制备。
[0072]
实施例2
[0073]
不同浓度琼脂糖水凝胶作为质控线拦截20nm胶体金溶液
[0074]
1)制备琼脂糖水凝胶:分别将0.1、0.2、0.3、0.4、0.5g的琼脂糖粉(生物用)加入到9.9、9.8、9.7、9.6、9.5ml超纯水中,加热到沸腾,并保持12min,分别得到1%、2%、3%、4%、5%的琼脂糖水凝胶(wt%,下同);
[0075]
2)制备质控线:用微型移液器移取5μl上述琼脂糖水凝胶溶液,趁热滴加在层析膜上,作为质控线;质控线长度为5mm,宽度2mm;然后置于60℃环境下真空干燥3min;
[0076]
3)制备拦截不同尺寸胶体金的试纸条:在检测试纸条的pvc背衬板(60
×
5mm)上一端粘贴上样品垫(17
×
5mm),样品垫的一端紧密压接nc膜(25
×
5mm),nc膜另一端紧密压接吸样垫(22
×
5mm),即得。
[0077]
4)检测方法:取10μl、实例1中20nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,侧向流动层析5min,拍照并读取质控线上灰度值。
[0078]
5)不同浓度琼脂糖水凝胶拦截20nm胶体金溶液的情况如图6所示,结果表明,1%-5%的琼脂糖水凝胶均能有效拦截20nm胶体金,其中,3%的琼脂糖水凝胶拦截效果最好。
[0079]
实施例3
[0080]
不同浓度琼脂糖水凝胶作为质控线拦截40nm胶体金溶液
[0081]
本实施例与实施例2大致相同,不同之处在于:
[0082]
4)检测方法:取10μl、实例1中40nm胶体金溶液滴加在nc膜下端,接着在样品垫上
滴加60μl超纯水作为展开剂,侧向流动层析5min,拍照并读取质控线上灰度值。
[0083]
5)不同浓度琼脂糖水凝胶拦截40nm胶体金溶液的情况如图7所示,结果表明,1%-5%的琼脂糖水凝胶均能有效拦截40nm胶体金,其中,3%的琼脂糖水凝胶拦截效果最好。
[0084]
实施例4
[0085]
不同浓度琼脂糖水凝胶作为质控线拦截60nm胶体金溶液
[0086]
本实施例与实施例2大致相同,不同之处在于:
[0087]
4)检测方法:取10μl、实例1中60nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,侧向流动层析5min,拍照并读取质控线上灰度值。
[0088]
5)不同浓度琼脂糖水凝胶拦截60nm胶体金溶液的情况如图8所示,结果表明,1%-5%的琼脂糖水凝胶均能有效拦截60nm胶体金,其中,3%的琼脂糖水凝胶拦截效果最好。
[0089]
实施例5
[0090]
不同浓度琼脂糖水凝胶作为质控线拦截80nm胶体金溶液
[0091]
本实施例与实施例2大致相同,不同之处在于:
[0092]
4)检测方法:取10μl、实例1中80nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,侧向流动层析5min,拍照并读取质控线上灰度值;
[0093]
5)不同浓度琼脂糖水凝胶拦截80nm胶体金溶液的情况如图9所示,结果表明,1%-5%的琼脂糖水凝胶均能有效拦截80nm胶体金,其中,3%的琼脂糖水凝胶拦截效果最好。
[0094]
实施例6
[0095]
不同浓度聚丙烯酸水凝胶作为质控线拦截40nm胶体金溶液
[0096]
1)制备聚丙烯酸水凝胶:分别将3、4、5、6g的丙烯酸,0.1、0.133、0.167、0.2g的n,n-亚甲基双丙烯酰胺,0.042、0.056、0.07、0.084g过硫酸铵,0.042、0.056、0.07、0.084g亚硫酸氢钠,分别加入到10ml超纯水中,搅拌均匀,分别得到23、29、33、38%的聚丙烯酸水凝胶(wt%,下同);
[0097]
2)制备质控线:用微型移液器移取5μl上述聚丙烯酸水凝胶溶液,滴加在层析膜上,作为质控线;质控线长度为5mm,宽度2mm;然后置于25℃环境下静置12h,然后置于25℃环境下真空干燥10min;
[0098]
3)制备拦截40nm胶体金溶液的试纸条:在检测试纸条的pvc背衬板(60
×
5mm)上一端粘贴上样品垫(17
×
5mm),样品垫的一端紧密压接nc膜(25
×
5mm),nc膜另一端紧密压接吸样垫(22
×
5mm),即得。
[0099]
4)检测方法:取10μl、实例1中40nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,侧向流动层析5min,拍照并读取质控线上灰度值。
[0100]
5)不同浓度聚丙烯酸水凝胶拦截40nm胶体金溶液的情况如图10所示,结果表明,23%~38%的聚丙烯酸水凝胶均能拦截40nm胶体金,其中,33%的聚丙烯酸水凝胶拦截效果最好。
[0101]
实施例7
[0102]
不同浓度聚丙烯酰胺水凝胶作为质控线拦截40nm胶体金溶液
[0103]
1)制备聚丙烯酰胺水凝胶:分别将1.0、1.5、2.0、2.5、3.0g的丙烯酰胺,0.0025、0.0038、0.005、0.0062、0.0075g的n,n-亚甲基双丙烯酰胺,0.1、0.15、0.2、0.25、0.3g的海藻酸,0.025、0.0038、0.005、0.0062、0.0075g过硫酸铵,0.017、0.0255、0.034、0.0425、
0.051g硫酸钙,0.005、0.0075、0.01、0.0125、0.015g四甲基乙二胺,分别加入到5ml超纯水中,搅拌均匀,分别得到17、23、29、33、38%的聚丙烯酰胺水凝胶(wt%,下同);
[0104]
2)制备质控线:用微型移液器移取5μl上述聚丙烯酰胺水凝胶溶液,滴加在层析膜上,作为质控线;质控线长度为5mm,宽度2mm;然后置于25℃环境下静置12h,然后置于25℃环境下真空干燥10min;
[0105]
3)制备拦截40nm胶体金溶液的试纸条:在检测试纸条的pvc背衬板(60
×
5mm)上一端粘贴上样品垫(17
×
5mm),样品垫的一端紧密压接nc膜(25
×
5mm),nc膜另一端紧密压接吸样垫(22
×
5mm),即得。
[0106]
4)检测方法:取10μl、实例1中40nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,侧向流动层析10min,拍照并读取质控线上灰度值。
[0107]
5)不同浓度聚丙烯酰胺水凝胶拦截40nm胶体金溶液的情况如图11所示,结果表明,17%-38%的聚丙烯酰胺水凝胶均能拦截40nm胶体金,其中,33%的聚丙烯酰胺水凝胶拦截效果最好。
[0108]
实施例8
[0109]
不同浓度明胶水凝胶作为质控线拦截40nm胶体金溶液
[0110]
1)制备明胶水凝胶:分别将0.35、0.53、0.89、1.04g的明胶粉末加入到3.15、2.96、3.57、3.13ml超纯水中,加热到70℃,并保持12min,分别得到10%、15%、20%、25%的明胶水凝胶(wt%,下同);
[0111]
2)制备质控线:用微型移液器移取5μl上述明胶水凝胶溶液,趁热滴加在层析膜上,作为质控线;质控线长度为5mm,宽度2mm;然后置于25℃环境下静置2h,然后置于25℃环境下真空干燥10min;
[0112]
3)制备拦截40nm胶体金的试纸条:在检测试纸条的pvc背衬板(60
×
5mm)上一端粘贴上样品垫(17
×
5mm),样品垫的一端紧密压接nc膜(25
×
5mm),nc膜另一端紧密压接吸样垫(22
×
5mm),即得。
[0113]
4)检测方法:取10μl、实例1中40nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,浓度为10%的明胶水凝胶侧向流动层析5min,浓度为15%、20%、25%的明胶水凝胶侧向流动层析30min,拍照并读取质控线上灰度值。
[0114]
5)不同浓度明胶水凝胶拦截40nm胶体金溶液的情况如图12所示,结果表明,10%-25%的明胶水凝胶均能拦截40nm胶体金,其中,10%的明胶水凝胶拦截效果最好。
[0115]
实施例9
[0116]
不同浓度卡拉胶水凝胶作为质控线拦截40nm胶体金溶液
[0117]
1)制备卡拉胶水凝胶:分别将0.02、0.04、0.05、0.07g的卡拉胶粉末加入到3.98、3.96、3.48、3.43ml超纯水中,加热到40℃,搅拌20min,然后加热到90℃,保持12min,分别得到0.5%、1%、1.5%、2%的卡拉胶水凝胶(wt%,下同);
[0118]
2)制备质控线:用微型移液器移取5μl上述卡拉胶水凝胶溶液,趁热滴加在层析膜上,作为质控线;质控线长度为5mm,宽度2mm;然后置于25℃环境下静置12h,然后置于25℃环境下真空干燥10min;
[0119]
3)制备拦截40nm胶体金的试纸条:在检测试纸条的pvc背衬板(60
×
5mm)上一端粘贴上样品垫(17
×
5mm),样品垫的一端紧密压接nc膜(25
×
5mm),nc膜另一端紧密压接吸样
垫(22
×
5mm),即得。
[0120]
4)检测方法:取10μl、实例1中40nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,浓侧向流动层析20min,拍照并读取质控线上灰度值。
[0121]
5)不同浓度卡拉胶水凝胶拦截40nm胶体金溶液的情况如图13所示,结果表明,0.5%-2%的卡拉胶水凝胶均能拦截40nm胶体金,其中,1%的明胶水凝胶拦截效果最好。
[0122]
实施例10
[0123]
不同浓度聚乙烯醇水凝胶作为质控线拦截40nm胶体金溶液
[0124]
1)制备聚乙烯醇水凝胶:分别将0.03、0.083、0.151、0.25、0.30g的聚乙烯醇1799型粉末,分别加入到3.17、4.06、3.62、3.92、3.45ml超纯水中,加热到100℃,并保持12min,分别得到1%、2%、4%、6%、8%的聚乙烯醇水凝胶(wt%,下同);
[0125]
2)制备质控线:用微型移液器移取5μl上述聚乙烯醇水凝胶溶液,趁热滴加在层析膜上,作为质控线;质控线长度为5mm,宽度2mm;然后置于-20℃环境下静置12h,然后置于25℃环境下真空干燥10min;
[0126]
3)制备拦截40nm胶体金的试纸条:在检测试纸条的pvc背衬板(60
×
5mm)上一端粘贴上样品垫(17
×
5mm),样品垫的一端紧密压接nc膜(25
×
5mm),nc膜另一端紧密压接吸样垫(22
×
5mm),即得。
[0127]
4)检测方法:取10μl、实例1中40nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,浓侧向流动层析5min,拍照并读取质控线上灰度值。
[0128]
5)不同浓度聚乙烯醇水凝胶拦截40nm胶体金溶液的情况如图14所示,结果表明,1%-8%的聚乙烯醇水凝胶均能拦截40nm胶体金,其中,8%的聚乙烯醇水凝胶拦截效果最好。
[0129]
实施例11
[0130]
不同浓度聚乙烯醇-海藻酸钠水凝胶作为质控线拦截40nm胶体金溶液
[0131]
1)制备聚乙烯醇-海藻酸钠水凝胶:分别将0.0203、0.062、0.11、0.153、0.234g的聚乙烯醇1799型粉末加入到2、2、2.09、2.033、2.106ml超纯水中,加热到100℃,并保持5min,得到质量分数为1%、3%、5%、7%、10%的聚乙二醇溶液(wt%,下同);取0.3239g的海藻酸钠粉末加入到6.154ml超纯水中,60℃下完全溶解,配制成5%的海藻酸钠溶液,再分别取5%的海藻酸钠溶液0.2、0.6、1、1.4、2ml加超纯水稀释到2ml,得到0.5%、1.5%、2.5%、3.5%、5%的海藻酸钠溶液;分别取上述0.5~5%的海藻酸钠溶液2ml,加入到2ml1~10%的聚乙二醇溶液中,100℃下搅拌2min,得到0.5-0.25、1.5-0.75、2.5-1.25、3.5-1.75、5-2.5wt%的聚乙烯醇-海藻酸钠水凝胶(聚乙二醇与海藻酸钠的质量分数比为2:1);
[0132]
2)制备质控线:用微型移液器移取5μl上述聚乙烯醇-海藻酸钠水凝胶溶液,趁热滴加在层析膜上,作为质控线;质控线长度为5mm,宽度2mm;然后置于-20℃环境下静置12h,然后置于25℃环境下真空干燥10min;
[0133]
3)制备拦截40nm胶体金的试纸条:在检测试纸条的pvc背衬板(60
×
5mm)上一端粘贴上样品垫(17
×
5mm),样品垫的一端紧密压接nc膜(25
×
5mm),nc膜另一端紧密压接吸样垫(22
×
5mm),即得。
[0134]
4)检测方法:取10μl、实例1中40nm胶体金溶液滴加在nc膜下端,接着在样品垫上滴加60μl超纯水作为展开剂,浓侧向流动层析5min,拍照并读取质控线上灰度值。
[0135]
5)不同浓度聚乙烯醇-海藻酸钠水凝胶拦截40nm胶体金溶液的情况如图15所示,结果表明,0.5-0.25%~5-2.5%的乙烯醇-海藻酸钠水凝胶均能拦截40nm胶体金,其中,2.5%-1.25%的乙烯醇-海藻酸钠水凝胶拦截效果最好。
[0136]
实施例12
[0137]
一种用于胶体金法生物素-亲和素体系的试纸条
[0138]
1)制备质控线:用微型移液器移取5μl上述3%琼脂糖水凝胶溶液,趁热滴加在层析膜上,作为质控线;质控线长度为3mm,宽度2mm;然后置于60℃环境下真空干燥3min,即得;
[0139]
2)制备检测线包被溶液:
[0140]
a、冰浴下,向3ml的dmso溶液中加入30mg nhs活化的生物素,向40ml、10mm ph=8的pb溶液中加入241.6mg牛血清蛋白,将所述生物素溶液缓慢滴加到所述bsa溶液中,在室温下搅拌2h,反应,得到bsa-生物素溶液。
[0141]
b、将所述bsa-生物素溶液在3kda析袋中透析48h,期间,每12h换一次超纯水,最后取所述透析袋中溶液,冷冻干燥72h,得到白色絮状物即bsa-生物素;
[0142]
c、取所述4mg bsa-生物素加入到1ml、10mm pb溶液中,得到4mg/ml的bsa-生物素包被溶液。
[0143]
3)检测线的包被:取本实施例步骤1)中的层析膜,将检测线与质控线之间的距离调试为5mm,设置点膜参数,启动划膜仪,将bsa-生物素包被溶液包被于检测线上,检测线的承载量为1μl/cm。
[0144]
4)胶体金标记的链霉亲和素的制备:
[0145]
a、复溶液的制备:包含8.7mg硼酸、5.7mg硼砂、50mg bsa、50mg聚乙烯吡咯烷酮(k30)、1g蔗糖、50mg nacl、100mg表面活性剂tetronic 1307(s9)加入到100ml超纯水中。
[0146]
b、将10μg/ml的待标记的链霉亲和素加入到1ml、未标记的实施例1中40nm(abs=2)胶体金溶液中,孵育30min后,再加入20μl、10%的bsa溶液封闭,孵育10min后,4℃下8000r/min离心10min,去除上清液,再向沉淀中加入200μl复溶液,即得。
[0147]
5)金标垫的制备:取7.5μl步骤4)中的胶体金标记的链霉亲和素均匀地铺于玻璃纤维素表面,并在37℃下烘干,即得。
[0148]
6)一种用于胶体金法生物素-亲和素体系的试纸条的制备:在检测试纸条的pvc背衬板(60
×
3mm)上一端粘贴上样品垫(18
×
3mm),样品垫的一端紧密压接步骤5)中的金标垫(6
×
3mm),金标垫的一端紧密压接步骤3)中的nc膜(25
×
3mm),nc膜另一端紧密压接吸样垫(19
×
3mm),即得。
[0149]
7)作为对照,一种用于胶体金法生物素-亲和素体系的试纸条的制备:在检测试纸条的pvc背衬板上一端粘贴上样品垫,样品垫的一端紧密压接步骤5)中的金标垫,金标垫的一端紧密压接步骤1)中的nc膜,nc膜另一端紧密压接吸样垫,即得;
[0150]
8)检测方法:取上述步骤6)和7)中的试纸,在样品垫上滴加50μl tris-hcl缓冲溶液作为展开剂,侧向流动层析20min,比色判读。
[0151]
9)用于胶体金法生物素-亲和素体系的试纸条的检测情况图16所示,结果表明,在生物素-亲和素检测体系中,以3%的琼脂糖水凝胶作为质控线的试纸条,可以拦截链霉亲和素偶联的金纳米颗粒。
[0152]
实施例13
[0153]
一种基于主客体竞争法用于检测金刚烷胺的试纸条
[0154]
1)制备质控线:用微型移液器移取5μl上述3%琼脂糖水凝胶溶液,趁热滴加在层析膜上,作为质控线;质控线长度为3mm,宽度为2mm;然后置于60℃环境下真空干燥3min,即得。
[0155]
2)制备检测线包被溶液:
[0156]
a、将摩尔比为1:5:5的金刚烷乙酸:edc
·
hcl:sulfo-nhs溶解在5ml、10mm的pb溶液(ph 6.0)中,并在黑暗中搅拌60min,得到活化的金刚烷乙酸溶液混合物;
[0157]
b、将439.9mg的bsa溶解在20ml、10mm的pb溶液中,得bsa溶液;
[0158]
c、将上述a中活化的金刚烷乙酸溶液混合物与b中bsa溶液混合,室温下反应60min后,用3kda的透析袋透析48h,再将述透析袋中的溶液冷冻干燥72h,得到;
[0159]
d、取20mg bas-金刚烷乙酸溶解在1ml超纯水中,得bas-金刚烷乙酸包被溶液。
[0160]
3)检测线的包被:取本实施例步骤1)中的层析膜,将检测线与质控线之间的距离调试为5mm,设置点膜参数,启动划膜仪,将2)中bas-金刚烷乙酸包被溶液包被于检测线上,检测线的承载量为1.5μl/cm。
[0161]
4)胶体金标记的葫芦[7]脲的制备:
[0162]
a、将20ml、5mm的cb[7]溶液与20ml、5mm的kaucl4·
2h2o溶液混合,静置5min后,加入40ml浓度为0.2m的naoh溶液,使得混合溶液ph=13,随后超声5min,37℃下静置48h,得到含有gnp@cb[7]沉淀的溶液,去除上清液,加入超纯水,超声2min,分散洗涤,继续沉淀12h,重复洗涤4次,最后一次加超纯水并稀释至溶液abs=0.7,得到gnp@cb[7]溶液;
[0163]
b、向1.5ml上述gnp@cb[7]溶液加入bsa封闭,使bas浓度为1%,室温下孵育40min后,4℃下3000r/min离心8min,取上清液后分散在200μl tris缓冲溶液(包含0.5%的bsa,0.5%的吐温-20,2%的蔗糖)中,超声5min,得到gnp@cb[7]-bsa溶液,即得,如图17所示,tem结果表明,制备了gnp@cb[7],粒径统计显示其尺寸为8nm。
[0164]
5)金标垫的制备:取8μl步骤4)中的胶体金标记的葫芦[7]脲均匀地铺于玻璃纤维素表面,并在37℃下烘干,即得。
[0165]
6)一种基于主客体竞争法用于检测金刚烷胺的试纸条的制备:在检测试纸条的pvc背衬板(60
×
3mm)上一端粘贴上样品垫(18
×
3mm),样品垫的一端紧密压接步骤5)中的金标垫(6
×
3mm),金标垫的一端紧密压接步骤3)中的nc膜(25
×
3mm),nc膜另一端紧密压接吸样垫(19
×
3mm),即得;
[0166]
7)作为对照,一种基于主客体竞争法用于检测金刚烷胺的试纸条的制备:在检测试纸条的pvc背衬板上一端粘贴上样品垫,样品垫的一端紧密压接步骤5)中的金标垫,金标垫的一端紧密压接步骤1)中的nc膜,nc膜另一端紧密压接吸样垫,即得;如图18所示,在主-客体竞争法检测体系中,以3%的琼脂糖水凝胶作为质控线的试纸条,可以拦截cb[7]偶联的金纳米颗粒。
[0167]
8)检测方法:取上述步骤6)和7)中的试纸,在样品垫上滴加60μl tris-hcl缓冲溶液作为展开剂,侧向流动层析10min,比色判读;取上述步骤6)和7)中的试纸两份,在样品垫上分别滴加不含和含有10μm金刚烷胺的60μl tris-hcl缓冲溶液作为展开剂,侧向流动层析10min,比色判读。
[0168]
9)一种基于主客体竞争法用于检测金刚烷胺的试纸条的检测情况如图19所示,结果表明,主客体竞争法检测金刚烷胺体系中,以3%的琼脂糖水凝胶作为质控线的试纸条,质控线可以拦截gnp@cb[7],且滴加金刚烷胺的试纸条的检测线颜色较不加的要浅,检测结果为阳性。
[0169]
实施例14
[0170]
一种用于检测新冠抗原重组蛋白的试纸条
[0171]
1)质控线的制备:用微型移液器移取10μl上述3%琼脂糖水凝胶溶液,趁热涂抹在层析膜上,作为质控线;质控线长度为3mm,宽度为2mm;然后置于60℃环境下真空干燥3min,即得。
[0172]
2)检测线包被溶液和检测限的制备:取本实施例步骤1)中的层析膜,将检测线与质控线之间的距离调试为5mm,设置划膜参数,检测线的承载量为1.5μl/cm,启动划膜仪,将2mg/ml的新冠抗原重组蛋白抗ii(11f2)的pb溶液(浓度为10mm)包被于检测线上,即得。
[0173]
3)胶体金标记的新冠抗原重组蛋白抗i蛋白(gnp-15c3)
[0174]
a、复溶液的制备:包含8.7mg硼酸、5.7mg硼砂、50mg bsa、50mg聚乙烯吡咯烷酮(k30)、1g蔗糖、50mg nacl、100mg表面活性剂tetronic 1307(s9)加入到100ml超纯水中,即得;
[0175]
b、胶体金标记的新冠抗原重组蛋白抗i溶液的制备:向1ml、实施例1中40nm(调abs=2)胶体金溶液中加入新冠抗原重组蛋白抗i蛋白,使其浓度为10μg/ml,振荡均匀后再加入20μl、10%的bsa溶液,振荡均匀,4℃下8000r/min离心10min,去除上清液,加入200ul新冠复溶液,即得。
[0176]
4)金标垫的制备:取7.5μl步骤3)中的胶体金标记的新冠抗原重组蛋白抗i溶液均匀地铺于玻璃纤维素表面,并在37℃下干燥2h,即得。
[0177]
5)一种用于检测新冠抗原重组蛋白的试纸条的制备:在检测试纸条的pvc背衬板(60
×
3mm)上一端粘贴上样品垫(18
×
3mm),样品垫的一端紧密压接步骤4)中的金标垫(6
×
3mm),金标垫的一端紧密压接步骤2)中的nc膜(25
×
3mm),nc膜另一端紧密压接吸样垫(19
×
3mm),即得。
[0178]
6)检测方法:取上述步骤5)中的试纸,在样品垫上滴加含有不同浓度新冠抗原重组蛋白,包含10mm pbs和0.1%吐温-20的新冠裂解液,作为展开剂展开,侧向流动层析20min,比色判读。
[0179]
7)一种用于检测新冠抗原重组蛋白的试纸条的检测情况如图20所示,结果表明,在检测新冠抗原重组蛋白体系中,以3%的琼脂糖水凝胶作为质控线的试纸条,质控线可以拦截新冠n蛋白15c3偶联的胶体金,且能均能检测到浓度为0.5,1,10ng/l的新冠抗原重组蛋白。
[0180]
上述结果表明,本发明所设计和构筑的一种用于胶体金法检测试纸质控线的通用技术,可以实现对不同尺寸胶体金的有效捕获,还能应用于包含但不限于生物素-亲和素检测、主客体竞争检测、抗原-抗体免疫检测在内的多种检测体系;其他各种水凝胶与琼脂糖水凝胶相比,具有相似的亲水性和多孔结构,能有效拦截胶体金,同样也可用于针对各种检测体系的试纸条上质控线;本发明所涉及的针对试纸条的质控线的一种通用技术,可进一步拓宽适用于待测物的种类,可有效解决现有试纸质控线的局限性与不足,对发展低成本
的及时检测技术具有十分重要的意义。
[0181]
上述实施例仅是为了清楚地说明所做的实例,而并非对实施方式的限制。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或者变动,这里无需也无法对所有的实施方式予以穷举,因此所引申的显而易见的变化或变动仍处于本发明创造的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1