一种SARS-CoV-2假病毒检测血清中中和抗体滴度的方法与流程
一种sars-cov-2假病毒检测血清中中和抗体滴度的方法
技术领域
1.本发明属于新冠病毒抗体滴度的检测方法,具体地涉及一种sars-cov-2假病毒检测血清中中和抗体滴度的方法。
背景技术:
2.新较高的防护标准极大限制了相关研究的开展,而假病毒中和抗体检测方法(pseudovirus-basedneutralizationassays,pbnas)作为一种替代的、概念验证性的检测手段,在疫苗的安全性与有效性评价中有较高的实用价值。
3.sars-cov-2假病毒一般以复制缺陷型的hiv病毒为骨架或以复制缺陷型的vsv-g病毒为骨架,衣壳包被sars-cov-2的表面刺突糖蛋白(spikeglycoprotein),通过spike蛋白受体结合区域(receptor-bindingdomain,rbd)与人血管紧张素转化酶2(angiotensinconvertingenzyme2,ace2)受体糖蛋白复合物结合,感染过表达人ace2的细胞,模拟病毒入侵细胞过程。由于假病毒只能单次感染,无法复制,因此可在生物安全2级(bsl-2)实验室内操作和使用。
4.北京维通达生物技术有限公司公开的sars-cov-2假病毒,以hiv病毒为骨架,外面包被sars-cov-2的spike蛋白,能够感染过表达人ace2的细胞,同时带有fireflyluc和egfp标记,通过fireflyluc和egfp检测感染效率。然而,该技术中假病毒只是用于检测细胞株(推荐感染hace2-cos7细胞)是否感染假病毒,不是检测方法,并不能用于表征疫苗后血清中中和抗体活性,无法实现细胞层面定量检测血清中中和抗体滴度。
技术实现要素:
5.为了解决上述技术问题,本发明公开了一种sars-cov-2假病毒检测血清中中和抗体滴度的方法。
6.本发明的技术方案如下:一种sars-cov-2假病毒检测血清中中和抗体滴度的方法,其特征在于,包括以下步骤:1)在检测板设空白对照组,病毒对照组,样品组,设置平行孔;2)对上述的空白对照组,病毒对照组,样品组进行培养后,分别进行荧光检测,获得空白对照组发光强度均值、病毒对照组的发光强度均值和样品组的发光强度均值;3)计算中和抗体抑制率=[1-(样品组的发光强度均值-空白对照组发光强度均值)/(病毒对照组的发光强度均值-空白对照组发光强度均值)]
×
100%;4)将上一步算出的中和抗体抑制率输入统计学软件进行非线性拟合,计算出中和抗体滴度;所述空白对照中含有hace2-cos7细胞;所述病毒对照中含有sars-cov-2假病毒和hace2-cos7细胞;所述样品组中含有sars-cov-2假病毒、hace2-cos7细胞和待测血清;
所述发光强度均值由以下步骤测定:31)细胞铺板:d1天在96孔板中每孔接种5000个hace2-cos7细胞,37℃培养过夜;32)样品稀释:d1天将待测血清56℃灭活30min,4℃放置过夜,每份40μl;d2天将待测血清做梯度稀释,血清30μl加稀释液570μl,加入24孔板第1列,每孔600μl混匀,后五列每孔加450μl稀释液,排枪将第一列混匀后取150μl加入第二列,依次稀释至第六列弃去150μl;优选的,上述梯度稀释比例可选为:1:20、1:80、1:320、1:1280、1:5120、1:20480。
[0007]
33)中和检测病毒感染:d2从-80℃冰箱中取出sars-cov-2假病毒冰上融化,样品组将假病毒与稀释后的血清按当批病毒对目的细胞的感染复数(moi)混合,病毒对照组将假病毒与完全培养基混合,37℃孵育1h为混合液;吸去细胞原有培养液,每孔加入100μl配制好的混合液;空白对照组加入100μl完全培养基,轻轻摇匀;4℃,1200g离心感染2h(边离心边感染),弃去含有假病毒的培养基,pbs清洗一遍,每孔加入30μl0.25%的胰酶,37℃消化5min,加入100μl完全培养基,排枪轻轻吹打4-5下重悬均匀,37℃培养过夜;34)细胞换液:d3、d4每天更换培养基,在37℃继续培养;35)蛋白表达检测:d5天进行荧光检测,计算发光强度均值。
[0008]
进一步的,上述一种sars-cov-2假病毒检测血清中中和抗体滴度的方法,所述步骤35)的荧光检测为luciferase定量测定。
[0009]
进一步的,上述一种sars-cov-2假病毒检测血清中中和抗体滴度的方法,所述luciferase定量测定包括以下步骤:1)样本处理:pbs洗两次,弃去上清,每孔加入40μl细胞裂解液,冰上裂解15min,裂解过程中间断吹打混悬以充分裂解,转移至1.5mlep管中,10000g离心3min,取上清用于测定。
[0010]
2)检测方法:取20μl样品加入检测板中,加入100μl已经溶解并平衡至室温的萤火虫荧光素酶检测试剂,适当混匀。震荡后室温孵育5min,使发光信号趋于稳定。使用化学发光检测仪检测520nm光波长下的luciferase信号值。
[0011]
优选的,使用的化学发光检测仪器型号:spectramaxl。
[0012]
优选的,使用以下试剂盒:bright-lumi
™
萤火虫萤光素酶报告基因检测试剂盒,货号为rg051s;萤火虫萤光素酶报告基因细胞裂解液,货号为rg126s。
[0013]
进一步的,上述一种sars-cov-2假病毒检测血清中中和抗体滴度的方法,所述sars-cov-2假病毒来自北京维通达生物技术有限公司,货号vs-sc-0001。
[0014]
进一步的,上述一种sars-cov-2假病毒检测血清中中和抗体滴度的方法,所述sars-cov-2假病毒以hiv病毒为骨架,外面包被sars-cov-2的spike蛋白,能够感染过表达人ace2的细胞,同时带有fireflyluc和egfp标记,通过fireflyluc和egfp检测感染效率。
[0015]
进一步的,上述一种sars-cov-2假病毒检测血清中中和抗体滴度的方法,所述待测血清来自于经过sars-cov-2疫苗免疫后的阳性血清,优选的,选用三针肌肉注射后的不同时间点采集的大鼠阳性血清。
[0016]
进一步的,上述一种sars-cov-2假病毒检测血清中中和抗体滴度的方法,所述统计学软件为graphpadprism中的log(agonist)vs.response
‑‑
variableslope。
[0017]
进一步的,上述检测方法在新冠疫苗的安全性/有效性评价中的应用。
[0018]
对比本发明优化前的说明书:
原来的假病毒的使用方法步骤(摘自官网维通达http://www.vitalstar.com.cn/index/lists/catid/342.html),作为与本发明方法的比较,包括以下步骤:1.第一天,96孔板每孔接种5000个hace2-cos7细胞。
[0019]
2.第二天,除去培养板里的培养基,新鲜培养基(100μl/孔)与假病毒2
×
103tu和polybrene混合(5ug/ml终浓度),加入培养孔,培养板离心(1200gx2h,4℃)。
[0020]
3.离心感染的细胞,吸干净培养基,再用pbs洗一次;每孔加入30μl0.25%的胰酶,37℃孵育5min,加入100μl完全培养基,继续培养。
[0021]
4.感染后继续培养3天(每天换液),进行luc检测,也可以观察egfp荧光(根据情况更换培养基)。本发明具有以下有益效果:原假病毒说明书的方案只是给出了可以通过fireflyluc和egfp检测感染,而本发明在此基础上,将其开发出可以定量检测打过疫苗的动物的血清的抗体的滴度。本发明所述方法克服了现有方法中无法实现细胞层面定量检测血清中中和抗体滴度的缺陷,灵敏度高,并且可以用于不同种属的实验动物,在新冠疫苗的安全性与有效性评价中有较高的实用价值。
附图说明
[0022]
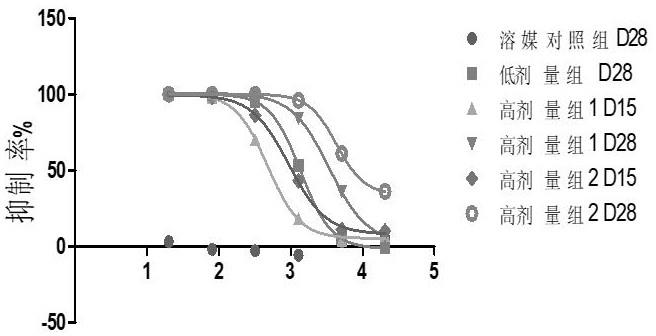
图1为不同剂量组大鼠对sars-cov-2疫苗免疫后血清梯度稀释后的中和抗体抑制率;注:结果已减去空白组背景rlu,通过graphpadprism5.0中log(agonist)vs.response
‑‑
variableslope非线性拟合曲线;纵坐标为中和抗体抑制率,横坐标为log转换后的稀释倍数;图2为不同剂量组大鼠对sars-cov-2疫苗免疫后d28时血清梯度稀释后的中和抗体抑制率;图3为高剂量组1号大鼠对sars-cov-2疫苗免疫后d15和d28时血清梯度稀释后的中和抗体抑制率;图4为高剂量组2号大鼠对sars-cov-2疫苗免疫后d15和d28时血清梯度稀释后的中和抗体抑制率;图5为大鼠对sars-cov-2疫苗免疫后血清中中和抗体检测ec
50
结果;图6为北京天坛假病毒系统—不同种属动物血清梯度稀释后的中和抗体抑制率;图7为维通达假病毒系统
‑‑
不同种属动物血清梯度稀释后的中和抗体抑制率。
具体实施方式
[0023]
下面结合实例对本发明的方法做进一步说明,实施例中未注明具体条件的实验方法,通常可按常规条件,如j.萨姆布鲁克(sambrook)等编写的《分子克隆实验指南》中所述的条件,或按照制造厂商所建议的条件进行。本领域相关的技术人员可以借助实施例更好地理解和掌握本发明。但是,实现本发明的方法不应限于本发明实施例所记载的具体方法步骤。
[0024]
实施例1大鼠对sars-cov-2疫苗免疫后血清中的中和抗体滴度检测1假病毒中和抗体检测结果
sars-cov-2疫苗三针肌肉注射(d1、d7、d15)后的不同时间点(疫苗免疫2针后d15、恢复期结束前d28天)采集大鼠血清,共6个样本,血清来源的大鼠分为3组,1-溶媒对照组(d28的1个样本),2-疫苗低剂量组(d28的1个样本),3-疫苗高剂量组(1号和2号大鼠在d15和d28的4个样本)通过sars-cov-2假病毒中和抗体检测方法(pbnaspseudovirus-basedneutralizationassays),进行1:20、1:80、1:320、1:1280、1:5120、1:20480梯度稀释,检测大鼠血清中不同时间点sars-cov-2的中和抗体水平。
[0025]
抑制曲线结果如图1,d28时如图2,溶媒对照组各稀释倍数抑制率在-6%-6%之间,低剂量组血清在稀释1280倍时抑制率为53%,高剂量组两只动物血清在稀释1280倍时,抑制率分别为84%和96%,呈中和抗体阳性,结果见图3和图4;ec
50
结果如图5,d28时溶媒对照组无法计算ec
50
,疫苗高剂量组ec
50
平均值为3893.5,疫苗低剂量组ec
50
为1374.0。中和抗体抑制率和中和抗体滴度结果均呈时间-剂量依赖关系。统计数据见下表1-3,个体数据见表4。
[0026][0026]
2.实验方法同一批检测板设空白对照(无病毒,无血清,只加细胞培养基),病毒对照(有病毒,无血清),待测血清实验组(病毒和免疫后血清共孵育),排板如下表,除低剂量组外每组2个平行孔。中和抗体抑制率=1-实验组发光强度/病毒对照组发光强度。
[0027]
实验分组及加样说明如下表5所示:
注:x表示细胞培养孔中不加该组分,o表示培养孔中加该组分。
[0028]
96孔板排板如下表6和7所示:
具体实验操作如下:1:细胞铺板:d1在96孔板中每孔接种5000个hace2-cos7细胞,37℃培养过夜。
[0029]
2:样品稀释:d1将待测血清56℃灭活30min,4℃放置过夜(每份40μl),d2将6份血清做系列稀释1:20、1:80、1:320、1:1280、1:5120、1:20480梯度稀释,血清30μl加稀释液570μl,加入24孔板第1列,每孔600μl混匀。后五列每孔加450μl稀释液,排枪将第一列混匀后取150μl加入第二列,依次稀释至第六列弃去150μl。
[0030]
3:中和检测病毒感染:d2从-80℃冰箱中取出sars-cov-2假病毒冰上融化,根据该批次假病毒目的细胞的moi推荐每孔2μl假病毒,样品组将2μl假病毒与98μl稀释后的血清混合,病毒对照组将假病毒与完全培养基混合,37℃孵育1h(配制液为使用体积的1.1倍,即2.2μl假病毒与107.8μl稀释的血清混合)。吸去细胞原有培养液,每孔加入100μl配制好的混合液,空白对照组加入100μl完全培养基,轻轻摇匀,4℃,1200g离心感染2h,弃去含有假病毒的培养基,pbs清洗一遍,每孔加入30μl0.25%的胰酶,37℃消化5min,加入100μl完全培养基,排枪轻轻吹打4-5下重悬均匀,37℃培养过夜。
[0031]
4:细胞换液:d3、d4每天更换培养基,在37℃继续培养。
[0032]
5:蛋白表达检测:d5进行luciferase检测。
[0033]
luciferase定量检测:样本处理:pbs洗两次,弃去上清,每孔加入40μl细胞裂解液,冰上裂解15min,裂解过程中间断吹打混悬以充分裂解,转移至1.5mlep管中,10000g离心3min,取上清用于测定。
[0034]
检测方法:取20μl样品加入检测板中,加入100μl已经溶解并平衡至室温的萤火虫荧光素酶检测试剂,适当混匀。震荡后室温孵育5min,使发光信号趋于稳定。使用化学发光检测仪检测520nm光波长下的luciferase信号值(仪器型号:spectramaxl)。
[0035]
试剂盒:bright-lumi
™
萤火虫萤光素酶报告基因检测试剂盒,货号为rg051s;萤火虫萤光素酶报告基因细胞裂解液,货号为rg126s。
[0036]
防护措施:本实验中所使用的病毒为复制缺陷的假病毒,对人和环境不具有危害性。
[0037]
接触含病毒标本的操作均于负压环境(负压实验室、生物安全柜)中进行。
[0038]
接触病毒的标本和耗材废弃前用10%的84消毒液中浸泡高温高压消毒。疑似污染标本或区域(如用于储存样品的离心管表面)用医用酒精消毒。
[0039]
实施例2与其他体系的假病毒中和抗体检测方法对比,并加入阳性抗体:用我们的方法和北京天坛药物生物技术开发公司提供的方法检测相同的5个样本和阳性抗体,进行对比。同时检测其他种属(恒河猴)是否有和假病毒的非特异性结合。
[0040]
样本信息:2只恒河猴的空白血清,3只sd大鼠疫苗免疫后的血清(3只大鼠分别来源于佐剂对照组,疫苗低剂量组,疫苗高剂量组),阳性抗体信息:新型冠状病毒中和抗体,批号:20200615,(赠送)提供单位:昭衍生物;原浓度0.92mg/ml,稀释20倍为0.046mg/ml。
[0041]
1.北京天坛药物生物技术开发公司来源的中和抗体检测结果按照推荐细胞数量和假病毒最适感染滴度加入(货号:80033,批号:20200904,滴度:95000tcid
50
/ml,建议稀释倍数:7),感染hace2-cos7,2只猴和1只鼠的阴性背景接近0%,低剂量大鼠血清中和抗体的滴度为3579,高剂量大鼠血清中和抗体的滴度为6514,终浓度为0.046mg/ml的阳性抗体梯度稀释后中和抗体抑制率均为100%。该实验cc,vc有三个复孔,其他无复孔。检测结果如图6和表8-9所示。
[0042]
2.维通达来源的假病毒中和抗体检测结果按照推荐细胞数量和假病毒最适感染滴度加入(批号:20200904,滴度:1.6
×
106tu/ml,稀释倍数:38,每孔约2000tu),感染hace2-cos7,2只猴和1只鼠的阴性背景接近0%,未见与假病毒的非特异性结合,低剂量组大鼠血清中和抗体的滴度为1233,高剂量组大鼠血清中和抗体的滴度为1665,检测结果呈剂量-效应依赖关系,终浓度为0.046mg/ml的阳性抗体梯度稀释后中和抗体抑制率均为100%,该实验cc,vc有六个复孔,其他无复孔,结果见附图7和表10和表11。
[0043]043]
综上,该假病毒的中和抗体检测方法与其它体系的检测方法的结果具有可比性,猴和大鼠的空白血清均无非特异性结合,阳性抗体在20-20480倍稀释过程中中和抗体抑制率均为100%,体系验证通过,灵敏度为0.045μg/ml。
[0044]
以上仅为本发明的较佳实施例而已,不能以此限定本发明的保护范围,即大凡依
本发明权利要求书及内容所做的简单的等效变化与修改,皆仍属于本发明专利申请的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1