一种基于秀丽隐杆线虫高通量检测污水毒性的方法
1.本发明涉及环境污染物毒性检测技术领域,具体为一种基于秀丽隐杆线虫高通量检测污水毒性的方法。
背景技术:
2.水质毒性评价技术能反映水质的总体毒性效应,被广泛应用于污水处理技术的评估中。有研究
1.表明污水处理新技术在降低常规理化指标参数时也会导致潜在生态风险危害,而目前污水评价方法多以化学检测为主,污水水质复杂性使单一的化学检测难以评估污水的实际危害,亟需引入生物毒性检测方法对污水的整体毒害效应进行评估。因此对市政污水开展水质生物毒性监测可以对处理技术的效能评价具有一定的指导作用,对于保护人类健康和维持生态系统稳定具有非常重要的意义。
3.目前已经有许多学者应用水质毒性评价开展污水处理工艺对水质生态毒性削减的研究,采用的生物测试终点如斑马鱼遗传毒性
2.、秀丽隐杆线虫子代数
3.、存活率
[4,5]
、大型溞急性毒性
[6]
、发光菌急性毒性
1.等,其中秀丽隐杆线虫是环境暴露与生态毒理研究中常用的模式生物,其具有较短的生命周期和繁殖周期等特点使得其具有高通量评价市政污水毒性的潜力。秀丽隐杆线虫的水环境毒性评价技术在国际上已有iso-10872标准,是12孔板暴露96h后检测体长与子代数,但存在实验通量较低、测量或计数采用人工方式来进行、单个样本检测耗时长、检测指标维度普遍单一等问题,难以从多角度综合呈现所检测样本对秀丽隐杆线虫的干扰作用;且人工计数数据可信度难以保证,如由不同人检测线虫摆动频次的计数结果差别大,不适用于开展大样本量毒性检测。因此,本发明提供了一种基于秀丽隐杆线虫高通量检测污水毒性的方法以有效解决上述技术问题。
技术实现要素:
[0004]
发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供一种基于秀丽隐杆线虫高通量检测污水毒性的方法。
[0005]
为了解决上述技术问题,本发明公开了一种基于秀丽隐杆线虫高通量检测污水毒性的方法,包括以下步骤:
[0006]
(1)将污水过膜调节ph后萃取,干燥后与有机溶剂水溶液复溶,再经k缓冲液(k medium溶液)稀释,得到染毒液;
[0007]
(2)将l1期秀丽隐杆线虫加入k缓冲液,即得虫液;所述虫液中线虫数量为20~30条/20μl;
[0008]
(3)染毒液暴露组:将步骤(1)所得染毒液、步骤(2)所得虫液,以及op50浓缩液(e.coli op50的浓缩菌)混合暴露;空白对照组:用k缓冲液替代染毒液暴露组中的染毒液;
[0009]
(4)暴露后,将线虫转移至含有琼脂垫片的孔板中,拍摄线虫的运动视频;
[0010]
(5)使用wormlab软件分析步骤(4)拍摄的视频,经分析表征得到线虫的指标,并通过如下公式计算各指标的抑制率i或各指标相对于空白对照组的值i’;所述线虫的指标为
线虫的体长、体宽、体面积,线虫运动轨迹的波长、振幅、最大振幅,线虫活性的摆动频率、游泳速度和活力中的任意一种或几种指标;
[0011][0012]
i’=i1/i0[0013]
其中,i为各指标的抑制率,i’为各指标相对于空白对照组的值,i0为空白对照组的指标值,i1为染毒液暴露组的指标值。
[0014]
步骤(1)中,所述过膜为过0.45μm的醋酸纤维滤膜以去除大颗粒杂质,收集滤液;所述ph为2~3,优选为ph为2。
[0015]
步骤(1)中,所述萃取为采用oasis hlb(waters)固相萃取柱对水样中有机污染物进行富集萃取,具体包括以下步骤:
[0016]
s0:活化:用甲醇/乙酸乙酯(50:50,v:v)活化hlb小柱,接着用盐酸酸化至ph=2
±
0.5的超纯水活化hlb小柱;
[0017]
s1:上样吸附:将调节ph后污水上样至oasis hlb固相萃取柱;
[0018]
s2:淋洗干燥:用ph 2
±
0.5的超纯水淋洗,干燥;
[0019]
s3:梯度洗脱:先用甲醇与乙酸乙酯的混合溶液进行第一洗脱,再用含2%氨水的甲醇与乙酸乙酯的混合溶液进行第二洗脱,最后用含1.7%甲酸的甲醇与乙酸乙酯的混合溶液进行第三洗脱,收集洗脱液。
[0020]
步骤s0仲,活化溶剂的流速均为10ml/min,活化溶剂量均为6ml。
[0021]
步骤s1中,上样流速为10ml/min,上样量为3l。
[0022]
步骤s2中,淋洗流速为10ml/min,淋洗量为6ml。
[0023]
步骤s2中,所述干燥的判断标准是干燥的白线是否出现;所述干燥为抽干,需0.5h左右,或氮气吹干,需5min左右。
[0024]
步骤s3中,所述第一洗脱过程中,洗脱流速为0.9ml/min,洗脱剂量为6ml;所述第二洗脱过程中,洗脱流速为0.9ml/min,洗脱剂量为6ml;所述第三洗脱过程中,洗脱流速为0.9ml/min,洗脱剂量为6ml。
[0025]
步骤s3中,所述混合溶液中,甲醇,或含氨水的甲醇,或含甲酸的甲醇,与乙酸乙酯的体积比为1:1。
[0026]
步骤(1)中,将污水过膜调节ph后萃取,微弱氮气吹干后与10%的二甲基亚砜(dmso)水溶液复溶,再经k缓冲液(k medium溶液)稀释,稀释成相对富集倍数为30的染毒液,得到染毒液。
[0027]
步骤(2)中,染毒前一天对产卵期线虫同步化,同步化17-24h,得到处于l1时期的秀丽隐杆线虫。
[0028]
步骤(2)中,将l1期秀丽隐杆线虫加入k缓冲液,显微镜下观察20μl虫液中所包含的l1期线虫的数量,通过再次加入k medium或者离心后吸走少许上清液,以确保20μl虫液中线虫数量在20~30条,避免同一孔中线虫密度过高影响平行性即得虫液。
[0029]
步骤(3)中,所述op50浓缩液(e.coli op50的浓缩菌)的制备方法为(i)将e.coli op50划线于lb平板,在37℃恒温培养箱中培养48h,从固体培养基上调取一个单菌落放入200ml lb液体培养基的锥形瓶中37℃下220rpm过夜震荡培养17h至od
600
在0.4~0.6之间,
分装在50ml离心管内;(ii)步骤(i)所得菌液于7000rpm离心5min后倒上清,无菌环境下加入k medium,震荡摇匀后再次离心,重复3~5次彻底洗去lb培养基后,加入k medium定容至25ml,获得e.coli op50浓缩菌。
[0030]
步骤(3)中,所述染毒液、虫液和op50浓缩液的体积比为100:10~30:90~70。
[0031]
步骤(3)中,所述暴露为于12~25℃下震荡40~55h,优选为20℃恒温震荡器内暴露50h,振速设为200rpm。
[0032]
步骤(4)中,将线虫转移至含有琼脂垫片的孔板中适应30s~2min,拍摄线虫的10s~30s的运动视频,优选为适应1~2min,拍摄线虫的20s的运动视频。
[0033]
步骤(5)中,所述线虫活力为单位时间内线虫每两个stroke间扫过的像素数目,可表征游泳时身体弯曲的活泼度、精神旺盛度。
[0034]
综上,本发明在iso-10872标准的基础上建立了基于秀丽隐杆线虫的高通量水质毒性检测体系:本发明采用了96孔板暴露线虫,提升了毒性实验暴露通量,并放弃对子代数指标的检测,增添表征野生型线虫发育、运动和活性的共9种指标,并将检测结点提前至暴露后的50h,即在原本的l1期成长为产卵期的时间点提前到l1期成长为l4期的时间点检测各项生理指标,缩短了实验周期。本发明还结合wormlab图像识别软件扩充检测指标类别,提高测量指标数据的准确度。本发明所提供的方法为在一定时间内完成大批量污水样品的毒性筛查工作奠定基础。
[0035]
有益效果:与现有技术相比,本发明具有如下优势:
[0036]
本发明采用秀丽隐杆线虫作为模式生物建立一种基于秀丽隐杆线虫高通量检测污水毒性的方法,首先同步化线虫,得到l1时期线虫,并以96孔板作为暴露载体,再添加暴露液、大肠杆菌e.coli op50作为食物,暴露时间缩短为50h,以生长发育、运动、活性三类九个指标为毒性终点,提高检测通量的同时也节省了样品使用量和实验时间,操作简单,分析结果可靠。
附图说明
[0037]
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
[0038]
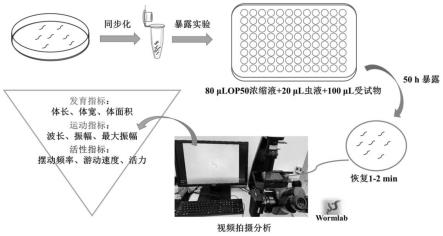
图1为基于秀丽隐杆线虫的市政污水毒性高通量检测流程图。
[0039]
图2为产卵期的秀丽隐杆线虫(a)及同步化获得的虫卵(b)图。
[0040]
图3为某市政污水厂沿程处理工段对线虫发育、运动行为、活性的影响结果图。
[0041]
图4为某市政污水厂沿程处理工段对线虫生长发育、运动、活力的干扰影响结果图,ref=15(*:p《0.05,**:p《0.01)。
具体实施方式
[0042]
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
[0043]
下述实施例中所用材料如下:
[0044]
秀丽隐杆线虫caenorhabiditis elegans(购于国际线虫遗传中心caenorhabiditis genetics center)。
[0045]
尿嘧啶缺陷型大肠杆菌e.coli op50(购于国际线虫遗传中心caenorhabiditis genetics center)。
[0046]
ngm固体培养基:1.2g nacl,1.0g蛋白胨,6.8g琼脂,溶于400ml milliq water,121℃灭菌20min后,于水浴锅降温至55℃,然后在无菌条件下加入400μl 1m的cacl2,400μl 1m的mgso4,400μl 5mg/l胆固醇溶液,10ml 1m磷酸盐缓冲液,充分混匀后在超净台中倒入60mm直径的培养皿中,每个倒入10ml左右的ngm培养基,室温下凝固,4℃储存备用;其中,1m cacl2溶液:称取4.44gcacl2,加入去离子水至40ml,超声使其充分溶解,过膜后备用;1m mgso4溶液:称取mgso4·
7h2o 9.8592g,加入去离子水至40ml,超声使其充分溶解,过膜后备用;5mg/l胆固醇溶液:称胆固醇0.2g,加入40ml无水乙醇,超声使其充分溶解,过膜后备用;1m磷酸钾缓冲液:称取108.3g kh2po4,46.648g k2hpo4·
3h2o,加入去离子水至1l,并调节ph至6.0,揽匀后在121℃下灭菌20min。
[0047]
k medium(k缓冲液):2.386g kcl,2.98g nacl,加去离子水至1l,搅匀后在121℃下灭菌20min。
[0048]
裂解液:700μl k-medium,200μl 5%naclo,100μl 5m naoh混匀,配置成1ml体系下的裂解液,现用现配;其中,k medium:3.8g nacl,2.975g kcl,加入1l milliq water中溶解,121℃灭菌,冷却到室温。
[0049]
琼脂垫片:称取琼脂糖4g溶于200ml milliq water中,加热至沸腾,趁热转移至六孔板中,每孔2.5ml琼脂液体,表面尽量光滑平整,室温下冷却,凝固后置于4℃下冷藏备用。该琼脂垫片用于线虫观察的载体。
[0050]
e.coli op50的培养:将e.coli op50冻藏管从-20℃冰箱取出,待其稍有融化,在无菌条件下用接种环取少许划线于lb平板,在37℃恒温培养箱中培养48h,从固体培养基上调取一个单菌落放入200ml lb液体培养基的锥形瓶中,另准备一支装有200ml lb液体培养基的锥形瓶做空白对照。37℃下220rpm过夜震荡培养17h至od
600
在0.4~0.6之间。其中,lb液体培养基:10g蛋白胨,5g酵母粉,5g nacl,加去离子水至1l,用naoh溶液调节培养基ph至7.0,搅匀后在121℃下灭菌20min。
[0051]
线虫的培养与传代:吸取100μl的e.coli op50菌液滴加在60mm的ngm固体培养基表面上,用酒精灯灼烧涂布棒,冷却后在ngm固体培养基表面轻轻将菌液抹匀。室温放置使菌液吸收,将培养皿转移至20℃无菌生化培养箱培养48h左右。大肠杆菌在培养基上形成薄薄的一层菌面且无杂菌污染时,便可以用于培养秀丽隐杆线虫。少量传代时使用挑虫针在显微镜下挑取处于产卵期的单个雌雄同体的线虫转移到涂有的op50培养基中培养(每次使用挑虫针之前要用酒精灯灼烧)。大量传代时先将手术刀用酒精灯灼烧灭菌,稍凉后切一块含有线虫较多的培养基,倒置放于新的涂有e.coli op50的ngm培养基上,线虫会自动爬到新培养基表面。当培养基表面没有大肠杆菌e.coli op50时,对线虫再进行传代,转到新涂有op50的培养基上,所有的秀丽隐杆线虫都在20℃培养箱中培养。
[0052]
e.coli op50浓缩菌配制:为使实验暴露体系中op50浓缩液的od
600
保持在0.4-0.6之间,提前配备e.coli op50浓缩菌,作为秀丽隐杆线虫实验暴露中的食物供给来源。将前述的37℃220rpm条件下震荡17h后获得的op50菌液在无菌环境下分装至50ml离心管,7000rpm离心5min后倒上清,无菌环境下加入k medium,震荡摇匀后再次离心,重复3~5次彻底洗去lb培养基后,加入k medium定容至25ml,获得e.coli op50浓缩菌。为排除op50对
暴露体系中致毒物质的分解作用而影响秀丽隐杆线虫表征样品毒性,造成实验误差,实验前将e.coli op50浓缩菌放置于65℃烘箱30min以灭活
[7]
。
[0053]
各实施例所使用的检测设备为倒置荧光显微镜(nikon,ts2-fl,日本)。
[0054]
实施例1:一种基于秀丽隐杆线虫的市政污水毒性高通量检测方法(图1)
[0055]
(1)3l某市政污水水样低温运送至实验室之后立刻过0.45μm的醋酸纤维滤膜以去除大颗粒杂质。
[0056]
其中,市政污水水样包括该污水处理厂的进水、缺氧池出水、好氧池出水、二沉池出水、污水处理厂最终出水水样。
[0057]
(2)加盐酸调节过滤后水样为ph≈2.0。
[0058]
(3)采用oasis hlb(waters)固相萃取柱对水样中有机污染物进行富集萃取,具体步骤为:
[0059]
①
活化:用甲醇/乙酸乙酯(50:50,v:v)6ml活化hlb小柱,接着用盐酸酸化至ph=2
±
0.5的超纯水6ml活化hlb小柱;其中,活化溶剂的流速均为10ml/min;
[0060]
②
上样:上样体积为3000ml,流速10ml/min;
[0061]
③
淋洗:盐酸酸化至ph=2
±
0.5超纯水6ml;流速为10ml/min,干燥1h;
[0062]
④
洗脱:第一洗脱过程的洗脱液为甲醇/乙酸乙酯(50:50,v:v),总体积为6ml,流速为0.9ml/min,第二洗脱过程的洗脱液为含体积百分比2%v/v氨水的甲醇/乙酸乙酯(50:50,v:v),总体积为6ml,流速为0.9ml/min;第三洗脱过程的洗脱液为含体积百分比为1.7%v/v甲酸的甲醇/乙酸乙酯(50:50,v:v),总体积为6ml,流速为0.9ml/min;收集三个洗脱过程的洗脱液于一个试管中。
[0063]
(4)微弱氮气吹干步骤(3)所得洗脱液,然后加入体积比为10%的二甲基亚砜(dmso)水溶液1ml对干燥的洗脱液复溶,涡旋振荡后用0.45μm有机相滤头过滤,将滤液转移至1ml色谱小瓶中,放置在-20℃冰箱保存待使用;此时的样品富集倍数为3000倍。
[0064]
(5)用k medium将步骤(4)制备好的3000倍市政污水浓缩水样,取适量稀释成相对富集倍数为30的染毒液,即稀释100倍。具体为1.5ml离心管中,加入396μl k medium和4μl步骤(4)制备好的样品浓缩液,吹吸混匀。
[0065]
(6)染毒前一天对产卵期线虫进行同步化操作:
[0066]
选择大部分处于产卵期秀丽隐杆线虫的ngm培养皿,用1.5ml k medium从ngm固体培养基表面冲洗下大量处于产卵期的秀丽隐杆线虫,转移至1.5ml离心管。静置1-2min后,处于产卵期的秀丽隐杆线虫自然沉在底部,吸去上清液,加入新的k medium并摇匀,重新沉淀去上清,然后加入1ml裂解液,每30s震荡一次,直至线虫裂解为2-3段使得卵释放出来,接着2500rpm离心2min,弃上清,加入1ml k medium摇匀,再2500rpm离心2min后弃上清,此为清洗步骤,该清洗步骤重复4次,待虫卵洗干净弃去上清液后,加入0.5ml k medium至离心管,吹吸混匀虫卵,转移至35mm培养皿中(35mm培养皿中有3ml k medium),再次吹吸混匀,放20
±
1℃培养箱中17h,实验当天得到都处于l1时期的线虫。
[0067]
(7)将孵化好的l1期线虫连同k medium转移至1.5ml离心管中,吸取20μl虫液滴加在透明载玻片上,显微镜下观察20μl虫液中所包含的l1期线虫的数量。通过再次加入k medium或者离心后吸走少许上清液,以确保20μl虫液中线虫数量在20~30条,避免同一孔中线虫密度过高影响平行性。
[0068]
(8)市政污水染毒液暴露组:96孔板作为载体,每孔的暴露体系为加入100μl的步骤(5)制备好的市政废水染毒液+80μl op50浓缩液(见实施例材料中e.coli op50浓缩菌)+20μl步骤(7)制备好的虫液,此时暴露组体系的染毒液的相对富集倍数是原水的15倍。暴露方式为20℃恒温震荡器内暴露50h,振速设为200rpm。每组3个平行孔。
[0069]
空白对照组:用100μl k medium替代市政污水染毒液暴露组中的染毒液,其余相同。
[0070]
(9)暴露50h后,分别将暴露组和空白对照组中的线虫转移到含有琼脂垫片的6孔板中适应1min,随机挑选20只线虫进行拍摄,然后每只线虫拍摄20s运动视频。
[0071]
(10)使用wormlab软件分析步骤(9)所拍摄的视频,经分析得到表征线虫生长发育的体长、体宽和体面积,表征线虫运动轨迹的波长、振幅和最大振幅,表征线虫活性的摆动频率、游泳速度和活力的抑制率,通过如下公式计算各指标的抑制率i或各组指标相对于空白对照组的值i’:
[0072][0073]
i’=i1/i0[0074]
其中,i为各指标的抑制率,i’为各组指标相对于空白对照组的值,i0为空白对照组的指标值,i1为市政污水染毒液暴露组的指标值。
[0075]
实施例中产卵期秀丽隐杆线虫及其同步化获得的卵、某市政污水沿程工段毒性检测结果见图2-3。
[0076]
图2为产卵期的秀丽隐杆线虫及同步化获得的虫卵实物图,展示的是产卵期线虫挑选和同步化操作后的虫卵情况。
[0077]
图3为某市政污水厂沿程处理工段对线虫发育、运动、活性影响结果图,图a是各沿程工段15倍浓缩样品暴露后各项指标相对于空白对照的比值,图b是沿程工段对于线虫发育影响的直观效果图。图中1-inf、2-a2、3-o、4-sed、5-eff、ck分别表示该污水处理厂的进水、缺氧池出水、好氧池出水、二沉池出水、污水处理厂最终出水水样的15倍浓缩样暴露组和空白对照组。对于发育指标,线虫相对体长由进水处的0.54
±
0.02增长至出水处的0.89
±
0.02,体宽体面积的变化规律与体长类似;运动轨迹特征上,线虫的运动轨迹相对波长由进水处0.51
±
0.04逐渐增大至出水处的0.92
±
0.07,相对平均振幅由进水处0.54
±
0.07降至缺氧段0.45
±
0.08后,逐渐回升至出水段的0.77
±
0.02。运动状态的特征上,线虫进水处相对摆动频率为0.74
±
0.18,在二沉池段的头部摆动最为活跃,升致1.22
±
0.14,出水段回落至1.07
±
0.37。线虫相对游泳速度在进水段为0.49
±
0.08,在出水段升至全流程段最高的1.19
±
0.17。总体上呈现由进水到出水各指标抑制率逐渐降低的趋势,且各项指标在出水段相较于空白对照的比值趋近于1。综上所述,可以看出本发明的样品浓缩倍数以及各个检测指标可以较好的区分市政污水处理厂的沿程工艺的生长、运动行为的毒性情况。
[0078]
实施例2
[0079]
同实施例1,仅将污水分别用江苏省某市政污水厂的进水、厌氧段出水、缺氧段出水、好氧段出水、二沉池出水、滤池出水、最终出水中污水替换,结果如图4所示。
[0080]
图4为实施例的基于野生型秀丽隐杆线虫的使用本发明高通量检测方法得到的江苏省某市政污水厂沿程处理工段水样的9个指标数据结果图,相对富集倍数是15,图中每张
小图的横坐标inf、a1、a2、o、sed、filter、eff、ctrl分别代表该污水处理厂进水、厌氧段、缺氧段、好氧段、二沉池、滤池、出水和空白对照暴露组。
[0081]
体宽、体长、体面积都是表征线虫生长发育的指标,该市政污水的进水暴露下线虫百分之百致死,除缺氧段其余工段水样均显著抑制线虫体长,厌氧、好氧、二沉、滤池、出水段水样15倍浓缩倍数暴露下,线虫体长相对抑制率分别为36.86
±
3.12%、9.18
±
6.74%、23.29
±
7.31%、21.55
±
7.34%和18.52
±
5.78%。对于线虫体宽,厌氧段、缺氧段的相对体宽抑制率分别为20.88
±
4.32%,-6.74
±
5.32%,其中缺氧段为促进体宽发育。对于线虫体面积,厌氧段、二沉池段、滤池段的相对抑制率分为54.18
±
3.23%、31.11
±
4.19%、20.76
±
3.32%。
[0082]
线虫自然运动时运动轨迹呈正弦波形,选取正弦波的平均波长、平均振幅与最大振幅三个指标用于描述线虫运动轨迹特征的变化。对于平均波长,厌氧、二沉池与滤池的波长抑制率分别为35.38
±
2.43%、23.09
±
2.32%和28.15
±
2.43%。对于平均振幅,厌氧、滤池和出水段的平均振幅抑制率分别为30.68
±
2.32%、24.69
±
5.43%和18.62
±
3.11%。对于最大振幅,厌氧和滤池段的最大振幅抑制率分别为19.77
±
5.21%和13.47
±
2.31%。
[0083]
线虫的头部摆动频率、游动速度和活力可以表征线虫的具体运动状态,反映线虫的运动能力。其中只有活力指标在厌氧段15倍暴露下与对照组间有显著性差异。
[0084]
综上述结果,15倍的市政污水各工段浓缩水样暴露下的秀丽隐杆线虫致死率适中,本发明选用的大部分指标在实验倍数下与空白对照间有显著性差异,可以体现出各工段间的毒性差异。对于该污水处理厂,线虫的发育及运动轨迹相关的指标能比运动指标更好的区分不同工段的毒性差异。
[0085]
参考文献
[0086]
[1]huang m-h,li y-m,gu g-w.toxicity reduction of municipal wastewater by anaerobic-anoxic-oxic process[j].biomedical and environmental sciences,2010,23(6):481-6.
[0087]
[2]张晶.a/o、a2/o和典型高级氧化技术对污水毒性削减效果研究[d];大连理工大学.
[0088]
[3]abbas a,valek l,schneider i,et al.ecotoxicological impacts of surface water and wastewater from conventional and advanced treatment technologies on brood size,larval length,and cytochrome p450(35a3)expression in caenorhabditis elegans[j].environmental science&pollution research international,2018,(6):1-13.
[0089]
[4]xue h,xin j,xuan m,et al.an investigation of changes in water quality throughout the drinking water production/distribution chain using toxicological and fluorescence analyses[j].journal of environmental sciences,2020,32(1):310-8.
[0090]
[5]spasiano d,russo d,vaccaro m,et al.removal of benzoylecgonine from water matrices through uv254/h2o2 process:reaction kinetic modeling,ecotoxicity and genotoxicity assessment[j].journal of hazardous materials,2016,318:515-25.
[0091]
[6]徐晓平,李济源,曹怀礼.市政污水对大型蚤急性毒性评价研究[j].西安文理学院学报:自然科学版,2017,20(2):5.
[0092]
[7]zheng s q,ding a j,li g p,et al.drug absorption efficiency in caenorhabditis elegans delivered by different methods[j].plos one,2013,8(2):e56877.
[0093]
本发明提供了一种基于秀丽隐杆线虫高通量检测污水毒性的方法的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1