用于乳腺癌HER2-ECD检测的电致化学发光能量共振转移适体传感器
用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感器
技术领域
1.本发明涉及电化学检测技术领域,具体涉及一种用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感器及其检测方法。
背景技术:
2.乳腺癌(breast cancer,bc)是发生在乳腺上皮或导管上皮的恶性肿瘤。多年来,全球乳腺癌的发病率不断上升,据报道,每年有超过100万的新病例。相对于其它癌症,乳腺癌在女性中的患病率很高,对女性的生命健康产生巨大的威胁,如果不及早诊断,这种疾病最严重会导致死亡。因此,需要开发一种经济、灵敏、快速的乳腺癌检测方法,在乳腺癌发展的早期给予正确、及时的治疗,从而抑制乳腺癌的进一步发展。人表皮生长因子受体2(her-2)是乳腺癌预后的重要判断因子,它编码相对分子量185kd的跨膜受体样蛋白,具有酪氨酸激酶活性。人表皮生长因子受体 2 (her2) 由细胞外结构域 (ecd)、亲脂性跨膜区和细胞内结构域 (icd) 组成。确定 her2 状态的最常用方法是免疫组织化学。然而,有时会给出假阴性结果,这会导致一些患者失去抗 her2 治疗的机会。
3.除细胞her2外,通过adam(一种去整合素和金属蛋白酶)蛋白酶介导的膜结合her2的裂解释放到循环中的her2胞外区(her2-ecd)水平已被证明与原发性乳腺癌患者和转移癌患者的肿瘤负担有关。对her2-ecd循环水平的分析被建议作为评估her-2水平、预测治疗反应和监测治疗反应的传统方法的微创替代方法。
4.目前,her2-ecd的分析技术主要集中在酶联免疫吸附试验(elisa),虽被广泛应用但也存在些许不足,如elisa常会存在假阳性,容易受到干扰物的影响。因此,随着血清her2-ecd临床实用性的提高,发展一种灵敏、经济和快速的检测方法,建立其准确的定量分析方法具有重要的意义。
技术实现要素:
5.为了解决现有技术中的问题,本发明提供一种用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感器。本发明以金纳米粒子(au nps)修饰的聚二烯丙基二甲基氯化铵(pdda)功能化的石墨相氮化碳(g-c3n4)复合发光材料作为基底信号材料,以金铂(aupt)修饰的金属有机框架材料(mof)作为信号猝灭材料,通过金属纳米粒子与氨基的键合作用装载大量her2-ecd结合适体链的部分互补链2(pdna),用6-巯基己醇(mch)封闭未结合的活性位点,最终制备得到了aupt@zif-67/pdna基底信号猝灭溶液。值得注意的是,zif-67的紫外光谱与g-c3n4的ecl光谱有重叠,由于ecl-ret效应而猝灭g-c3n4的ecl信号,并且在zif-67表面修饰了aupt之后能有效地提高mof的稳定性,且aupt作为her2-ecd结合适体链的部分互补链2(pdna)的活性结合位点,提高pdna负载量。因此,本发明以au nps/g-c3n4/pdda复合发光材料为基底、aupt@zif-67/pdna基底信号猝灭溶液,利用能量共振转移(ecl-ret)效应,实现了对her2-ecd的超灵敏检测,为乳腺癌患者早期诊断提供新的诊断途径。
6.除特殊说明外,本发明所述份数均为重量份,所述百分比均为质量百分比。
7.为实现上述目的,本发明的技术方案为:一种用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感器,其特征在于,所述构建用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感器的方法为:将基底材料au nps/g-c3n4/pdda分散液滴加到清洁的玻碳电极表面,室温干燥后再将cdna滴加到电极表面,4-5℃孵育12-13 h;再将mch溶液滴加到电极上,室温孵育30-35 min;然后将apt滴加在电极上,室温孵育1-2 h;最后将aupt@zif-67/pdna基底信号猝灭溶液滴加到电极上,室温孵育3-4 h,即得到用于her2-ecd检测的电致化学发光适体传感器。
8.所述基底材料au nps/g-c3n4/pdda分散液的制备方法为将g-c3n4/pdda分散液加入到胶体金纳米粒子(au nps)溶液中,搅拌6-7 h,离心、洗涤,再将沉淀物分散在超纯水中,即得到分散均匀的au nps/g-c3n4/pdda分散液。
9.所述g-c3n4/pdda分散液:g-c3n4溶于超纯水中,超声分散均匀,加入pdda溶液(5 wt%),磁力搅拌12-13h,离心、洗涤,再将沉淀物分散在超纯水中,即得到分散均匀的g-c3n4/pdda分散液。
10.所述aupt@zif-67/pdna基底信号猝灭溶液的制备方法为:称取aupt@zif-67纳米复合物粉末溶于超纯水中,超声分散均匀,加入her2-ecd结合适体的部分互补链2(pdna),冰浴搅拌12-13 h,离心,水洗,将沉淀物重新分散于超纯水中,加入6-巯基己醇(mch)溶液,搅拌1-2h,离心,水洗,将沉淀物重新分散于超纯水中,即得到aupt@zif-67/pdna基底信号猝灭溶液。
11.所述aupt@zif-67纳米复合物的制备方法为:称取六水硝酸钴(co(no3)2·
6h2o)和2-甲基咪唑(c4h6n2)溶解于无水甲醇中,在超声的作用下,缓慢加入c4h6n2溶液,继续超声反应1-2h;然后将k2ptcl
6 (0.3 wt%)和haucl
4 (0.2 wt%)加入到混合溶液中,并将反应搅拌3-4小时;最后分离产物,用无水甲醇洗涤,离心,80-85℃真空干燥,得到aupt@zif-67纳米复合物。
12.所述胶体金纳米粒子(au nps)溶液的制备方法为:将1%haucl4添加到超纯水中,加热至沸腾,然后将1%柠檬酸三钠加入到煮沸的溶液中,当溶液颜色由蓝色变成红色时,将混合物保持沸腾15-20分钟,冷却至室温,加入超纯水分散得到胶体金纳米粒子(au nps)溶液。
13.上述aupt@zif-67/pdna基底信号猝灭溶液的制备方法,包括如下步骤;1)aupt@zif-67:首先,称取六水硝酸钴(co(no3)2·
6h2o)和2-甲基咪唑(c4h6n2),溶解于无水甲醇中;在超声的作用下,将c4h6n2溶液缓慢倒入co(no3)2·
6h2o溶液中,然后继续超声反应1h;将k2ptcl
6 (0.3 wt%)和haucl
4 (0.2 wt%)加入到混合溶液中,并将反应搅拌3小时;最后用无水甲醇洗涤3次,离心,80℃真空干燥,得到aupt@zif-67纳米复合物;2)aupt@zif-67/pdna:称取步骤1)制得的aupt@zif-67粉末,溶于超纯水中,超声分散均匀,加入her2-ecd结合适体的部分互补链2(pdna),冰浴搅拌12 h,离心,水洗,将沉淀物重新分散于超纯水中加入1mm 6-巯基己醇(mch)溶液,搅拌1h,离心,水洗,将沉淀物重新分散于超纯水中,即得到aupt@zif-67/pdna基底信号猝灭溶液。
14.具体的说,一种用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感
器,其特征在于,所述构建用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感器的方法包括如下步骤:(1)基底材料的制备;1)au nps:将1ml(1%)haucl4添加到100ml超纯水中并加热至沸腾,然后将2.5ml(1%)柠檬酸三钠快速加入到煮沸的溶液中;当溶液颜色由蓝色变成红色时,将混合物保持沸腾15分钟,冷却至室温,加入超纯水定容至100ml,得到胶体金纳米粒子(au nps);2)g-c3n4/pdda分散液:称取2mg的g-c3n4,溶于2ml超纯水中,超声分散均匀,加入600ml pdda溶液(5 wt%),磁力搅拌12h,离心、洗涤,再将沉淀物分散在2ml超纯水中,即得到分散均匀的g-c3n4/pdda分散液;3)au nps/g-c3n4/pdda分散液:取2ml 步骤2)制得的g-c3n4/pdda分散液,加入600 ul步骤1)制得的au nps,搅拌6 h,离心、洗涤,再将沉淀物分散在1ml超纯水中,即得到分散均匀的au nps/g-c3n4/pdda分散液;(2)信号猝灭材料的制备;1)aupt@zif-67:首先,称取六水硝酸钴(co(no3)2·
6h2o,0.582g)和2-甲基咪唑(c4h6n2,0.656g)分别溶解于25ml无水甲醇中;在超声的作用下,将c4h6n2溶液缓慢倒入co(no3)2·
6h2o溶液中,然后继续超声反应1 h;其次,将2 ml k2ptcl
6 (0.3 wt%)和3 ml haucl
4 (0.2 wt%)加入到混合溶液中,并将反应搅拌3小时;最后用无水甲醇洗涤3次,离心,80℃真空干燥,得到aupt@zif-67纳米复合物;2)aupt@zif-67/pdna:称取2mg步骤1)制得的aupt@zif-67粉末,溶于1ml超纯水中,超声分散均匀,加入2μm her2-ecd结合适体的部分互补链2(pdna)200μl,冰浴搅拌12 h,离心,水洗,将沉淀物重新分散于1ml超纯水中加入200μl 1mm 6-巯基己醇(mch)溶液,搅拌1h,离心,水洗,将沉淀物重新分散于500μl超纯水中,即得到aupt@zif-67/pdna基底信号猝灭溶液;(3)用于her2-ecd检测的电致化学发光能量共振转移(ecl-ret)适体传感器的构建:1)用20 mm tris-hcl(ph=7.4)缓冲液室温下处理her2-ecd结合适体(apt)、apt的部分互补链1(cdna)和apt的部分互补链2(pdna),4℃储存备用;2)将玻碳电极用食人鱼洗液(98% h2so4/30% h2o
2 = 3:1, v/v)浸泡30 min后用超纯水冲洗干净备用;3)将步骤2)得到的电极分别用0.3 μm和0.05 μm的al2o3粉末抛光呈镜面,然后分别按超纯水、无水乙醇、超纯水的顺序超声处理电极,干燥备用;4)将步骤3)得到的电极在0.5 m h2so4中进行电化学活化,然后用超纯水冲洗,干燥;5)将10 μl所述的基底材料au nps/g-c3n4/pdda溶液滴加到步骤4)清洁的玻碳电极表面上,室温干燥;6)将10 μl步骤1)制得的cdna,滴加在步骤5)制备得到的电极4℃孵育12 h;7)将10 μl 1mm mch溶液滴加到步骤6)得到的电极上室温孵育30 min;8)将10 μl步骤1)制得的apt,滴加在步骤7)制备得到的电极上室温孵育1 h;
9)将15 μl所述的aupt@zif-67/pdna基底信号猝灭溶液滴加到步骤8)制备得到的电极上室温孵育3 h,即得到用于her2-ecd检测的电致化学发光适体传感器。
15.本发明还提供一种利用上述电致化学发光能量共振转移(ecl-ret)适体传感器检测her2-ecd的方法。
16.一种利用上述电致化学发光能量共振转移(ecl-ret)适体传感器检测her2-ecd的方法,其特征在于,包括如下步骤:1)向上述传感器的电极上滴加不同浓度的目标物人表皮生长因子受体2细胞外结构域(her2-ecd);2)将电极置于含有8 mm k2s2o8的0.1 m pbs(ph=7.0)溶液中进行表征,测量其电致化学发光强度值;3)根据步骤2)所得发光强度与her2-ecd浓度对数值的线性关系,绘制工作曲线;4)将待测样品用所述传感器检测,将得到的电流值通过步骤3)制得的工作曲线计算得到待测样品的her2-ecd浓度。
17.与现有技术相比,本发明的一种检测her2-ecd的电致化学发光能量共振转移(ecl-ret)适体传感器的制备方法与应用,其突出的特点是:本发明制备了金纳米粒子(au nps)修饰的聚二烯丙基二甲基氯化铵(pdda)功能化的石墨相氮化碳(g-c3n4)复合发光材料和金铂(aupt)修饰的金属有机框架材料(mof)的信号猝灭材料,通过金属粒子与氨基的键合作用装载大量her2-ecd结合适体的部分互补链2(pdna),最终制备了aupt@zif-67/pdna的基底信号猝灭溶液。本发明制备的金纳米粒子(au nps)修饰的聚二烯丙基二甲基氯化铵(pdda)功能化的石墨相氮化碳(g-c3n4)复合发光材料具有强大而稳定的阴极ecl活性。同时信号猝灭材料的紫外光谱与au nps/g-c3n4/pdda的ecl光谱具有高度重合。aupt的加入增加了zif-67的稳定性且作为her2-ecd结合适体的部分互补链2(pdna)的活性结合位点,提高pdna负载量。在本发明中,以聚二烯丙基二甲基氯化铵-石墨相氮化碳(g-c3n4/pdda)和金纳米粒子(au nps)通过搅拌的方法合成au nps/g-c3n4/pdda复合材料作为传感界面,捕获大量her2-ecd结合适体的部分互补链1(cdna)进一步实现信号放大。通过上述手段,所制备的电致化学发光能量共振转移适体传感器成功的用于her2-ecd的超灵敏检测。与传统的her2-ecd检测方法相比,本发明的优点在于灵敏度高,特异性强,检测迅速,操作方便,设备材料价格低廉,无污染,从而为her2-ecd的检测提供了新的分析方法。
18.本发明的有益效果是:1)通过金纳米粒子(au nps)修饰的聚二烯丙基二甲基氯化铵(pdda)功能化的石墨相氮化碳(g-c3n4)复合发光材料,可以极大地改善g-c3n4的负载位点少,发光效率低,电极易钝化的特点,从而提高传感器性能实现信号放大作用,同时提高检测的灵敏度。
19.2)本发明制备的电致化学发光能量共振转移(ecl-ret)适体传感器用于目标物的识别具有高度的特异性,可提高传感器的选择性,从而为微量her2-ecd的检测提供了新的研究方向和分析方法。
20.4)本发明涉及的材料均可在实验室条件下合成,具有操作简单,原材料价格低廉,毒性低、环境友好,而且每次使用量极少,降低了实验成本。
21.5)本发明整个检测分析方法步骤清晰简便,灵敏度高,信号响应迅速。
22.6)本方法制备的电化学适体传感器可为her2-ecd的检测提供新方法。
附图说明
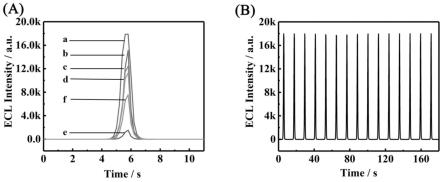
23.图1是不同修饰电极在含8 mm k2s2o8的0 .1 m pbs (ph 7.0)中电压范围从0到-1.2 v以200 mv/s的扫描速率(a)及au nps/g-c3n4/pdda的连续扫描得到的时间-电化学发光强度图(b)。
24.图2是不同修饰电极在含8 mm k2s2o8的0 .1 m pbs (ph 7.0)中电压范围从0到-1.2 v以200 mv/s的扫描速率扫描得到的时间-电化学发光强度图(a)及aupt@zif-67/pdna的紫外光谱(b)和au nps/g-c3n4/pdda的ecl光谱图(a)。
25.图3是不同修饰电极在5 mm k3[fe(cn)6]/k4[fe(cn)6]溶液中电压范围从-0.2到0.7 v以100 mv/s的扫描速率得到的循环伏安表征图(a)和阻抗表征图(b)。
[0026]
图4是不同浓度的her2-ecd通过本发明传感器检测的结果,其中,图(a)为在8 mm k2s2o8的0.1 m pbs (ph 7.0)中传感器分别对0.0001, 0.001, 0.01,0.1,1,10 和 100 ng/ml 的her2-ecd扫描的时间-电化学发光强度图;图(b)为传感器电化学发光强度与不同浓度her2-ecd对数值的校准曲线。
[0027]
图5是传感器稳定性检测结果,为1 ng/ml her2-ecd孵育的传感器在连续扫描12圈后得到的时间-电化学发光强度图;图6是五支不同玻碳电极同时孵育10 ng/ml her2-ecd所得的传感器在相同条件下扫描后得到的重现性结果。
[0028]
图7是her2-ecd适体传感器的特异性检测图,其中,干扰物为神经烯醇化酶(nse,10ng/ml),人附睾蛋白4(he4,10ng/ml),前列腺特异性抗原(psa,10ng/ml)癌胚抗原(cea,10ng/ml),人血清白蛋白(has,10 ng/ml)和细胞角蛋白19的可溶性片段(cyfra21-1,10 ng/ml)。
具体实施方式
[0029]
下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
[0030]
本发明实施例中用到的主要化学试剂如下:人表皮生长因子受体2配体结合域(her2-ecd)elisa检测试剂盒购自江苏晶美生物科技有限公司;聚二烯丙基二甲基氯化铵(pdda,30%)购自索莱宝(中国北京);石墨相氮化碳(g-c3n4)购自南京先锋纳米有限公司(中国南京);六水硝酸钴和2-甲基咪唑购自阿拉丁生化科技股份有限公司(中国上海);氯金酸(haucl4)和氯铂酸钾(k2ptcl6)购自sigma(usa);6-巯基己醇(mch)和过硫酸钾(k2s2o8)购自j&k scientific ltd(中国北京);涉及到的适体由上海生工有限公司合成,具体序列如下:her2-ecd结合适体链(apt)的序列:5'-tccacctttccgtctaactccccactttat-3'与apt部分互补链1(cdna)的序列: 5'-nh
2-(ch2)
6-ataaagtggggagtt-3'与apt部分互补链2(pdna)的序列: 5'
‑ꢀ
agacggaaaggtgga
ꢀ‑
(ch2)
6-nh
2-3'所用设备及技术参数:仪器:使用mpi-eⅱ型电致化学发光工作站(中国西安)进行时间/电压-电化学发光强度测定。使用metrohm autolab b.v.电化学工作站(瑞士modular仪器)进行循环伏安
法(cv)和阻抗法(eis)测定。电化学发光检测采用三电极系统:修饰后的玻碳电极(直径4 mm)作为工作电极,铂丝作为对电极,银-氯化银(饱和kcl)作为参比电极。电化学检测采用三电极系统:修饰后的玻碳电极(直径4 mm)作为工作电极,铂丝作为对电极,饱和甘汞电极(sce)作为参比电极。ph计监测ph值(s210 sevencompact,梅特勒-托利多,中国上海)。使用紫外分光光度仪测量紫外可见吸收光谱(uv
‑ꢀ
2600,岛津,日本)。电化学发光三电极系统在含8 mm k2s2o8的0.1 m pbs (ph 7.0)中以200 mv/s扫描。电化学三电极系统在5 mm k3[fe(cn)6]/k4[fe(cn)6]溶液中以100 mv/s扫描。
[0031]
实施例1构建用于乳腺癌her2-ecd检测的电致化学发光能量共振转移适体传感器,包括如下步骤操作:(1)基底材料的制备;1)au nps:将1ml(1%)haucl4添加到100ml超纯水中并加热至沸腾,然后将2.5ml(1%)柠檬酸三钠快速加入到煮沸的溶液中;当溶液颜色由蓝色变成红色时,将混合物保持沸腾15分钟,冷却至室温,加入超纯水定容至100ml,得到胶体金纳米粒子(au nps);2)g-c3n4/pdda分散液:称取2mg的g-c3n4,溶于2ml超纯水中,超声分散均匀,加入600ml pdda溶液(5 wt%),磁力搅拌12h,离心、洗涤,再将沉淀物分散在2ml超纯水中,即得到分散均匀的g-c3n4/pdda分散液;3)au nps/g-c3n4/pdda分散液:取2ml 步骤2)制得的g-c3n4/pdda分散液,加入600 ul步骤1)制得的au nps,搅拌6 h,离心、洗涤,再将沉淀物分散在1ml超纯水中,即得到分散均匀的au nps/g-c3n4/pdda分散液。
[0032]
(2)信号猝灭材料的制备;1)aupt@zif-67:首先,称取六水硝酸钴(co(no3)2·
6h2o,0.582g)和2-甲基咪唑(c4h6n2,0.656g)溶解于25ml无水甲醇中,在超声的作用下,将c4h6n2溶液缓慢倒入co(no3)2·
6h2o溶液中,然后继续超声反应1h;将2 ml k2ptcl
6 (0.3 wt%)和3 ml haucl
4 (0.2 wt%)加入到混合溶液中,并将反应搅拌3小时;最后用无水甲醇洗涤3次,离心,80℃真空干燥,得到aupt@zif-67纳米复合物;2)aupt@zif-67/pdna:称取2mg步骤1)制得的aupt@zif-67粉末,溶于1ml超纯水中,超声分散均匀,加入2 μm her-ecd结合适体的部分互补链2(pdna)200 μl,冰浴搅拌12 h,离心,水洗,将沉淀物重新分散于1ml超纯水中加入200μl 1mm 6-巯基己醇(mch)溶液,搅拌1h,离心,水洗,将沉淀物重新分散于500μl超纯水中,即得到aupt@zif-67/pdna基底信号猝灭溶液。
[0033]
(3)用于her2-ecd检测的电致化学发光能量共振转移适体传感器的构建:1)用20 mm tris-hcl(ph=7.4)缓冲液室温下处理her2-ecd结合适体链(apt)、apt的部分互补链1(cdna)和2(pdna),4℃储存备用;2)将玻碳电极用食人鱼洗液(98% h2so4/30% h2o
2 = 3:1, v/v)浸泡30 min后用超纯水冲洗干净备用;3)将步骤2)得到的电极分别用0.3 μm和0.05 μm的al2o3粉末抛光呈镜面,然后分别按超纯水、无水乙醇、超纯水的顺序超声处理电极,干燥备用;
4)将步骤3)得到的电极在0.5 m h2so4中进行电化学活化,然后用超纯水冲洗,干燥;5)将10 μl所述的基底材料au nps/g-c3n4/pdda溶液滴加到步骤4)清洁的玻碳电极表面上,室温干燥;6)将10 μl步骤1)制得的cdna,滴加在步骤5)制备得到的电极4℃孵育12 h;7)将10 μl 1mm mch溶液滴加到步骤6)得到的电极上室温孵育30 min;8)将10 μl步骤1)制得的apt,滴加在步骤7)制备得到的电极上室温孵育1 h;9)将15 μl所述的aupt@zif-67/pdna基底信号猝灭溶液滴加到步骤8)制备得到的电极上室温孵育3 h,即得到用于her2-ecd检测的电致化学发光适体传感器。
[0034]
实施例2利用电致化学发光能量共振转移适体传感器检测her2-ecd利用实施例1构建的电致化学发光能量共振转移适体传感器检测her2-ecd,按照如下步骤操作:一、绘制工作曲线1)将实施例2步骤5)至步骤9)的修饰电极分别置于含8 mm k2s2o8的0 .1 m pbs(ph=7.0)中进行表征,测量其电化学发光响应信号,结果如图1a所示:(a)滴加基底材料au nps/g-c3n4/pdda;(b)滴加cdna;(c)滴加mch溶液封闭;(d)滴加apt;(e)滴加信号猝灭材料aupt@zif-67/pdna;(f)滴加her2-ecd;图1b:基底材料au nps/g-c3n4/pdda。
[0035]
2)将不同修饰电极分别置于含8 mm k2s2o8的0.1 m pbs(ph=7.0)中进行表征,测量其电化学发光响应信号,结果如图2a所示:(a)au nps/g-c3n4/pdda;(b)g-c3n4/pdda;(c)aupt@zif-67/g-c3n4/pdda。分别测量au nps/g-c3n4/pdda的ecl光谱和aupt@zif-67/pdna的紫外光谱,结果如图2b所示:(a)au nps/g-c3n4/pdda的ecl光谱;(b)aupt@zif-67/pdna的紫外光谱。
[0036]
3)将实施例2步骤5)至步骤9)的修饰电极分别置于5 mm k3[fe(cn)6]/k4[fe(cn)6]溶液中进行cv和eis表征。测量其电流响应信号,结果如图3a所示:(a)滴加基底材料au nps/g-c3n4/pdda;(b)滴加cdna;(c)滴加mch溶液封闭;(d)滴加apt;(e)滴加信号猝灭材料aupt@zif-67/pdna;(f)滴加her2-ecd。测量其阻抗响应信号,结果如图3b所示:(a)滴加基底材料au nps/g-c3n4/pdda;(b)滴加cdna;(c)滴加mch溶液封闭;(d)滴加apt;(e)滴加信号猝灭材料aupt@zif-67/pdna;(f)滴加her2-ecd。
[0037]
4)向实施例1制得的适体传感器的电极上滴加10 μl不同浓度的目标物her2-ecd,分别测定其发光强度情况。如图4a所示:从下到上的浓度依次为: 0.0001, 0.001, 0.01,0.1,1,10 和 100 ng/ml。
[0038]
5)根据所得发光强度值与her2-ecd浓度对数值的线性关系,绘制工作曲线(如图4b所示)。测定结果表明发光强度响应值与her2-ecd浓度对数值在100 fg/ml-100 ng/ml范围内呈良好的线性关系,线性相关系数为0.9989,检测限为17.3 fg/ml;结果如图4所示。
[0039]
二、传感器稳定性测试:将实施例1制得的传感器在最佳条件下连续进行12圈ecl测量后,其发光强度仅降低了5.1%(如图5所示),表明传感器具有良好的稳定性。
[0040]
三、传感器重现性测试:将实施例1采用五支不同玻碳电极孵育相同浓度her-2(10 ng/ml)制得的传感器进行ecl测量后(如图6所示),得到相对标准偏差(rsd)为3.6%,表明传
感器重现性良好。
[0041]
四、传感器特异性测试:为了研究提出的适应传感器的特异性,采用可能存在于血清中的干扰物:神经烯醇化酶(nse,10ng/ml),人附睾蛋白4(he4,10ng/ml),前列腺特异性抗原(psa,10ng/ml)癌胚抗原(cea,10ng/ml),人血清白蛋白(has,10 ng/ml)和细胞角蛋白19的可溶性片段(cyfra21-1,10 ng/ml)在相同浓度及条件下测定的不同干扰物质在含8 mm k2s2o8的0 .1 m pbs(ph=7.0)中电化学发光强度响应值。结果表明(如图7所示),提出的基于her2-ecd~hba的高特异性反应的适体传感器具有良好的特异性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1