一种纸基微流控传感器阵列平台及其制备方法和应用与流程
1.本发明涉及生物传感技术领域,具体地,涉及一种纸基微流控传感器阵列平台及其制备方法和应用。
背景技术:
2.生物硫醇,如半胱氨酸、同型半胱氨酸和谷胱甘肽,由于其内在的氧化还原和亲核性,在各种生理功能和疾病中发挥着至关重要的作用。一般来说,体内生物硫醇水平异常与许多慢性和退行性疾病有关,如癌症、阿尔茨海默病、心血管疾病和神经退行性疾病。因此,监测生物硫醇含量的变化在医学研究和疾病诊断等领域具有重要意义。
3.基于纸的微流控设备具有简单、可处置和低成本的优点,已被广泛开发并应用于即时检测。通过印刷在纸基材料上制备疏水屏障,形成亲水区域。样品可以通过纸基纤维结构提供的毛细管力自发地输送到检测区,而不需要任何外部驱动力,从而实现紧凑和快速的检测。到目前为止,纸基微流控装置已经与各种检测技术相结合,包括比色法、电化学、荧光、化学发光等。其中,受益于便携性、集成性和灵敏度等优点,基于荧光的纸基微流控装置正逐渐成为一种新的发展趋势。
4.与具有高选择性的传统传感器相比,传感器阵列是由一系列非选择性的传感单元构成的,它模仿了哺乳动物的嗅觉或味觉系统。传感器阵列对分析物产生非特异性反应,其反应通过多元分析(线性判别分析、分级聚类分析或主成分分析)处理,以获得识别目标的独特指纹。传感器阵列无需费力地合成特定的识别受体,并在多样性、抗干扰性、同时检测和区分一系列具有类似结构或性质的化合物方面具有优势。
5.目前检测生物硫醇的方式仍然是使用具有高选泽性的传感器,每种传感器检测特定种类的生物硫醇,检测多种生物硫醇时操作较复杂。目前也有可定量检测多种生物硫醇的传感器,但仅能检测出生物硫醇,而不能具体判断是何种生物硫醇,检测方法仍然有不便之处。
技术实现要素:
6.本发明的目的是克服现有技术的上述不足,提供一种纸基微流控传感器阵列平台及其制备方法和应用。
7.本发明的第一个目的是提供一种纸基芯片的制备方法。
8.本发明的第二个目的是提供一种纸基芯片。
9.本发明的第三个目的是提供所述纸基芯片在制备纸基微流控装置中的应用。
10.本发明的第四个目的是提供一种纸基微流控装置。
11.本发明的第五个目的是提供所述纸基微流控装置在制备检测生物硫醇的装置中的应用。
12.本发明的第六个目的是提供一种纸基微流控传感器阵列平台。
13.为了实现上述目的,本发明是通过以下方案予以实现的:
14.一种纸基芯片的制备方法,包括以下步骤:
15.s1:活化玻璃纤维纸上的羟基,洗涤,得到活化后的玻璃纤维纸,再在活化后的玻璃纤维纸上修饰氨基,得到预处理的玻璃纤维纸;
16.s2:将含有碳量子点、n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的溶液,与所述预处理的玻璃纤维纸在黑暗环境中反应,得到修饰碳量子点的玻璃纤维纸;
17.s3:混合生物硫醇受体、n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,与所述修饰碳量子点的玻璃纤维纸在黑暗环境中反应,得到纸基芯片,所述生物硫醇受体为迈克尔受体。
18.优选地,步骤s2所述碳量子点的制备方法为:配置含有柠檬酸和尿素的水溶液,160~200℃加热,离心,去除固体,收集上清液,透析,得到碳量子点。
19.更优选地,所述柠檬酸和尿素的质量比为0.5~1.1:1,加热时间为11~13h,8000~10500rpm离心10~12min,透析袋的截留分子量为500~1000,透析时间为30~50h。
20.最优选地,所述柠檬酸和尿素的质量比为1:1,加热温度为200℃,加热时间为12h,10000rpm离心10min,透析袋的截留分子量为500,透析时间为48h。
21.优选地,步骤s1中,用盐酸活化玻璃纤维纸上的羟基,用含有氨丙基三乙氧基硅烷的乙醇和水混合溶液在活化后的玻璃纤维纸上修饰氨基;
22.步骤s2中,所述碳量子点与n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的质量比为1:248~252:123~127,反应时间为4~7h;
23.步骤s3中,n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的质量与制备修饰碳量子点的玻璃纤维纸时相同,反应时间为2~3.5h。
24.更优选地,步骤s1中,用盐酸浸泡玻璃纤维纸,洗去盐酸,得到盐酸处理的玻璃纤维纸;用含有氨丙基三乙氧基硅烷的乙醇和水混合溶液,浸泡所述盐酸浸泡的玻璃纤维纸,得到预处理的玻璃纤维纸;
25.更优选地,步骤s1中,所述盐酸的浓度为0.18~0.22m,浸泡时间为15~30min;所述氨丙基三乙氧基硅烷与乙醇和水的体积比为0.19~0.21:1,所述乙醇和水的体积比为0.9~1.1:1,浸泡含有氨丙基三乙氧基硅烷的乙醇和水混合溶液的时间为3~4.5h;
26.更优选地,步骤s1中,所述盐酸的浓度为0.2m,浸泡时间为30min。
27.更优选地,步骤s1中,所述氨丙基三乙氧基硅烷与乙醇和水的体积比为0.2:1,所述乙醇和水的体积比为1:1,浸泡含有氨丙基三乙氧基硅烷的乙醇和水混合溶液的时间为4h。
28.更优选地,步骤s2中,所述碳量子点与n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的质量比为1:250:125,反应时间为6h。
29.更优选地,步骤s3中,n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐的质量与制备修饰碳量子点的玻璃纤维纸时相同,反应时间为3h。
30.优选地,步骤s3所述生物硫醇受体是4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)苯甲酸、4-(2,2-二氰基乙烯基)苯甲酸和/或(e)-4-(2-硝基乙烯基)苯甲酸。
31.更优选地,所述碳量子点与4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)苯甲酸的质量比为1:374~416,所述碳量子点与4-(2,2-二氰基乙烯基)苯甲酸的质量比为1:331~
368,所述碳量子点与(e)-4-(2-硝基乙烯基)苯甲酸的质量比为1:230~386。
32.更优选地,所述碳量子点与4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)苯甲酸的质量比为1:435,所述碳量子点与4-(2,2-二氰基乙烯基)苯甲酸的质量比为1:355,所述碳量子点与(e)-4-(2-硝基乙烯基)苯甲酸的质量比为1:240。
33.一种纸基芯片,由所述的制备方法制备得到。
34.所述纸基芯片在制备纸基微流控装置中的应用。
35.一种纸基微流控装置,其特征在于,由顶层纸层与底层纸层组成,所述顶层纸层与底层纸层可拆卸连接,所述顶层纸层由亲水区域和疏水区域组成,所述亲水区域由通过亲水通道连接的样品入口和检测单元组成,每个亲水区域含有2个以上的检测单元;
36.所述底层纸层固定有2种以上权利要求5所述的纸基芯片,每个纸基芯片上修饰有不同生物硫醇受体;
37.所述顶层纸层的检测单元与底层纸层的纸基芯片位置相对应。
38.优选地,所述生物硫醇受体为4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)苯甲酸、4-(2,2-二氰基乙烯基)苯甲酸或(e)-4-(2-硝基乙烯基)苯甲酸中的2种或3种;
39.所述4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)苯甲酸的浓度为1.8~2.0mm,所述4-(2,2-二氰基乙烯基)苯甲酸的浓度为1.8~2.0mm,所述(e)-4-(2-硝基乙烯基)苯甲酸的浓度为1.2~2.0mm。
40.更优选地,所述4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)苯甲酸的浓度为2.0mm,所述4-(2,2-二氰基乙烯基)苯甲酸的浓度为1.8mm,所述(e)-4-(2-硝基乙烯基)苯甲酸的浓度为1.2mm。
41.优选地,所述顶层纸层上还设有观察口。
42.更优选地,所述顶层纸层与底层纸层通过铆钉铆合形成纸基微流控装置。
43.更优选地,所述顶层纸层为圆形滤纸,所述亲水区域呈树枝状分布,所述样品入口和圆形检测单元都为圆形。
44.更优选地,每个顶层纸层有1~4个亲水区域,每个亲水区域有1个样品入口,处于顶层纸层的中间,每个亲水区域有2~3个检测单元,处于顶层纸层的边缘。当在样品入口滴入待测样品溶液后,由于亲水区域的毛细作用,待测样品溶液经过亲水通道同时进入多个检测单元。
45.最优选地,每个顶层纸层有4个亲水区域,每个亲水区域有3个检测单元。
46.更优选地,所述底层纸层为与顶层纸层一样大小的圆形滤纸,所述底层纸层贴有圆形纸基芯片,作为传感单元,与顶层纸层的检测单元的性状、大小和位置对应。
47.更优选地,每个亲水区域及其2~3个检测单元对应的2~3个纸基芯片为一个检测组。所述底层纸层的其他区域为疏水区域。待测样品溶液到达了检测单元后渗透至底层纸层的纸基芯片处。所述纸基芯片与观察口的形状大小一致。
48.最优选地,每个亲水区域及其3个检测单元对应的3个纸基芯片为一个检测组。
49.所述顶层纸层与底层纸层铆合时,底层纸层贴有纸基芯片的一面位于纸基微流控装置的内部。
50.所述纸基微流控装置在制备检测生物硫醇的装置中的应用。所述制备检测生物硫醇的装置为制备检测生物硫醇种类和/或含量的装置。
51.一种纸基微流控传感器阵列平台,所述纸基微流控传感器阵列平台包括所述纸基微流控装置、荧光检测装置和计算机。
52.使用时,在样品入口滴入待测样品溶液后,由于亲水区域的毛细作用,待测样品溶液经过亲水通道同时进入多个检测单元。待测样品溶液到达了检测单元后渗透至纸基微流控装置的底层纸层的纸基芯片处,形成待检测的纸基芯片。将纸基微流控装置的将观察口与待检测的纸基芯片重合,将纸基微流控装置的放置于荧光检测装置内,荧光检测装置发出紫外光,通过观察口照射在待检测的纸基芯片上,检测待检测的纸基芯片上待测样品的荧光强度,当完成其中一个检测组,即同一个亲水区域的3个检测单元的检测后,旋转纸基微流控装置,继续检测下一个检测组的荧光强度。
53.所述计算机与荧光检测装置电路连接,收集并处理待测样品的荧光强度数据。通过计算机将多种待测生物硫醇的荧光光谱标准数据通过origin软件,从多个维度对生物硫醇的荧光光谱标准数据进行处理,计算荧光强度变化的差异((f-f0)/f),通过线性判别和层次聚类分析得到可视化的标准图谱,结合标准生物硫醇的数据和位置,与标准生物硫醇的位置和数据接近的待测物即含有对应种类的生物硫醇,从而判定待测物所含生物硫醇的种类。
54.生物硫醇受体中亲电性的多样性和生物硫醇中亲核性的多样性使得每个生物硫醇受体与6个不同种类的生物硫醇的反应速度不同,碳量子点恢复荧光的程度不同,产生独特的荧光反应。
55.如果仅针对同一种生物硫醇受体,不同的生物硫醇可能会产生荧光强度接近的结果,难以区分生物硫醇的种类;但是针对多种生物硫醇受体,不同的生物硫醇反应后产生多个荧光强度,再从多个维度来综合来看(每一种生物硫醇受体作为一个维度),就能对生物硫醇的种类做明显的区分。尽管6种生物硫醇的结构和反应性相似,但利用3种生物硫醇受体与生物硫醇反应的差异,仍然可以对种生物硫醇进行准确区分。同时,本发明也用于检测(mpa)、半胱氨酸(cys)、二硫苏糖醇(dtt)、二巯基丁二酸(dmsa)、同型半胱氨酸(hcy)和谷胱甘肽(gsh)之外的其他种类的生物硫醇。
56.与现有技术相比,本发明具有以下有益效果:
57.本发明公开了一种纸基微流控传感器阵列平台及其制备方法和应用。本发明结合纸基微流控技术、纳米技术以及荧光传感技术,制备了一个快速检测和识别多种生物硫醇的荧光传感检测平台,本发明的纸基微流控传感器阵列平台是“信号关闭-开启”型。在纸基芯片引入生物硫醇受体后,碳量子点的荧光被淬灭,而加入生物硫醇后,荧光就会恢复,本发明利用多个生物硫醇受体与不同生物硫醇反应产生的荧光强度存在区别,根据荧光强度的变化建立了不同生物硫醇的识别模式,通过喷墨打印技术建立了低成本、高效率的多通道纸基微流控传感器阵列,通过多变量分析方法将复杂的多维数据转换成简单的可视化图谱,准确地区分单一和混合生物硫醇,有效解决操作繁琐、仪器体积大和成本高的问题,作为一种现场测试工具,有望在疾病诊断、日常生理监测、环境污染检测、食品安全评估等方面发挥重要作用。
附图说明
58.图1为不同浓度的生物硫醇受体与碳量子点反应的荧光光谱和荧光淬灭效率与生
物硫醇受体的浓度的相关性图。其中a为生物硫醇受体1(tr1)荧光光谱;b为生物硫醇受体2(tr2)荧光光谱;c为生物硫醇受体3(tr3)荧光光谱。d为生物硫醇受体1(tr1)相关性图,e为生物硫醇受体2(tr2)相关性图,f为生物硫醇受体3(tr3)相关性图。误差条代表三个平行测试的标准偏差;各荧光光谱图中曲线从上到下,依次为0.001、0.01、0.05、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6和2.0mm的生物硫醇受体。
59.图2为cqds-tr1与不同浓度生物硫醇反应后的荧光光谱。其中a为mpa,b为cys,c为dtt,d为dmsa,e为gsh,f为hcy;各图中曲线从下到上,依次为0、10、50 100、200、300、400、500、600、700、800、900和1000μm生物硫醇。
60.图3为cqds-tr2与不同浓度生物硫醇反应后的荧光光谱。其中a为mpa,b为cys,c为dtt,d为dmsa,e为gsh,f为hcy;各图中曲线从下到上,依次为0、10、50 100、200、300、400、500、600、700、800、900和1000μm生物硫醇。
61.图4为cqds-tr3与不同浓度生物硫醇反应后的荧光光谱。其中a为mpa,b为cys,c为dtt,d为dmsa,e为gsh,f为hcy;各图中曲线从下到上,依次为0、10、50 100、200、300、400、500、600、700、800、900和1000μm生物硫醇。
62.图5为纸基微流控装置(μpad)的示意图。1-μpad,13-铆钉。
63.图6为纸基微流控装置(μpad)的顶层纸层的结构示意图。11-顶层纸层,111-亲水区域,112-疏水区域,113-观察口,1111-样品入口,1113-检测单元,1112-亲水通道。
64.图7为纸基微流控装置(μpad)的底层纸层的结构示意图。121-纸基芯片。
65.图8为滴加待测样品溶液后纸基微流控装置(μpad)的状态。
66.图9为纸基微流控装置(μpad)放置于荧光检测装置内的情况。
67.图10为纸基微流控装置(μpad)和荧光检测装置的连接示意图。
68.图11为检测生物硫醇的纸基微流控传感器阵列平台的原理图。
69.图12为检测生物硫醇的纸基微流控传感器阵列平台的检测流程图。
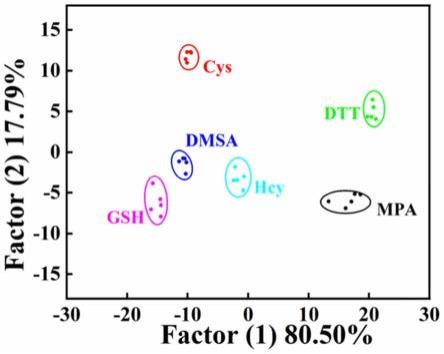
70.图13为浓度分别为10μm的6个生物硫醇的检测结果。其中a为典型评分图;b为簇热图;c为箱线图。
71.图14为含有dmsa和cys生物硫醇的待测物的典型得分图。
72.图15为含有cys、dmsa和gsh生物硫醇的待测物的典型得分图。其中t1为:60%cys-20%dmsa-20%gsh;t2为:20%cys-60%dmsa-20%gsh;t3为:20%cys-20%dmsa-60%gsh。
73.图16为6种生物硫醇在胎牛血清的鉴别标准评分。
具体实施方式
74.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
75.实施例1制备碳量子点、生物硫醇受体和纸芯片
76.一、实验方法
77.1、制备碳量子点(cqds)
78.采用水热法将1g柠檬酸(ca)和1g尿素溶解在10ml水中,得到混合液,然后将混合
液转移到25ml特氟龙内衬的高压釜中,180℃条件下加热12h,10000rpm离心10min,去除混合液的固体。收集离心上清液,加入透析袋(mwco为500)中透析48h,透析液为去离子水,将透析袋内样品冷冻干燥,得到固相即为碳量子点。
79.2、制备生物硫醇受体
80.(1)制备生物硫醇受体1:
81.将4-氨基苯甲酸(0.9g)和琥珀酸酐(718.61mg)在10ml二恶烷中的溶液在100℃下搅拌10min,得反应混合物1。向反应混合物1中加入过2.98g硫酸铵和0.93ml dmso,在100℃条件下继续加热5h,得反应混合物2。用棉塞将反应混合物2过滤,在真空中除去反应混合物2中的二氧六环,得粗品。将粗品溶于乙酸乙酯,依次用0.1mol/l稀盐酸、饱和nahco3水溶液和饱和nacl水溶液洗涤。洗涤后在无水na2so4上干燥脱水,真空条件蒸发溶剂,再重结晶得到1.1g的4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)苯甲酸,即生物硫醇受体1。
82.(2)制备生物硫醇受体2:在0℃下向4-氨基苯甲酸的ch3cn溶液中依次加入5mmol的phi(oac)2和6mmol丙二腈,所述4-氨基苯甲酸为5.0mmol,所述ch3cn体积为20ml,得到混合物a。在20~25℃和n2气氛下搅拌混合物a 45min,得反应混合物。用tlc监测搅拌反应的进展。搅拌反应完成后,在真空下蒸发反应混合物的溶剂,用5ml饱和nahco3溶液淬灭反应混合物,用10ml的etoac作提取液提取生物硫醇受体2,合并有机层,用饱和nacl水溶液洗涤,用na2so4干燥并减压浓缩,重结晶得到0.8g的4-(2,2-二氰基乙烯基)苯甲酸,即生物硫醇受体2。
83.(3)制备生物硫醇受体3:在一个25ml的schlenk管中加入4mmol的(e)-4-(2-羧基乙烯基)苯甲酸、4.8mmol的cu(no3)2和20ml的ch3cn,得混合物b,密封,然后将混合物b在空气中于110℃条件下搅拌8h。用tlc监测的反应的进展,搅拌反应完成后,加入30ml水,得混合物c。用二氯甲烷(3x20ml)提取混合物c中的生物硫醇受体3,合并的有机层依次用30ml饱和nahco3溶液和20ml水洗涤,在无水na2so4上干燥,用旋转蒸发器浓缩。浓缩后的浓缩物通过重结晶提纯,得到0.5g的(e)-4-(2-硝基乙烯基)苯甲酸,即生物硫醇受体3。
84.3、制备纸芯片
85.(1)用0.2m盐酸溶液浸泡φ7mm的玻璃纤维纸30min,用去离子水清洗以去除多余的盐酸。
86.(2)用含有200μl氨丙基三乙氧基硅烷的20ml乙醇/水(1:1,v/v)中浸泡步骤(1)浸泡过盐酸的玻璃纤维纸4h,之后将其固定在培养皿上以防止漂浮。
87.(3)在步骤(2)的培养皿中加入1ml碳量子点(1mg/ml)、5ml,50mg/ml的n-羟基琥珀酰亚胺和5ml,25mg/ml的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,于黑暗中与纸张反应6h,通过碳量子点的羧基与纸表面的氨基发生酰胺反应将碳量子点修饰在纸表面。
88.(4)用去离子水清洗3次步骤(3)反应完成后的纸张,再在培养皿中加入1ml本实施例制备的生物硫醇受体(生物硫醇受体1、生物硫醇受体2或生物硫醇受体3)、5ml浓度为50mg/ml的n-羟基琥珀酰亚胺和5ml浓度为25mg/ml的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,并在黑暗中与纸张反应3h,碳量子点的氨基与生物硫醇受体表面的羧基发生酰胺反应,将生物硫醇受体修饰在碳量子点表面。得到的反应完成后的纸片即为装载碳量子点与生物硫醇受体(cqds-trs)的纸基芯片,作为传感单元,所述纸基芯片储存在4℃条件下。
89.实施例2生物硫醇受体浓度对检测的影响
90.一、实验方法
91.生物硫醇受体与碳量子点结合生成荧光探针,用荧光滴定法检测不同生物硫醇受体浓度对荧光探针的荧光强度的影响。
92.实验步骤:首先在0.1ml(1g/ml)实施例1制备的碳量子点溶液中分别加入0.1ml,不同浓度的实施例1制备的生物硫醇受体1、2和3,各生物硫醇受体实验浓度分别为0.001、0.01、0.05、0.1、0.2、0.4、0.8、1.0、1.2、1.4、1.6、1.8和2.0mm,之后加入0.4ml n-羟基琥珀酰亚胺(50mg/ml)和0.4ml 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(25mg/ml),反应3h,碳量子点上的氨基与生物硫醇受体上的氨基发生酰胺反应,将生物硫醇受体时修饰上去,然后进行荧光检测。
93.二、实验结果
94.如图1a、图1b和图1c所示,随着生物硫醇受体浓度的增加,碳量子点的荧光强度逐渐下降,表明实施例1制备的3种生物硫醇受体有效地淬灭碳量子点的荧光。如图1d、图1e和图1f所示,与相同浓度的3种生物硫醇受体相比,生物硫醇受体3的淬灭作用最有效。生物硫醇受体1、生物硫醇受体2和生物硫醇受体3的最佳浓度分别为2.0mm、1.8mm和1.2mm,在这些浓度下其淬灭反应达到约90%。
95.实施例3生物硫醇受体(tr)与生物硫醇之间的相互作用
96.一、实验方法
97.待测生物硫醇:3-巯基丙酸(mpa)、半胱氨酸(cys)、二硫苏糖醇(dtt)、二巯基丁二酸(dmsa)、同型半胱氨酸(hcy)和谷胱甘肽(gsh)。
98.结合碳量子点的生物硫醇受体(cqds-trs):实施例1制备的碳量子点分别与实施例1制备的生物硫醇受体(tr)1~3结合生成的探针,即cqds-tr1、cqds-tr2和cqds-tr3。
99.并用荧光滴定法检测上述6种生物硫醇分别与实施例1制备的3种生物硫醇受体反应后生成的荧光探针的荧光强度变化。
100.具体实验步骤为:首先在0.1ml(1g/ml)实施例1制备的碳量子点溶液中分别加入0.1ml,2.0mm的生物硫醇受体1,0.1ml,1.8mm的生物硫醇受体2,0.1ml,1.2mm的生物硫醇受体3,之后加入0.4ml n-羟基琥珀酰亚胺(50mg/ml)和0.4ml 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(25mg/ml),反应3h,碳量子点上的氨基与受体上的氨基发生酰胺反应,将受体时修饰上去。然后加入不同浓度(0、10、50 100、200、300、400、500、600、700、800、900和1000μm)生物硫醇进行检测。
101.二、实验结果
102.如图2所示,分别为cqds-tr1与不同浓度生物硫醇mpa(图2a)、cys(图2b)、dtt(图2c)、dmsa(图2d)、hcy(图2e)和gsh(图2f)反应后的荧光光谱。随着生物硫醇浓度的增加,cqds-tr1的荧光强度逐渐增加。不同的生物硫醇对cqds-tr1的荧光强度具有不同的抑制程度。
103.如图3所示,分别为cqds-tr2与不同浓度生物硫醇mpa(图3a)、cys(图3b)、dtt(图3c)、dmsa(图3d)、hcy(图3e)和gsh(图3f)反应后的荧光光谱。随着生物硫醇浓度的增加,cqds-tr2的荧光强度逐渐增加。不同的生物硫醇对cqds-tr2的荧光强度具有不同的抑制程度。
104.如图4所示,分别为cqds-tr3与不同浓度生物硫醇mpa(图4a)、cys(图4b)、dtt(图4c)、dmsa(图4d)、hcy(图4e)和gsh(图4f)反应后的荧光光谱。随着生物硫醇浓度的增加,cqds-tr3的荧光强度逐渐增加。不同的生物硫醇对cqds-tr3的荧光强度具有不同的抑制程度。
105.本发明实施例1制备的生物硫醇受体1~3都是自合成的迈克尔受体,可以触发光诱导电子转移效应,淬灭碳量子点的荧光。
106.生物硫醇具有高亲核性,与生物硫醇受体反应时,会破坏光诱导电子转移效应,导致荧光部分恢复。6种生物硫醇中的-sh基团通过迈克尔加成反应与生物硫醇受体中的亲电基团发生反应,从而破坏碳量子点和生物硫醇受体之间的光诱导电子转移效应。
107.生物硫醇受体中亲电性的多样性和生物硫醇中亲核性的多样性使得每个生物硫醇受体与6个不同种类的生物硫醇的反应速度不同,碳量子点恢复荧光的程度不同,产生独特的荧光反应。
108.如果仅针对同一种生物硫醇受体,不同的生物硫醇可能会产生荧光强度接近的结果,难以区分生物硫醇的种类;但是针对多种生物硫醇受体,不同的生物硫醇反应后产生多个荧光强度,再从多个维度来综合来看(每一种生物硫醇受体作为一个维度),就能对生物硫醇的种类做明显的区分。尽管6种生物硫醇的结构和反应性相似,但利用3种生物硫醇受体与生物硫醇反应的差异,仍然可以对种生物硫醇进行准确区分。以每种生物硫醇产生独特的荧光响应模式作为“指纹图谱”,在5~100μm范围内可通过线性判别分析和层次聚类分析进行区分。
109.实施例4制备检测生物硫醇的纸基微流控传感器阵列平台
110.一、制备纸基微流控装置(μpad)
111.所述纸基微流控装置由滤纸组成,使用solid-works 2014 3d cad软件设计,并通过低成本、易操作的喷墨打印技术在滤纸上打印出疏水边框(支持信息)。纸基微流控装置由两层滤纸组成。
112.如图5所示,为纸基微流控装置1的示意图,顶层纸层11与底层纸层12通过铆钉13铆合形成纸基微流控装置1。
113.如图6所示,为纸基微流控装置1的顶层纸层11的结构示意图,所述顶层纸层11为圆形滤纸,由呈树枝状分布的亲水区域111、疏水区域112和观察口113组成,所述亲水区域111有4个,每个亲水区域111中的圆形样品入口1111和圆形检测单元1113通过亲水通道1112连接。
114.每个亲水区域111有1个样品入口1111,处于顶层纸层11的中间,每个亲水区域111有3个检测单元1113,处于顶层纸层11的边缘。当在样品入口1111滴入待测样品溶液后,由于亲水区域111的毛细作用,待测样品溶液经过亲水通道1112同时进入多个检测单元1113。
115.如图7所示,为纸基微流控装置1的底层纸层12的结构示意图,所述底层纸层12为与顶层纸层11一样大小的圆形滤纸,所述底层纸层12贴有12个圆形纸基芯片121,作为传感单元,与顶层纸层11的检测单元1113的性状、大小和位置对应。每个亲水区域111及其3个检测单元1113对应的3个纸基芯片121为一个检测组。所述底层纸层12的其他区域为疏水区域。待测样品溶液到达了检测单元1113后渗透至纸基微流控装置1的底层纸层12的纸基芯片121处。所述纸基芯片121与观察口113的形状大小一致。
116.顶层纸层11与底层纸层12铆合时,底层纸层12贴有纸基芯片121的一面位于纸基微流控装置1的内部。
117.每个检测组的3个纸基芯片121分别为实施例1制备的装载碳量子点和生物硫醇受体1的纸基芯片(cqds-tr1/paper传感单元)、装载碳量子点和生物硫醇受体2的纸基芯片(cqds-tr2/paper传感单元)和装载碳量子点和生物硫醇受体3的纸基芯片(cqds-tr3/paper传感单元)。制备时,所述生物硫醇受体1、生物硫醇受体2和生物硫醇受体3的浓度分别为2.0mm、1.8mm和1.2mm。
118.如图8所示,为滴加待测样品溶液后纸基微流控装置1的状态。
119.二、制备检测生物硫醇的纸基微流控传感器阵列平台
120.如图9和图10所示,所述纸基微流控装置1放置于荧光检测装置2的实验台内,以实现在黑暗环境下检测样品,所述荧光检测装置上2设有发射紫外光的通孔,以发出紫外光,照射在纸基芯片121上,荧光检测装置2的实验台通过3d打印制备得到。
121.如图11所示,本发明的检测生物硫醇的纸基微流控传感器阵列平台,由3部分组成,分别为:纸基微流控装置1、荧光检测装置2和用于信号处理的计算机3。计算机3与荧光检测装置2电路连接,收集并处理待测样品的荧光强度数据。通过计算机3将多种待测生物硫醇的荧光光谱标准数据从多个维度对生物硫醇的荧光光谱标准数据进行处理,通过线性判别和聚类分析得到可视化的标准图谱。
122.如图12所示,使用时,在样品入口1111滴入待测样品溶液后,将纸基微流控装置1的将观察口113与待检测的纸基芯片121重合,将纸基微流控装置1的放置于荧光检测装置2内,荧光检测装置2发出紫外光,通过观察口113照射在待检测的纸基芯片121上,计算机3检测分析待检测的纸基芯片121上待测样品的荧光强度,当完成其中一个检测组,即同一个亲水区域111的3个检测单元1113的检测后,旋转纸基微流控装置1,继续检测分析下一个检测组的荧光强度。
123.实施例5用纸基微流控传感器阵列平台鉴定生物硫醇
124.一、实验方法
125.1、使用实施例4制备的纸基微流控传感器阵列平台,对实施例3中6种生物硫醇(mpa、cys、dtt、dmsa、gsh和hcy)进行鉴定。
126.用15μl浓度分别为10μm的6种生物硫醇分别与实施例4中的3个传感单元反应,实验重复5次,用荧光检测装置检测记录420nm处的荧光信号,记录未添加生物硫醇的初始荧光强度f0,和生物硫醇反应后的荧光强度f,用荧光强度变化的差异((f-f0)/f)用来识别生物硫醇。建立了一个由3个纸片
×
6个生物硫醇
×
5个重复组成的荧光反应矩阵。用origin软件的多变量分析方法(线性判别分析lda和层次聚类分析hca)将复杂的多维数据转换成简单的可视化模式,得到典型评分图、簇热图和箱线图。
127.2、使用实施例4制备的纸基微流控传感器阵列平台,检测含有2种和3种生物硫醇的待测物。
128.待测物t含有10μm生物硫醇,由dmsa和cys这2种生物硫醇组成,其中待测物t1含有75%(7.5μm)dmsa和25%(2.5μm)cys,待测物t2含有50%(5.0μm)dmsa和50%(5.0μm)cys,待测物t3含有25%(2.5μm)dmsa和75%(7.5μm)cys。
129.待测物t含有10μm生物硫醇,由cys、dmsa和gsh这3种生物硫醇组成,其中待测物t1
含有60%(6.0μm)cys,20%(2.0μm)dmsa和20%(2.0μm)gsh,待测物t2含有20%(2.0μm)cys,60%(6.0μm)dmsa和20%(2.0μm)gsh,待测物t3含有20%(2.0μm)cys,20%(2.0μm)dmsa和60%(6.0μm)gsh。
130.取15μl待测物分别与实施例4中的3个传感单元反应,其他检测步骤与本实施例实验1相同。
131.3、使用实施例4制备的纸基微流控传感器阵列平台,对含有10μm的24种单一生物硫醇和24种生物硫醇混合物盲样进行检测。
132.二、实验结果
133.1、如图13a所示,30个(6个生物硫醇
×
5个重复)典型的荧光反应模式被分为6个不同的组,没有重叠,表明实施例4制备的纸基微流控传感器阵列平台对6种生物硫醇具有良好的分辨率。
134.如图13b所示,根据纸基微流控传感器阵列平台对6种生物硫醇的荧光强度反应,得到了一个聚类热图。聚类结果显示,所有的生物硫醇都被正确地分配到它们各自的组中。从热图中清楚地看到每个传感单元与生物硫醇的反应。对于cqds-tr1/paper传感单元,gsh、hcy和mpa的荧光强度变化不大,对于cqds-tr2/paper传感单元,gsh、dmsa和hcy的荧光强度变化很大,而对于cqds-tr3/paper传感单元,dtt和mpa的荧光强度变化很大。
135.如图13c所示,箱形图还描述了3个传感单元对每种生物硫醇的反应的差异,如下所示。荧光强度变化的差异((f-f0)/f)为:dtt》gsh》hcy》mpa》cys》dmsa。
136.2、如图14所示,为含有不同浓度的dmsa和cys生物硫醇的待测物的典型得分图,这3种待测物被完全分离,本发明实施例4的纸基微流控传感器阵列平台具有良好的分辨率。
137.如图15所示,为含有不同浓度的cys、dmsa和gsh生物硫醇的待测物的典型得分图,这3种待测物被完全分离,本发明实施例4的纸基微流控传感器阵列平台具有良好的分辨率。
138.3、如表1所示,cqds-tr1、cqds-tr2和cqds-tr3分别为碳量子点与生物硫醇受体1、2和3反应得到的荧光探针,表1中记录了各荧光探针与盲样中的生物硫醇反应后的荧光响应数值,本发明实施例4的纸基微流控传感器阵列平台对盲样中的生物硫醇受体检测结果准确,特异性强。
139.表1 24种单一生物硫醇和24种生物硫醇混合物盲样的鉴定
140.141.142.143.[0144][0145]
实施例6真实样品检测
[0146]
一、实验方法
[0147]
将实施例2中6种生物硫醇(mpa、cys、dtt、dmsa、gsh和hcy)分别加入到胎牛血清(fbs)中,用实施例4制备的纸基微流控传感器阵列平台检测生物硫醇。在检测前用去离子水稀释fbs 50倍,以减少基质效应,每种生物硫醇的添加浓度为10μm。
[0148]
二、实验结果
[0149]
如图16所示,为6种生物硫醇在胎牛血清的鉴别标准评分,这6种生物硫醇在胎牛血清中被完全分离。
[0150]
在后续分析检测其他含有生物硫醇的真实样品时,将用实施例4的纸基微流控传感器阵列平台检测标准生物硫醇的数据与待测物的数据比较,与标准生物硫醇的位置和数据接近的待测物即含有对应种类的生物硫醇。
[0151]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保
护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1