一种检测抗重组人GLP-1-Fc融合蛋白中和抗体的方法与流程
一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法
技术领域
1.本发明涉及生物医药技术领域,具体涉及一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法。
背景技术:
2.重组人glp-1-fc融合蛋白是为两条重组人胰高血糖素样肽-1类似物的c末端分别通过短肽连接igg4 fc(ch2)和fc(ch3)构成的融合蛋白,半衰期延长至近4天,其90%的氨基酸序列与内源性人glp-1具有同源性,它通过激活glp-1受体,促进胰岛素分泌,降低患者的空腹血糖;抑制餐后胰高血糖素的分泌,降低患者餐后血糖;延长胃排除时间,降低食欲,改善胰岛β细胞功能而产生降血糖疗效。
3.重组人glp-1-fc融合蛋白作为生物治疗剂属于外来抗原,可能潜在地诱导免疫反应,从而导致抗药抗体(ada)的形成,这可能引起不希望的效应,如药物暴露的丧失、功效的丧失和严重的不良的事件等。中和抗体(nab)属于ada的一个子集,其可以与治疗剂的药理活性区域结合,从而抑制或完全中和其临床功效。然而,目前的nab的测定方法可耐受的药物浓度低,容易受到药物干扰,同时血清样本中的血清因子也会产生干扰,导致nab的测定灵敏度低。
技术实现要素:
4.因此,本发明要解决的技术问题在于提供一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法,所述的方法灵敏度高,可耐受的药物浓度水平高。
5.为此,本发明提供了如下的技术方案:
6.一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法,包括:
7.(1)将待测样品进行酸化并进行第一次孵育,然后加入生物素标记的重组人glp-1-fc融合蛋白溶液和中和液,进行第二次孵育;
8.(2)将步骤(1)中得到的反应液加至包被链霉素亲和素的包被板中,第三次孵育,洗板;
9.(3)将步骤(2)中洗板后的包被链霉素亲和素的包被板进行酸化并第四次孵育;
10.(4)将步骤(3)中孵育后得到的反应液从包被链霉素亲和素的包被板中转移,并对转移后的反应液进行中和,然后与glp-1融合蛋白溶液混合并进行第五次孵育;
11.(5)将步骤(4)中孵育后的反应液与含报告基因的glp-1r稳转细胞悬液混合并进行第六次孵育,然后进行化学发光检测。
12.可选的,在步骤(1)中,在酸化并进行第一次孵育的步骤中,将待测样品和酸性溶液混合,然后于室温500rpm孵育25-35分钟;和/或
13.在步骤(1)中,在酸化并进行第一次孵育的步骤中,采用300mm的乙酸溶液进行酸化;和/或
14.在步骤(1)中,生物素标记的重组人glp-1-fc融合蛋白溶液的浓度为6μg/ml;和/
或
15.在步骤(1)中,中和液为浓度为1m,ph为9.5的tris-hcl溶液;和/或
16.待测样品、酸性溶液、生物素标记的重组人glp-1-fc融合蛋白溶液和中和液的体积比为30:45:30:5;和/或
17.在步骤(1)中,所述第二次孵育的条件为室温500rpm孵育2.5-3小时。
18.可选的,在步骤(2)中,所述第三次孵育的条件为2-8℃下静置孵育16-24小时;和/或
19.在步骤(2)中,在所述洗板步骤中,按照300μl/孔用洗液洗板4次;和/或
20.在步骤(2)中,洗板所用的洗液为含0.05v/v%tween 20的1
×
pbs。
21.可选的,在步骤(2)中,在将步骤(1)中得到的反应液加至包被链霉素亲和素的包被板中之前,还包括对包被链霉素亲和素的包被板进行封闭的步骤,采用分析缓冲液加入包被链霉素亲和素的包被板中孵育,然后弃掉分析缓冲液;
22.可选的,分析缓冲液为含1wt%bsa,0.05v/v%tween 20的1
×
pbs;
23.可选的,采用分析缓冲液按照200μl/孔加入包被链霉素亲和素的包被板中,于室温下500rpm孵育10-20min。
24.可选的,在步骤(3)中,向步骤(2)中洗板后的包被链霉素亲和素的包被板中按照50μl/孔加入乙酸溶液;和/或
25.在步骤(3)中,乙酸溶液浓度为300mm;和/或
26.在步骤(3)中,所述第四次孵育的条件为室温下500rpm孵育10-15分钟。
27.可选的,在步骤(4)中,将转移后的反应液和tris-hcl溶液按照体积比40:13混合进行中和;
28.可选的,tris-hcl溶液浓度为1m,ph为9.5;
29.可选的,glp-1融合蛋白溶液的浓度为10ng/ml;
30.可选的,glp-1融合蛋白溶液的体积和转移后的反应液的体积比为1:1;
31.可选的,所述第五次孵育的条件为室温下700rpm下孵育30分钟。
32.可选的,在步骤(5)中,步骤(4)中孵育后的反应液与含报告基因的glp-1r稳转细胞悬液按照体积比35:80混合;和/或
33.含报告基因的glp-1r稳转细胞悬液的浓度为2
×
106个细胞/ml;和/或
34.所述第六次孵育的条件为37℃、5%co2的下培养孵育5小时。
35.可选的,在步骤(5)中,所述化学发光检测步骤中,向第六次孵育后得到的反应液中加入报告基因检测试剂,于室温1000rpm混合5min,然后检测化学发光信号,根据获得的化学发光信号对抗重组人glp-1-fc融合蛋白中和抗体进行定性检测。
36.可选的,所述定性检测:通过测试一批个体血清确定中和阈值因子ncpf,待测样品的s/n值大于或等于中和阈值因子则被判定为抗重组人glp-1-fc融合蛋白中和抗体阳性;待测样品的s/n值小于ncpf则被判定为抗重组人glp-1-fc融合蛋白中和抗体阴性;s/n=样品信号值/阴性质控样品nc信号值。所述阴性质控样品为不含阳性对照抗体(抗重组人glp-1-fc融合蛋白中和抗体)的对照组。
37.本发明技术方案,具有如下优点:
38.1.本发明提供的一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法,包括:(1)
将待测样品进行酸化并进行第一次孵育,然后加入生物素标记的重组人glp-1-fc融合蛋白溶液和中和液,进行第二次孵育;(2)将步骤(1)中得到的反应液加至包被链霉素亲和素的包被板中,第三次孵育,洗板;(3)将步骤(2)中洗板后的包被链霉素亲和素的包被板进行酸化并第四次孵育;(4)将步骤(3)中孵育后得到的反应液从包被链霉素亲和素的包被板中转移,并对转移后的反应液进行中和,然后与glp-1融合蛋白溶液混合并进行第五次孵育;(5)将步骤(4)中孵育后的反应液与含报告基因的glp-1r稳转细胞悬液混合并进行第六次孵育,然后进行化学发光检测;上述方法中,通过对待测样品如血清样本进行加酸处理,待测样品中的抗重组人glp-1-fc融合蛋白中和抗体与待测样品中的可能含有的药物重组人glp-1-fc融合蛋白解离开,随后加入生物素标记的重组人glp-1-fc融合蛋白溶液,使得抗重组人glp-1-fc融合蛋白中和抗体和生物素标记的重组人glp-1-fc融合蛋白结合,然后将所得的反应液转移到包被链霉素亲和素的包被板中,通过生物素和链霉素亲和素的结合,将抗重组人glp-1-fc融合蛋白中和抗体捕获到包被板上,然后洗板洗去未结合的物质如游离的glp-1融合蛋白和血清因子进而可以减轻药物和血清因子的干扰,然后再将抗重组人glp-1-fc融合蛋白中和抗体从包被板上酸化下来并中和,并和glp-1融合蛋白混合,然后加入到含报告基因的glp-1r稳转细胞悬液中孵育,glp-1融合蛋白与含报告基因的glp-1r稳转细胞膜上的glp-1受体结合,通过信号传导系统,激活报告基因(荧光素酶)产生荧光信号,若待测样品中含有抗重组人glp-1-fc融合蛋白中和抗体会中和glp-1融合蛋白药物的活性,使得荧光信号下降,因此,可以检测待测样品中的抗重组人glp-1-fc融合蛋白中和抗体,且上述方法灵敏度高,可耐受的药物浓度水平高。
具体实施方式
39.提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
40.实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
41.下述实施例中:
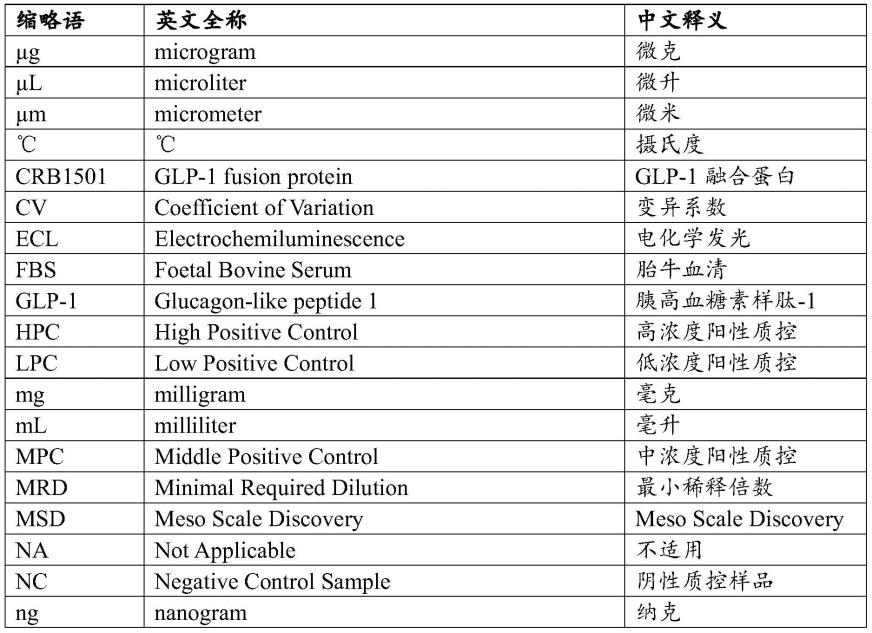
42.1、缩写列表
43.表1缩写列表
[0044][0045][0046]
2、数据处理
[0047]
数据采集系统,magellan tracker v7.2。
[0048]
数据处理系统,microsoft excel 2016。
[0049]
3、试剂
[0050]
表2试剂
[0051][0052][0053]
4、仪器设备及耗材
[0054]
表3、仪器设备及耗材
[0055][0056]
5、试剂配制
[0057]
洗液:含0.05v/v%tween 20的1
×
pbs。
[0058]
分析缓冲液:含1wt%bsa,0.05v/v%tween 20的1
×
pbs。
[0059]
300mm乙酸溶液:取冰醋酸到纯水中,充分混匀,制得终浓度为300mm乙酸溶液,室温储存,有效期6个月。
[0060]
生物素标记的重组人glp-1-fc融合蛋白(bio-crb1501)工作液:取24μl bio-crb1501到2788μl分析缓冲液中,充分混匀,使bio-crb1501终浓度都达到6μg/ml,室温避光储存,配制当天使用。
[0061]
glp-1融合蛋白(crb1501)溶液:取crb1501储备液用细胞培养基配制成10ng/ml的工作液,室温避光储存,配制当天使用。
[0062]
下述实施例中室温温度为20-25℃。
[0063]
实施例1
[0064]
本实施例提供了一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法,包括如下步骤:
[0065]
(1)在稀释板a中,加待测样品(血清样本)30μl/孔,再加入45μl/孔的300mm乙酸溶液(单孔操作),室温500rpm孵育30分钟,然后向孵育结束后的稀释板a中按照30μl/孔加入bio-crb1501工作液,再按照5μl/孔加入tris-hcl溶液(浓度为1m,ph 9.5)混匀,室温500rpm孵育2.8h。
[0066]
(2)取包被链霉素亲和素的包被板,按照200μl/孔加入分析缓冲液,室温500rpm孵育15min,然后弃掉分析缓冲液,拍干,然后从步骤(1)中孵育结束的稀释板a中取反应液按照100μl/孔加入拍干的包被链霉素亲和素的包被板中,在2-8℃下静置孵育20小时,然后按照300μl/孔加入洗液洗板4次,以洗去未结合的物质,在吸水纸上拍干。
[0067]
(3)将300mm乙酸溶液按照50μl/孔加入步骤(2)中得到的包被链霉素亲和素的包被板中,室温下500rpm孵育13min。
[0068]
(4)从步骤(3)中孵育结束的包被链霉素亲和素的包被板中取反应液按照40μl/孔加入稀释板b中,然后按13μl/孔加入tris-hcl溶液(1m,ph 9.5),500rpm混匀2min左右,然
后按照40μl/孔加入glp-1融合蛋白溶液,室温下700rpm下孵育30分钟。
[0069]
(5)取出含报告基因的glp-1r稳转细胞株经消化液消化后并吹散后细胞计数,离心,将冻存细胞离心重悬稀释到2
×
106个细胞/ml的细胞悬液,将所得细胞悬液按照80μl/孔加入96孔白板中,从步骤(4)中孵育结束的稀释板b中取反应液按照35μl/孔加入96孔白板中,于37℃、5%co2的下培养孵育5小时,然后按照50μl/孔加入bright-glo
tm luciferase assay试剂,室温1000rpm混匀5分钟,放入化学发光检测仪检测,根据获得的化学发光信号对抗重组人glp-1-fc融合蛋白中和抗体进行定性检测。
[0070]
所述定性检测:通过测试一批个体血清确定中和阈值因子,待测样品的s/n值大于或等于中和阈值因子则被判定为抗重组人glp-1-fc融合蛋白中和抗体阳性;待测样品的s/n值小于中和阈值因子则被判定为抗重组人glp-1-fc融合蛋白中和抗体阴性;s/n=样品信号值/阴性质控样品nc信号值。所述阴性质控样品为不含阳性对照抗体(抗重组人glp-1-fc融合蛋白中和抗体)的对照组。
[0071]
实施例2
[0072]
本实施例提供了一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法,包括如下步骤:
[0073]
(1)在稀释板a中,加待测样品(血清样本)30μl/孔,再加入45μl/孔的300mm乙酸溶液(单孔操作),室温500rpm孵育25分钟,然后向孵育结束后的稀释板a中按照30μl/孔加入bio-crb1501工作液,再按照5μl/孔加入tris-hcl溶液(1m,ph 9.5)混匀,室温500rpm孵育2.5h。
[0074]
(2)取包被链霉素亲和素的包被板,按照200μl/孔加入分析缓冲液,室温500rpm孵育10-20min,然后弃掉分析缓冲液,拍干,然后从步骤(1)中孵育结束的稀释板a中取反应液按照100μl/孔加入拍干的包被链霉素亲和素的包被板中,在2-8℃下静置孵育16小时,然后按照300μl/孔加入洗液洗板4次,以洗去未结合的物质,在吸水纸上拍干。
[0075]
(3)将300mm乙酸溶液按照50μl/孔加入步骤(2)中得到的包被链霉素亲和素的包被板中,室温下500rpm孵育10min。
[0076]
(4)从步骤(3)中孵育结束的包被链霉素亲和素的包被板中取反应液按照40μl/孔加入稀释板b中,然后按13μl/孔加入tris-hcl溶液(1m,ph 9.5),500rpm混匀2min左右,然后按照40μl/孔加入glp-1融合蛋白溶液,室温下700rpm下孵育30分钟。
[0077]
(5)取出含报告基因的glp-1r稳转细胞株消化后吹散后细胞计数,离心,将冻存细胞离心重悬稀释到2
×
106个细胞/ml的细胞悬液,将所得细胞悬液按照80μl/孔加入96孔白板中,从步骤(4)中孵育结束的稀释板b中取反应液按照35μl/孔加入96孔白板中,于37℃、5%co2的下培养孵育5小时,然后按照50μl/孔加入bright-glo
tm luciferase assay试剂,室温1000rpm混匀5分钟,放入化学发光检测仪检测,根据获得的化学发光信号对抗重组人glp-1-fc融合蛋白中和抗体进行定性检测。
[0078]
所述定性检测:通过测试一批个体血清确定中和阈值因子,待测样品的s/n值大于或等于中和阈值因子则被判定为抗重组人glp-1-fc融合蛋白中和抗体阳性;待测样品的s/n值小于中和阈值因子则被判定为抗重组人glp-1-fc融合蛋白中和抗体阴性;s/n=样品信号值/阴性质控样品nc信号值。所述阴性质控样品为不含阳性对照抗体(抗重组人glp-1-fc融合蛋白中和抗体)的对照组。
[0079]
实施例3
[0080]
本实施例提供了一种检测抗重组人glp-1-fc融合蛋白中和抗体的方法,包括如下步骤:
[0081]
(1)在稀释板a中,加待测样品(血清样本)30μl/孔,再加入45μl/孔的300mm乙酸溶液(单孔操作),室温500rpm孵育35分钟,然后向孵育结束后的稀释板a中按照30μl/孔加入bio-crb1501工作液,再按照5μl/孔加入tris-hcl溶液(1m,ph 9.5)混匀,室温500rpm孵育3h。
[0082]
(2)取包被链霉素亲和素的包被板,按照200μl/孔加入分析缓冲液,室温500rpm孵育10-20min,然后弃掉分析缓冲液,拍干,然后从步骤(1)中孵育结束的稀释板a中取反应液按照100μl/孔加入拍干的包被链霉素亲和素的包被板中,在2-8℃下静置孵育24小时,然后按照300μl/孔加入洗液洗板4次,以洗去未结合的物质,在吸水纸上拍干。
[0083]
(3)将300mm乙酸溶液按照50μl/孔加入步骤(2)中得到的包被链霉素亲和素的包被板中,室温下500rpm孵育15min。
[0084]
(4)从步骤(3)中孵育结束的包被链霉素亲和素的包被板中取反应液按照40μl/孔加入稀释板b中,然后按13μl/孔加入tris-hcl溶液(1m,ph 9.5),500rpm混匀2min左右,然后按照40μl/孔加入glp-1融合蛋白溶液,室温下700rpm下孵育30分钟。
[0085]
(5)取出含报告基因的glp-1r稳转细胞株消化后吹散后细胞计数,离心,将冻存细胞离心重悬稀释到2
×
106个细胞/ml的细胞悬液,将所得细胞悬液按照80μl/孔加入96孔白板中,从步骤(4)中孵育结束的稀释板b中取反应液按照35μl/孔加入96孔白板中,于37℃、5%co2的下培养孵育5小时,然后按照50μl/孔加入bright-glo
tm luciferase assay试剂,室温1000rpm混匀5分钟,放入化学发光检测仪检测,根据获得的化学发光信号对抗重组人glp-1-fc融合蛋白中和抗体进行定性检测。
[0086]
所述定性检测:通过测试一批个体血清确定中和阈值因子,待测样品的s/n值大于或等于中和阈值因子则被判定为抗重组人glp-1-fc融合蛋白中和抗体阳性;待测样品的s/n值小于中和阈值因子则被判定为抗重组人glp-1-fc融合蛋白中和抗体阴性;s/n=样品信号值/阴性质控样品nc信号值。所述阴性质控样品为不含阳性对照抗体(抗重组人glp-1-fc融合蛋白中和抗体)的对照组。
[0087]
实验例
[0088]
1、样品配制
[0089]
表4、灵敏度曲线样品配制
[0090]
[0091]
表5、药物耐受样品a配制
[0092][0093]
表6、药物耐受样品b配制
[0094][0095]
2、实验方法和结果
[0096]
(1)中和阈值因子
[0097]
中和阈值因子(ncpf)检测方法:将表7中的样品(ind01-33)按照实施例1的方法实施,同时设置阴性质控样品nc(不含阳性对照抗体),记录检测得到信号值,计算s/n,s/n=样品的平均信号值/nc信号值。
[0098]
ncpf计算以s/n为基础。首先通过箱线图的方法剔除离群值,s/n值的上限=第75百分位数+n
×
(第75百分位数
–
第25百分位数),s/n值下限=第25百分位数-n
×
(第75百分位数
–
第25百分位数),n可用1至3之间的数值,通常为1.5,在本发明中取1.5见表7,进行离群值的计算和剔除。ncpf可以用基于风险允许1%假阳性的方法确定。由于本方法为竞争法,阳性样品信号被抑制,所以取剔除离群值以后的数据的第1百分位数会被定义为中和阈值因子。
[0099]
ncpf=percentile(a1,a2
…
an,0.01)
[0100]
其中
[0101]
a1,a2
…
an指代剔除离群值后的所有数据。
[0102]
表7、中和阈值因子分析结果
[0103][0104]
(2)灵敏度检测
[0105]
取表4中的灵敏度曲线样品,按照实施例1的方法实施,记录检测得到的信号值,并计算平均信号值,计算s/n=样品平均信号值/nc信号值,%cv=标准偏差/平均值
×
100,灵敏度=forecast(x,known_y’s,known_x’s),其中,公式中:
[0106]
x:ncpf
[0107]
known_y’s:灵敏度曲线上第一次横跨ncpf的两个样品浓度
[0108]
known_x’s:灵敏度曲线上第一次横跨ncpf的两个样品的s/n,结果见下表8。
[0109]
表8灵敏度分析结果(分析批6)
[0110][0111]
(3)药物耐受分析
[0112]
取表5中的药物耐受样品a和表6中的药物耐受样品b配制药物耐受样品,将40μl的2
×
2000pc或2
×
1000pc或nc分别与40μl的2
×
d1、2
×
d2、2
×
d3、2
×
d4、2
×
d5、2
×
d6、2
×
d7、2
×
d8混合,得到的药物耐受样品(样品编号、阳性对照抗体浓度、药物浓度)见下表,按照实施例1的方法实施,记录检测得到的信号值,并计算平均信号值,计算s/n=样品平均信号值/nc信号值,%cv=标准偏差/平均值
×
100,药物耐受浓度=forecast(x,known_y’s,known_x’s),其中,公式中:
[0113]
x:ncpf
[0114]
known_y’s:横跨ncpf的两个样品的药物浓度
[0115]
known_x’s:横跨ncpf的两个样品的s/n,结果见下表。
[0116]
表9、药物耐受分析(分析批6)
[0117][0118]
综上,采用本发明的方法检测抗抗重组人glp-1-fc融合蛋白中和抗体的灵敏度为300ng/ml。阳性抗体浓度为2000ng/ml时,本发明的方法可耐受的药物浓度为3200ng/ml;阳性抗体浓度为1000ng/ml时,本发明的方法可耐受的药物浓度为1600ng/ml。
[0119]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1