一种检测血清体外杀菌功能的方法与流程
1.本发明属于生物医药技术领域,具体而言,涉及一种检测血清体外杀菌功能的方法。
背景技术:
2.脑膜炎奈瑟菌(neisseria meningitidis)可以通过呼吸道传播引起化脓性脑膜炎。严重威胁婴幼儿的健康。脑膜炎奈瑟菌可分为至少13个血清群,95%的病例由a、b、c、w135和y群引起。上世纪七八十年代,我国流脑流行以a群为主。2002年以来,我国广西、安徽、广东等地发生了c群引起的流脑局部暴发。我国1980年正式使用a群多糖菌苗,临床观察表明其对学龄儿童和成人保护率可达90%。脑膜炎奈瑟菌疫苗免疫反应的实验室评价的一个重要指标是杀菌抗体,其目前已经成为临床终点判定的替代指标。作为脑膜炎奈瑟菌疫苗评价的重要指标,杀菌抗体反映的是抗体中起到保护作用的部分,因而其作用愈显重要。1974年,a/c群流脑多糖疫苗基于血清体外杀菌实验(serum bactericidal assay,sba)的结果上市之后,sba结果作为临床终点的替代物在疫苗的临床试验中起到越来越重要的作用。
3.杀菌抗体的检测方法是血清体外杀菌实验。早在1918年,kolmer等已经证明抗体和补体对脑膜炎的保护作用。1969年,goldschneider等在入伍士兵中研究发现人补体sba≥4对脑膜炎奈瑟菌c群具有保护作用。1976年who推荐了a、c群sba实验方法。1997年美国cdc对who sba方法进行了改进,建立了a、c群标准sba方法,并进行了多实验室间sba结果比较。目前国际实验室基本参照cdc方法建立了各自的a、c群sba实验方法。w135和y群的标准化sba实验方法未见专门的文献报道。由于合格的人补体来源的局限性,who和美国cdc推荐使用3-4周乳兔补体替代人补体。2001年borrow等的研究表明c群乳兔补体sba≥128与人补体sba≥4相当。2014年在中国发表了乳兔补体来源的标准化的流脑四个群sba检测方法,但因为每个群都必须单独进行检测,检测时间较为冗长。
技术实现要素:
4.为解决上述现有技术中所存在的问题,本发明提供了一种检测血清体外杀菌功能的方法。
5.具体而言,本发明提供了:
6.(1)一种检测血清体外杀菌功能的方法,其中所述血清含有两种以上的抗体,这些抗体分别针对某种细菌的不同群别,其特征在于,所述方法包括以下步骤:
7.1)诱导所述不同群别的细菌使其分别具有不同的抗生素抗性;
8.2)在同一体系中,将所述血清、补体和分别具有不同抗生素抗性的不同群别的细菌混合孵育,进行杀菌,得到经杀菌的混合菌液;
9.3)将含有一种群别的细菌所抵抗的抗生素的培养基与所述经杀菌的混合菌液混合,从而使具有该种抗生素抗性的该种群别的细菌生长;对每种群别的细菌进行此步;
10.4)根据每种群别的细菌的生长情况确定所述血清对所述不同群别的细菌的杀菌功能。
11.(2)根据(1)所述的方法,其中所述细菌包括脑膜炎奈瑟菌,所述不同的群别选自a群、b群、c群、w135群和y群中的两种或更多种。
12.(3)根据(1)所述的方法,其中所述血清为经脑膜炎奈瑟菌疫苗免疫生物体后得到的血清。
13.(4)根据(1)所述的方法,其中所述诱导包括:i)用含有一种抗生素的培养基分别培养不同群别的细菌,提高所述抗生素的浓度,使其至少达到这样的浓度:在该浓度下,一种群别的细菌能够生长,且其他群别的细菌不能生长,由此得到一种群别的对所述抗生素具有抗性的细菌;ii)分别用不同的抗生素进行步骤i)所述的方法,直到不同群别的细菌分别具有不同的抗生素抗性。
14.(5)根据(1)或(4)所述的方法,其中所述抗生素选自壮观霉素、甲氧苄氨嘧啶、硫酸链霉素和红霉素中的两种或更多种。
15.(6)根据(1)所述的方法,其中在所述混合孵育时,所述血清为经过补体灭活的血清
16.(7)根据(1)所述的方法,其中在所述混合孵育时,每种群别的细菌的数量为8-14个/μl。
17.(8)根据(1)所述的方法,其中在所述混合孵育时,所述血清的稀释倍数为2倍以上,所述补体的浓度为基于孵育体系的总体积为12.5-25体积%,所述血清、所述补体、和细菌的混合体积比为2:(0.5-1):1。
18.(9)根据(1)所述的方法,其中所述混合孵育在35-37℃下孵育0.5-2小时。
19.(10)根据(1)所述的方法,其中在步骤3)中,所述的使细菌生长在35-37℃下进行12-20小时。
20.本发明与现有技术相比具有以下优点和积极效果:
21.本发明的方法首次提出将a群、c群、w135群和y群流脑体外杀菌试验方法所用的靶细菌进行抗性诱导,使每个群的靶细菌分别带有对不同抗生素的抗性。检测血清的体外杀菌滴度时,在同一杀菌体系中可以同时加入四个群的菌,杀菌过程结束后,进行活菌培养时,再利用含有不同抗生素的培养基区分不同群别的细菌,从而巧妙地实现同时完成不同菌群的杀菌试验。
22.本发明的方法还适用于针对其他细菌的血清体外杀菌功能检测。
23.本发明可达到快速、高通量地进行血清中功能抗体水平的检测,提高工作效率,并且能够节省补体和待检血清的用量(例如可减少4倍),这有益于采血不易的婴幼儿,目前此方法在国内外未有相关的报道。
具体实施方式
24.以下通过具体实施方式的描述对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。
25.脑膜炎奈瑟菌疫苗临床评价的主要指标是血清的体外杀菌滴度。现有的体外杀菌
试验方法是分别针对某种细菌的不同群别,每个群别单独进行检测。本发明的发明人意识到,随着多价疫苗的出现,每个群别进行单独检测会耗费较多的人力物力,花费较长的时间。因此打破惯性思维,巧妙地提出先对不同群别的细菌进行抗性诱导,然后在同一体系中同时加入各群别进行杀菌试验,随后用不同的抗生素培养基进行培养,由此实现同时完成不同菌群的杀菌试验的目的。
26.基于上述发明构思,本发明一个方面提供了一种检测血清体外杀菌功能的方法,其中所述血清含有两种以上的抗体,这些抗体分别针对某种细菌的不同群别,其特征在于,所述方法包括以下步骤:
27.1)诱导所述不同群别的细菌使其分别具有不同的抗生素抗性;
28.2)在同一体系中,将所述血清、补体和分别具有不同抗生素抗性的不同群别的细菌混合孵育,进行杀菌,得到经杀菌的混合菌液;
29.3)将含有一种群别的细菌所抵抗的抗生素的培养基与所述经杀菌的混合菌液混合,例如将所述经杀菌的混合菌液接种于含有一种群别的细菌所抵抗的抗生素的培养基平板,从而使具有该种抗生素抗性的该种群别的细菌生长;对每种群别的细菌进行此步;
30.4)根据每种群别的细菌的生长情况确定所述血清对所述不同群别的细菌的杀菌功能。
31.本发明的发明人研究和探索了诱导不同抗性的思路和要求,包括:1)选择抗生素,优选选择目前已经不常用的抗生素,但需要面对的问题是,对于致病菌来说,对已经淘汰的抗生素可能有普遍的抗性;2)确定不同群别的细菌对所选定的抗生素的天然抗性如何;3)根据具体情况进行定向诱导;4)检测已具有诱导抗性的细菌,对其它群别的菌所带的诱导抗性的抵抗情况;5)确保每种群别的细菌只具有各自的诱导抗性,不具有其他群别的细菌的诱导抗性。由此可见,能够成功地诱导每种群别的细菌分别具有各自的诱导抗性需要严谨、科学的实验构思和大量的筛选工作,是创造性劳动的结果。
32.基于上述思路和要求,在本发明的一些实施方案中,所述诱导包括:i)用含有一种抗生素的培养基分别培养不同群别的细菌,提高所述抗生素的浓度,使其至少达到这样的浓度:在该浓度下,一种群别的细菌能够生长,且其他群别的细菌不能生长,由此得到一种群别的对所述抗生素具有抗性的细菌;ii)分别用不同的抗生素进行步骤i)所述的方法,直到不同群别的细菌分别具有不同的抗生素抗性。
33.在一些实施方案中,所述细菌包括脑膜炎奈瑟菌,所述不同的群别选自a群、b群、c群、w135群和y群中的两种或更多种。
34.在一些实施方案中,所述血清为经脑膜炎奈瑟菌疫苗免疫生物体后得到的血清。
35.优选地,所述抗生素选自壮观霉素、甲氧苄氨嘧啶、硫酸链霉素和红霉素中的两种或更多种。这些抗生素能够满足上文所述的诱导抗性的各项要求。
36.优选地,在所述混合孵育时,所述血清为经过补体灭活的血清。
37.优选地,在所述混合孵育时,所述每种群别的细菌的数量为8-14个/μl,例如8-12个/μl。
38.优选地,在所述混合孵育时,所述血清的稀释倍数为2倍以上,例如2-15倍,所述补体的浓度为基于孵育体系的总体积为12.5-25体积%,所述血清、所述补体、和所述细菌的混合体积比为2:(0.5-1):1。
39.优选地,所述混合孵育在35-37℃下孵育0.5-2小时。
40.在杀菌试验之后进行细菌培养时,优选地,所述培养在35-37℃下培养过夜,例如培养12-20小时。
41.本发明的方法可以用一份血清在同一个杀菌体系中完成针对不同群别的细菌的杀菌滴度检测,大幅度提高了工作效率,节省了试验成本。特别是对于婴幼儿来说,采血不易,这种方法可将待检血清用量减少4倍,减轻了临床试验中采血的负担。
42.以下通过实施例的方式进一步解释或说明本发明内容,但这些实施例不应被理解为对本发明保护范围的限制。
43.实施例
44.以下除非特别说明,否则以下例子中所用实验方法均使用本领域的常规实验流程、操作、材料和条件进行。
45.实施例中所用材料、试剂和仪器来源如下:
46.a.靶菌:四个群的靶菌分别是:a群脑膜炎奈瑟球菌cmcc29201(a4),c群脑膜炎奈瑟球菌cmcc29201(c11),y群脑膜炎奈瑟球菌cmcc29028,w135群脑膜炎奈瑟球菌cmcc29037,这些靶菌得自兰州生物制品研究所有限责任公司,经诱导分别具有对四种不同的抗生素抗性。
47.b.ttc储备液:ttc(购自sigma,t-8877)1.25g,加水至40ml,待其完全溶解后,补足水至50ml,用0.22μm滤膜过滤后备用;
48.c.明胶溶液(1%):明胶(购自sigma,g-9391)0.5g,加水至50ml,高压灭菌(115℃,30min)后备用,室温保存;
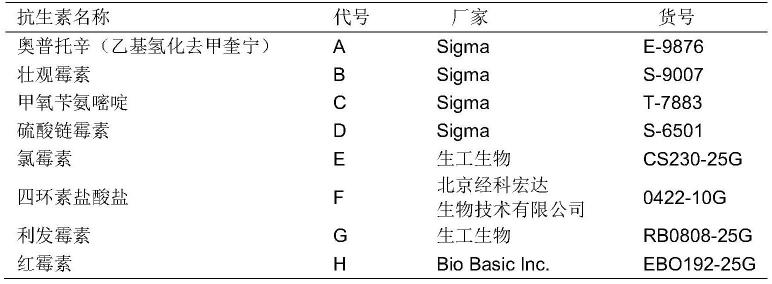
49.d.杀菌缓冲液:灭菌h2o 40ml,10x hbss(购自invitrogen,14065-056)(含ca
2+
,mg
2+
)5ml,1%明胶溶液5ml,现配现用。
50.实施例1:诱导抗性菌株
51.1.材料和方法
52.1.1抗生素的厂家及使用浓度
53.表1-1.抗生素信息
54.[0055][0056]
1.2培养基
[0057]
thya平板:配比为当总体积为800ml时加入24g thb(todd-hewitt,购自becton-dickinson,249240),12g酵母粉(购自becton-dickinson,212750),12g琼脂(购自becton-dickinson,214010)。高压灭菌(115℃,30min)后冷却至56℃,加入适当浓度的抗生素,倒入方形培养皿,每个方形培养皿20ml;得到带有不同抗性的培养基平板,4℃贮存备用。
[0058]
thy液体培养基:配比为当总体积为800ml时加入24g thb,12g酵母粉,0.22μm膜除菌过滤后使用。
[0059]
2.抗性诱导的过程
[0060]
本实施例需要做的是将脑膜炎奈瑟菌四种不同群的细菌分别诱导出对不同抗生素的抗性,从而能够在混合的细菌中,用不同的抗生素将它们分离出来。所以筛选需要经过四步:1)选择抗生素,要选目前已经不常用的抗生素,但这有个问题,对于这种致病菌来说,对这些已经淘汰的抗生素可能都有抗性;2)确定四株细菌对所选定的抗生素的天然抗性如何;3)根据具体情况进行定向诱导;4)检测具有不同抗性的细菌,对其它三株菌所带的抗性的抵抗情况。
[0061]
2.1首先确定四株细菌对八种不同抗生素的抗性范围。
[0062]
四株菌是脑膜炎奈瑟菌a群、c群、w135群、y群;八种不同抗生素见表1-1。
[0063]
将抗生素按照下表在96孔细胞培养板中进行稀释,稀释液为thb液体培养基(thb 30g,酵母粉5g,h2o 1000ml,用0.22μm的滤膜除菌过滤后,保存于4℃)。同样的操作分别在四块板中进行(即,一式四份)。每块板对应一种菌株,分别在每孔中加入菌。观察每种菌在哪些孔中能够生长。阴性对照为:thb液体培养基,不含有抗生素及相应细菌;阳性对照为:thb液体培养基和相应细菌,不含有抗生素。
[0064][0065]
筛选结果见表3
[0066][0067]
从表中可以看出,a、e、f抗生素中有四株或三株菌株均带有抗性,不予考虑。从表中的情况,做出以下判断,y群可诱导b抗生素抗性,命名为菌株yb;w135群可诱导c抗生素抗性,命名为菌株wc;c群可诱导d抗性,命名为菌株cd;a群可诱导h抗性,命名为菌株ah。
[0068]
2.2抗性诱导
[0069]
对菌株ah/cd/wc/yb在浓度更高的抗生素抗性压力下进行诱导,使其对这些抗生素具有更强的抗性。
[0070]
在具有抗生素(每种菌株从1μg/ml至16μg/ml,如果最高浓度下还能够生长,就继续加大浓度进行诱导;如果最低浓度下都不能生长,就降低浓度。所使用的抗生素浓度范围见表4,诱导在thya平板上进行:在诱导过程中进行以下操作:每一个抗生素培养基平板上都同时接种4个群的细菌,每一株菌都要同时接种带四种抗生素的培养基。这样才能够保证筛选出的菌株只能对四种抗生素中的其中一种具有抗性,而对其它三种敏感。在筛选过程中如果有菌株对其中两种抗生素具有抗性,就需要重新调整抗生素浓度。如果还不行,就要从上一步开始重新筛选具有单一抗性的菌落,直到成功。
[0071]
最终得到四株具有单一的较高抗性的菌株:ah/cd/wc/yb。
[0072]
2.3抗性范围的确认
[0073]
以上四株菌诱导至比较高的抗生素抗性浓度时,还需要进行抗性浓度范围的确认,也就是找到只能够有一个群的细菌生长的抗性范围。结果如下:
[0074]
[0075][0076][0077][0078]
表中“+”表示细菌生长,
“‑”
表示细菌不生长。从以上结果可以看出:a群有抗性的抗生素h的浓度探索从0.02至1.6μg/ml,最终确定浓度范围为0.08-0.4μg/ml,该抗生素浓度上限值0.4μg/ml比表3显示的筛选浓度上限值低是因为所用的培养基由液体改为固体,导致a群生长条件改变而耐受抗生素h的浓度有所变化,属于正常现象。经此步抗性范围确认之后所得的条件即为稳定条件;c群有抗性的抗生素d的浓度探索从1至400μg/ml,最终确定浓度范围为50-200μg/ml;w135群有抗性的抗生素c的浓度探索从1至240μg/ml,最终确定浓度范围为8-240μg/ml及以上;y群有抗性的抗生素b的浓度探索从1至480μg/ml,最终确定浓度范围为32-480μg/ml及以上。所以将h的使用浓度定在0.18μg/ml;d的使用浓度定在100μg/ml;c的使用浓度定在30μg/ml;b的使用浓度定在120μg/ml。
[0079]
2.4抗性交叉试验:
[0080]
将上述已确定的浓度用上下两倍的浓度,共三个浓度进行试验,结果如下:
[0081][0082]
结果表明,已确定的抗生素工作浓度正确。
[0083]
实施例2:血清的多群流脑体外杀菌试验
[0084]
1.经脑膜炎奈瑟菌疫苗免疫人体后得到血清,血清样品如下表所示。将血清中的补体灭活:
[0085]
1.1从-80℃冰柜取出样品置于室温。调整水浴温度至56℃。
[0086]
1.2样品完全溶化后,彻底混匀,放在56℃水浴中30分钟。
[0087]
1.3从水浴中取出样品,冷却至室温。
[0088]
1.4在4℃短期贮存样品(<7天),在-80℃长期贮存样品。
[0089][0090]
2.血清稀释:
[0091]
2.1在96孔细胞培养板中,向第1、2列的a至h行加入30μl杀菌缓冲液;向第3至12列的a至g行加入30μl杀菌缓冲液。
[0092]
2.2在板a中,向第3、4列的a至h行加入45μl经热灭活和预稀释(最低2倍)的血清样品1,向第5、6列的a至h行加入45μl经热灭活和预稀释(最低2倍)的血清样品2,继续按此形式加完血清样品5,如下表所示。其余的血清样品按照相同的方式加入板bcd中,如下表所
示。
[0093]
在板a中设置对照a和b,如下表所示。
[0094][0095]
2.3从第3列至12列,进行3倍系列稀释:从h行向g行转移15μl血清,小心混匀,避免产生气泡,从g行再向f行转移15μl,以此类推。在从b行向a行转移15μl混匀后,从a行中吸取15μl液体,弃掉。
[0096]
板a
[0097] 123456789101112a对照a对照b稀释8稀释8稀释8稀释8稀释8稀释8稀释8稀释8稀释8稀释8b对照a对照b稀释7稀释7稀释7稀释7稀释7稀释7稀释7稀释7稀释7稀释7c对照a对照b稀释6稀释6稀释6稀释6稀释6稀释6稀释6稀释6稀释6稀释6d对照a对照b稀释5稀释5稀释5稀释5稀释5稀释5稀释5稀释5稀释5稀释5e对照a对照b稀释4稀释4稀释4稀释4稀释4稀释4稀释4稀释4稀释4稀释4f对照a对照b稀释3稀释3稀释3稀释3稀释3稀释3稀释3稀释3稀释3稀释3g对照a对照b稀释2稀释2稀释2稀释2稀释2稀释2稀释2稀释2稀释2稀释2h对照a对照b稀释1稀释1稀释1稀释1稀释1稀释1稀释1稀释1稀释1稀释1
ꢀꢀꢀ
样品1样品1样品2样品2样品3样品3样品4样品4样品5样品5
[0098]
板b\c\d
[0099][0100]
3.快速解冻4种工作菌种及洗细菌:
[0101]
1)37℃水浴箱里轻轻转动菌种管,使之融化。
[0102]
2)在微型离心机内,12,000g,2分钟。
[0103]
3)小心去除上清,弃掉。
[0104]
4)每管加入1ml杀菌缓冲液,悬浮细菌,混匀。
[0105]
5)12,000g,离心2分钟。
[0106]
6)小心去除上清,弃掉。
[0107]
7)用初始体积杀菌缓冲液重悬细菌沉淀(例如,0.5ml),菌落计数:
[0108]
4.将四株细菌各取一定的体积,加入30ml杀菌缓冲液中,使每株菌的终浓度约为32,000~48,000cfu/ml,得到混合菌液,在具有稀释血清的每孔中加入15μl混合菌液,包括所有的对照孔;
[0109]
5.将补体(3-4周幼兔补体,购自pel-freez biologicals,31061)从冰箱中取出,约需要5ml有活性的补体和0.15ml热灭活的补体。补体在层流架子下吹化,立即将其置于冰上,待用;
[0110]
6.在a板的第一列加入灭活补体,15μl/孔,其余孔加入活性补体,15μl/孔;
[0111]
7.将微量滴定板在小摇床上振荡混匀,置于37℃,5%co2孵箱中,60分钟。为了维持co2的浓度,过程中不要开启孵箱门;
[0112]
8.孵育之后,将板置于冰浴约5分钟,以终止反应;
[0113]
9.分别从每个反应混合物的孔中取10μl加入分别含抗生素h、d、c、b抗性的四种thya平板,抗生素浓度如前文所述。排枪混合每孔的混合物,从每一列的8个孔中取10μl液体,从thya平板的左侧滴加,立即倾斜平板,使滴上的液体流成一条,约2-3cm长,四列32个孔并排滴在一个平板上,平板倾斜使液滴流动的时候,将平板的盖子放在培养基平板下面,盖子上面划着格子,指示每个液滴可以流动的范围,这样完全可以避免液滴流到一起。
[0114]
10.在室温孵育10~20分钟,让液体吸收到琼脂板上;
[0115]
11.将平板反过来放置,37℃、5%co2,孵育16-18小时;
[0116]
12.使用自动菌落计数器计数存活菌落数。
[0117]
13.数据分析:把正常补体对照(对照b)中的菌落数作为标准,计算试验中每孔的杀菌率:杀菌率=[1-(对照b菌落数-被检板孔菌落数目)/对照b菌落数]*100%。杀菌指数为杀菌率50%时的最高血清稀释倍数,该倍数用线性内插入法计算杀菌滴度。
[0118]
结果:
[0119]
各血清样品对脑膜炎奈瑟菌a群、c群、w135群、y群的杀菌滴度如下:
[0120][0121]
注:出现“131220”代表杀菌试验中血清起始稀释倍数太低,在最高稀释度下,细菌仍被杀死大部分或全部杀死,所以无法计算。可以增加起始稀释倍数进行调整
[0122]
本方法用时较常规方法对不同群别分别单独检测用时减少4倍,大大提高了工作效率,显著地节省了时间、人力、物力成本,非常适合产业化应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1