一种检测新型鹅星状病毒ORF2蛋白抗体的特异性多肽-ELISA试剂盒及其方法
一种检测新型鹅星状病毒orf2蛋白抗体的特异性多肽-elisa试剂盒及其方法
技术领域
1.本发明涉一种检测新型鹅星状病毒orf2蛋白抗体的特异性多肽-elisa试剂盒及其方法,属于生物技术检测领域。
背景技术:
2.新型鹅星状病毒(goose astrovirus,gastv)是一种能引起雏鹅痛风的无囊膜单股正链rna病毒。自2015年,我国不同地区雏鹅陆续发生一种以内脏尿酸盐沉积为主要症状,并伴有关节尿酸盐沉积的传染性疾病。该病的发生与发展已对我国养鹅业造成了极大危害,已成为危害养鹅业健康发展的一种重要传染病,严重制约了国内家禽业的健康发展。虽然已经开发了几种诊断方法来检测gastv,例如实时pcr和环介导的等温扩增法(lamp)检测病毒核酸,免疫层析条测定法直接捕获病毒,然目前缺乏商品化的检测gastv特异性抗体的血清学诊断技术。因此,本研究拟以靶向gastv结构蛋白orf2的特异性多肽为抗原,建立高效灵敏的血清学检测方法,为gastv感染诊断和免疫监控提供技术支撑。
技术实现要素:
3.本发明的目的在于针对现有技术中所存在问题,提供一种测新型鹅星状病毒orf2蛋白抗体的特异性多肽-elisa试剂盒及其方法。本发明的原理是将人工合成的独有特异性多肽作为包被抗原组装检测gastv抗体的间接elisa试剂盒。检测结果显示,该检测gastv抗体的间接elisa试剂盒具有良好的gastv特异性、敏感性,在gastv病毒流行病学调查中具有良好的应用价值。
4.本发明的目的是这样实现的:一种检测新型鹅星状病毒orf2蛋白抗体的特异性多肽-elisa试剂盒,其特征在于,所述试剂盒包含包被gastv独有特异性多肽的酶标板、阳性阴性对照、hrp标记的兔抗鸡二抗、样品稀释液、洗涤液、显色液以及终止液;
5.所述包被的gastv独有特异性多肽是根据gastv线性b细胞抗原表位序列设计合成,具体的序列如下:cqtltdpeedddplsdvtslfd。
6.所述包被gastv独有特异性多肽的酶标板是通过如下方法制得:
7.人工合成gastv独有特异性多肽并对其进行klh偶联,用超纯水稀释至1μg/μl后进行保存;
8.包被时,用碳酸盐缓冲液将多肽进行稀释,使得特异性多肽的浓度为3μg/ml,以100μl/孔的量包被于96孔酶标板中,4℃反应过夜后用360μl pbst洗板一次;每孔加入360μl用pbst稀释的5%脱脂乳进行封闭,37℃孵育30min后用360μl pbst洗板1次,晾干备用。
9.所述样品稀释液是通过pbs中加入脱脂乳和tween-20制得,所述脱脂乳终浓度为1%,tween-20的终浓度为0.05%。
10.所述洗涤液是pbst洗涤液。
11.所述显色液是tmb显色溶液。
12.所述终止液是浓度为2mol/l的硫酸溶液。
13.利用所述的试剂盒检测新型鹅星状病毒orf2蛋白抗体的方法,elisa的封闭时间,一抗孵育时间和二抗孵育时间均为30min,显色时间为10min。具体方法为:
14.将待检血清以及阳性阴性血清用含1%脱脂乳的pbst样品稀释液按照1:400进行稀释,并设置空白对照,将稀释好的血清加入包被gastv独有特异性多肽的酶标板,每孔100μl,37℃反应30min;360μl的pbst洗涤液洗涤3遍后,加入1:10000稀释的hrp标记的兔抗鸡二抗,37℃反应30min;360μl的pbst洗涤液洗涤3遍后,用tmb显色溶液进行显色10min,随后加入终止液终止显色;读取od
450
吸光值;elisa方法采用s/p比值进行判定,公式为s/p=(样品od
450
nm值-阴性对照od
450
nm平均值)/(阳性对照od
450
nm平均值-阴性对照od
450
nm平均值),s/p比值大于临界值判为阳性,s/p比值小于或等于临界值判为阴性;
15.所述临界值为0.495。
16.本发明方法先进科学,通过本发明,提供的一种检测新型鹅星状病毒抗体的特异性多肽-elisa试剂盒,包含包被gastv独有特异性多肽的酶标板、阳性阴性对照、hrp标记的兔抗鸡二抗、样品稀释液、洗涤液、显色液以及终止液;所述包被新型鹅星状病毒orf2蛋白的特异性多肽的酶标板是通过如下方法制备:人工合成特异性多肽并对其进行klh偶联,具体多肽序列如下:klh-cqtltdpeedddplsdvtslfd。合成的多肽均用超纯水稀释至1μg/μl后进行保存。包被时,用碳酸盐缓冲液将多肽进行稀释,使得特异性多肽的浓度为3μg/ml,以100μl/孔的量包被于96孔酶标板中,4℃反应过夜后用360μl pbst洗板一次;每孔加入360μl用pbst稀释的5%脱脂乳进行封闭,37℃孵育30min后用360μlpbst洗板1次,晾干备用。
17.将待检血清以及阳性阴性血清用含1%脱脂乳的pbst按照1:400进行稀释,并设置空白对照,将稀释好的血清加入酶标板,每孔100μl,37℃反应30min;360μl的pbst洗涤3遍后,加入1:10000稀释的hrp标记的兔抗鸡抗体,37℃反应30min;360μl的pbst洗涤3遍后,用tmb溶液进行显色10min,随后加入终止液终止显色。读取od
450
吸光值。elisa方法采用s/p比值进行判定。公式为s/p=(样品od
450
nm值-阴性对照od
450
nm平均值)/(阳性对照od
450
nm平均值-阴性对照od
450
nm平均值)。s/p比值大于临界值判为阳性,s/p比值小于或等于临界值判为阴性。
18.与现有技术相比,本发明具有如下的有益技术效果:
19.本发明可用于检测gastv特异性抗体,评估鹅群感染情况。本发明使用人工合成方法制备gastv的orf2蛋白独有特异性多肽,纯度高,特异性好,直接靶向orf2抗体,避免其他物质引起的非特异性反应,减少假阳性,提高检测准确性;具有灵敏度高,成本低,操作简便,速度快、特异性强等优点,能被基层单位广泛使用。
20.本发明涉及一种基于多肽的检测新型鹅星状病毒抗体的间接elisa试剂盒,包含了包被gastv的orf2特异性多肽的酶标板,商品化的兔抗鸡hrp标记的二抗,通过间接elisa方法有效检测gastv抗体。通过本发明,可以实现快速特异检测gastv抗体。此试剂盒能用于大规模血清学检测和流行病学调查,在gastv感染以及免疫检测中具有良好的应用和推广价值。
附图说明
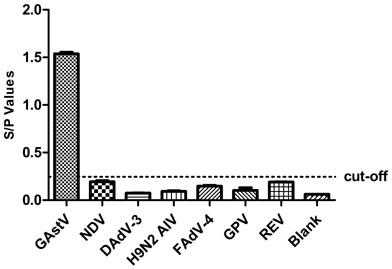
21.图1为基于orf2蛋白的特异性多肽间接elisa试剂盒特异性检测。
具体实施方式
22.下面结合实施例和附图对本发明做进一步说明。
23.实施例:
24.1.gastv独有特异性多肽的合成;
25.人工合成gastv独有特异性多肽并进行klh偶联,其序列如下:klh-cqtltdpeedddplsdvtslfd,纯化后纯度在95%以上。
26.2.间接elisa方法的具体步骤;
27.将终浓度为3μg/ml的多肽以100μl/孔的量包被于96孔酶标板中,包被过夜后,洗涤液洗板1次;加入5%脱脂乳进行封闭,37℃孵育30min,洗涤液洗板1次;随后加入用样品稀释液1:400稀释的样品血清、阳性阴性血清,每孔100μl,同时设置空白对照,37℃孵育30min,洗涤液洗板3次;加入稀释10000倍的hrp酶标二抗,每孔100μl,37℃孵育30min,洗涤液洗板3次;用tmb溶液避光显色10min,随后加入终止液终止显色。酶标仪测定od
450
。结果判定:采用s/p比值进行判定。公式为s/p=(样品od
450
nm值-阴性对照od
450
nm平均值)/(阳性对照od
450
nm平均值-阴性对照od
450
nm平均值)。s/p比值大于临界值判为阳性,s/p比值小于或等于临界值判为阴性。
28.3.检测gastv抗体的间接elisa方法的特异性分析;
29.相同条件下,对gastv阳性血清,fadv-4、h9n2 aiv、alv-j、ndv、gpv、rev、dadv-3等禽源病毒的阳性血清以及阴性血清进行检测。结果表明,该试剂盒只与gastv阳性血清反应,而与所检测的其它病毒阳性血清及阴性血清均没有反应。说明这种elisa方法均具有很好的特异性(见图1)。
30.4.检测gastv抗体的间接elisa方法的重复性性分析;
31.取4份抗gastv的阳性鹅血清进行批内和批间重复,分别用同一批抗原包被的酶标板和3个批次包被的酶标板各重复检测3次,计算标准偏差,结果显示,批内重复实验中变异系数最大为9.42%,最小为1.48%且批间重复实验中变异系数最大为5.63%,最小为0.41%(表1),表明该间接elisa的批间批内实验变异程度较小,具有良好的重复性。
32.5.检测gastv抗体的间接elisa方法的灵敏度性分析;
33.取5份gastv阳性鹅血清进行梯度稀释(1:100、1:200、1:400、1:800、1:1600、1:3200、1:6400、1:12800)后进行elisa检测,同时将0.1moi gastv病毒感染lmh细胞,在96h后固定细胞,以ifa方法进行同步检测。比较两种方法的检测效果,评估elisa方法的灵敏度。结果显示,本建立elisa方法敏感性最高可达1:3200(表2),远高于ifa方法的敏感性(1:400),表明方法的敏感性好。
34.6.临床样品的检测;
35.为了评估间接elisa在临床样本中的实际适用性,对112份血清样本分别进行了elisa和ifa。结果显示,elisa检测中80份血清呈现阳性,32份呈现阴性,而ifa中70份血清为阳性,42份为阴性。与ifa结果相比,阳性符合率为85%(68/80),阴性符合率为93.75%(30/32)(表3)。表明elisa检测方法可用于临床应用,而且比ifa具有更高的灵敏度。
36.表1
[0037][0038]
注:表中的数值均为s/p比值
[0039]
表2
[0040][0041]
注:elisa(s/p≥0.495,gastv抗体阳性;s/p<0.495,gastv抗体阴性);
[0042]
ifa(+为gastv抗体阳性;-为gastv抗体阴性)
[0043]
表3
[0044][0045]
注:+为使用该检测方法检测血清出现gastv抗体阳性;-为使用该检测方法检测血清出现gastv抗体阴性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1