蓝藻水华对水生植物的生物效应评估方法
1.本技术涉及水生植物评估的技术领域,更具体地说,它涉及蓝藻水华对水生植物的生物效应评估方法。
背景技术:
2.在水生生态系统中,水生植物是湖泊的主要初级生产者,其生长于湖泊水体中,能够稳定沉积物、降低水体流速,为微生物、底栖生物和鱼类提供栖息地和饵料,还可以净化水质,抑制微型藻类的过量繁殖,维持生态系统的结构和功能,对生态系统物质能量的循环和传递起调控作用。蓝藻与水生植物存在互相竞争关系,蓝藻可通过竞争光照、营养盐、释放化感物质等途径来影响水生植物的生长,而且,蓝藻在水中漂浮的过程中也会被水生植物黏附,蓝藻会很快死亡释放出高浓度营养盐、藻毒素等物质进一步影响水生植物。
3.目前,关于蓝藻水华对水生植物的影响的研究比较广泛,但多数研究集中于蓝藻产生的单一物质对水生植物的影响方面。蓝藻水华及其腐解液对水生植物的危害,应该是多种因素引起的综合效应,而不仅是单一的因素(藻毒素、氨氮等)所引起的,且蓝藻分泌物及降解后的产物比较复杂,仅从单一物质或几种物质评估蓝藻及其腐解液带来的危害往往与实际水体出现较大偏差,在蓝藻水华暴发的背景下,以蓝藻量为衡量单位来研究蓝藻及其堆积腐解液对水生植物的生物效应尚未引起广泛关注。
4.本发明以蓝藻及其腐解液为研究对象,探究其对苦草和狐尾藻的生态效应,分析了水生植物的生物量、抗氧化物应激指标、组织细胞结构以及水生植物表层附着微生物的变化,以探明导致水生态系统崩溃时蓝藻水华程度,为我国蓝藻水华灾害的生态安全阈值指标体系完善提供支撑。
技术实现要素:
5.为了以蓝藻及其腐解液为研究对象,探究其对苦草和狐尾藻的生态效应,本技术提供蓝藻水华对水生植物的生物效应评估方法。
6.本技术提供蓝藻水华对水生植物的生物效应评估方法,采用如下的技术方案:
7.蓝藻水华对水生植物的生物效应评估方法,包括以下步骤:
8.选取苦草与狐尾藻,并对两种水生植物进行预处理;
9.将苦草与狐尾藻分为2组,每组包含5个小组,将5个小组编号为0 4,每小组包含10株苦草与10株狐尾藻,并对每小组中的每株植株分别编号1~10;
10.向其中一组加入新鲜蓝藻,命名为新鲜蓝藻处理组,向另一组加入蓝藻腐解液,命名为蓝藻腐解液处理组,两组中编号为0的小组作为不添加新鲜蓝藻与不添加蓝藻腐解液的空白组;
11.水培14d后,采取苦草与狐尾藻的叶片组织,检测叶片的细胞膜透性、植物抗逆性、植物应激指标、显微镜下细胞形态,并对苦草与狐尾藻进行扫描电镜分析、透镜电镜分析、微生物采样分析,以检测结果评估苦草与狐尾藻的生物效应。
12.优选的,所述苦草与所述狐尾藻的预处理方法为:去除损伤或死亡的叶片及组织后,对其进行7d的过渡培养,选取生长状况良好且长势相近的植株备用。
13.优选的,所述新鲜蓝藻与所述蓝藻腐解液的添加量随小组编号的增加而增加。
14.优选的,所述新鲜蓝藻处理组与所述蓝藻腐解液处理组编号3与编号4的两组植株中新鲜蓝藻或蓝藻腐解液的添加量相同,但所述编号4的小组植株与新鲜蓝藻或蓝藻腐解液通过微孔滤膜分隔。
15.优选的,水培养时的用水为通过1~3μm慢速滤膜过滤后的湖水与去离子水的混合物。
16.优选的,检测细胞膜透性的方法为:取叶片适量,用去离子水清洗干净,用吸水纸吸干叶片表面水分后将叶片剪碎;称取鲜重0.1g,置于25ml比色管中,加去离子水10ml,塞上玻璃塞置于室温浸泡12h,用电导仪测定浸提液电导值r1,然后90℃水浴加热30min,冷却室温后摇匀,再次测量浸提液电导值r2,计算相对电导率为r0,其计算公式为:,其计算公式为:
17.优选的,检测植物应激指标前对植物进行前处理,前处理方法为:取新鲜植物叶片,使用ph7.8的pbs缓冲液作为保护液研磨提取,并于10000r/min下离心15min,取上清液用于检测应激指标。
18.优选的,在显微镜下观察植物细胞形态前,先制作临时切片,临时切片制作方法为:取新鲜植物叶片适量,平放在玻璃板上,用食指和拇指紧紧捏住两个对齐合并的刀片,对需要切割的材料轻轻地压切,材料薄片就夹在两刀片之间;分开两刀片,用解剖针小心地把薄片剔进带有一滴水的载玻片中央,再盖上盖玻片,制作完成。
19.优选的,进行扫描电镜与透镜电镜前,先对叶片进行前处理,前处理方法为:1)先取1
×3×
1mm3大小的植物组织,将其置于1.5ml离心管内,使用2.5%的戊二醛溶液在4℃下固定24h;2)倒掉固定液,用0.1m、ph7.0的磷酸缓冲液漂洗样品3次,每次15min;3)用1%的锇酸溶液固定样品1~2h;4)取出锇酸废液,用0.1m、ph7.0的磷酸缓冲液漂洗样品3次,每次15min;使用梯度浓度为30%、50%、70%、80%、90%与95%的乙醇溶液对样品进行脱水处理,每种浓度处理15min,再用100%的乙醇处理2次,每次20min;5)使用乙醇与醋酸异戊酯的混合液(v/v=1/1)处理样品30min,再用纯醋酸异戊酯处理样品1h或放置过夜;6)临界点干燥、镀膜、观察后完成前处理。
20.优选的,微生物采样分析前对叶片进行前处理,前处理方法为:1)在同一组中取3个不同样点的植物叶片,将三份等量混匀成一个样本;2)将植物组织浸没于无菌pbs溶液中,180rpm孵育20min;3)取出样本,再次加入无菌pbs溶液,180rpm孵育20min;4)再次取出样本,加入无菌pbs溶液,超声波洗涤10min;5)将3次洗涤液汇总,过0.2μm滤膜,收集滤膜至于干冰盒中低温保存备用。
21.综上所述,本发明具有以下有益效果:
22.通过本发明的评估方法评估蓝藻水华对水生植物苦草与狐尾藻的生物效应的影响,具体分析了水生植物的生物量、抗氧化物应激指标、组织细胞结构以及水生植物表层附着微生物的变化,为我国蓝藻水华灾害的生态安全阈值指标体系完善提供支撑。
附图说明
23.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
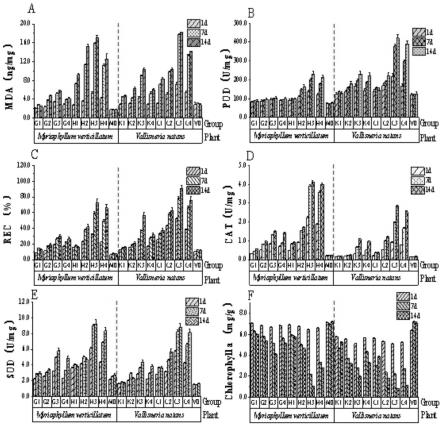
24.图1是本实施例中水生植物在蓝藻及其腐解液胁迫下的应激性指标示意图。
25.图2本实施例实验组中水生植物组织及显微镜观察示意图。
26.图3是本实施例中苦草叶表面扫描电镜示意图。
27.图4是本实施例中狐尾藻叶表面扫描电镜示意图。
28.图5是本实施例中实验组苦草及狐尾藻叶片组织透射电镜示意图。
29.图6是本实施例中实验组水生植物生物量变化示意图。
30.图7是本实施例中v0、k3、k4实验组三元相分析图。
31.图8是本实施例中v0、l3、l4实验组三元相分析图。
32.图9是本实施例中m0、g3、g4实验组三元相分析图。
33.图10是本实施例中m0、h3、h4实验组三元相分析图。
具体实施方式
34.本发明实验设备主要有紫外分光光度计、水浴锅、电导仪、振荡器、奥林巴斯显微镜、su8010日立新型高分辨场发射扫描电镜su8000、透射电镜fei tecnai spirit(120kv tem)。
35.实验装置为有机玻璃装置(长50cm、宽50cm、高25cm)。
36.丙二醛(mda)、过氧化氢酶(pod)、超氧化物歧化酶(sod)、过氧化氢酶(cat)等酶试剂盒购自南京建成生物工程研究所。
37.实验用苦草购自上海千草堂水草店,狐尾藻采自太湖竺山湾。
38.实验中的湖水采自太湖竺山湾湖水。
39.以下结合实施例对本技术作进一步详细说明。
40.蓝藻水华对水生植物的生物效应评估方法,包括以下步骤:
41.选取苦草与狐尾藻,去除损伤或死亡的叶片及组织后,对其进行7d的过渡培养,选取生长状况良好且长势相近的植株备用,植株信息见表1;
42.将苦草与狐尾藻分为2组,每组包含5个小组,将5个小组编号为0 4,每小组包含10株苦草与10株狐尾藻,对每小组中的每株植株分别编号1 10;
43.向其中一组加入新鲜蓝藻,命名为新鲜蓝藻处理组,向另一组加入蓝藻腐解液,命名为蓝藻腐解液处理组,两组中编号为0的小组作为不添加新鲜蓝藻与不添加蓝藻腐解液的空白组,新鲜蓝藻与蓝藻腐解液的添加量随小组编号的增大而增加,新鲜蓝藻处理组与蓝藻腐解液处理组编号3与编号4的两组植株中新鲜蓝藻或蓝藻腐解液的添加量相同,但编号4的小组植株与新鲜蓝藻或蓝藻腐解液通过微孔滤膜分隔,具体分组以及编号命名等信息见表2,每个小组中的每株植株中,编号1 3的植株用来测量生物量的变化,编号4~10的植株用来测定其他指标;
44.使用通过1~3μm慢速滤膜过滤后的湖水与去离子水(v/v=1/1)的混合水,水培
14d后,采取苦草与狐尾藻的叶片组织,检测叶片的细胞膜透性、植物抗逆性、植物应激指标、显微镜下细胞形态,并对苦草与狐尾藻进行扫描电镜分析、透镜电镜分析、微生物采样分析,以检测结果评估苦草与狐尾藻的生物效应。
45.检测叶片细胞膜透性的方法为:取叶片适量,用去离子水清洗干净,用吸水纸吸干叶片表面水分后将叶片剪碎;称取鲜重0.1g,置于25ml比色管中,加去离子水10ml,塞上玻璃塞置于室温浸泡12h,用电导仪测定浸提液电导值r1,然后90℃水浴加热30min,冷却室温后摇匀,再次测量浸提液电导值r2,计算相对电导率为r0,其计算公式为:
46.检测植物应激指标前先对植物进行前处理,前处理方法为:取新鲜植物叶片,使用ph7.8的pbs缓冲液作为保护液研磨提取,并于10000r/min下离心15min,取上清液用于测应激指标。
47.在显微镜下观察植物细胞形态前,先制作临时切片,临时切片的制作方法为:取新鲜植物叶片适量,平放在玻璃板上,用食指和拇指紧紧捏住两个对齐合并的刀片,对需要切割的材料轻轻地压切,材料薄片就夹在两刀片之间;分开两刀片,用解剖针小心地把薄片剔进带有一滴水的载玻片中央,再盖上盖玻片,制作完成。
48.进行扫描电镜与透镜电镜前,先对植物叶片进行前处理,前处理方法为:1)先取1
×3×
1mm3大小的植物组织,将其置于1.5ml离心管内,使用2.5%的戊二醛溶液在4℃下固定24h;2)倒掉固定液,用0.1m、ph7.0的磷酸缓冲液漂洗样品3次,每次15min;3)用1%的锇酸溶液固定样品1~2h;4)取出锇酸废液,用0.1m、ph7.0的磷酸缓冲液漂洗样品3次,每次15min;使用梯度浓度为30%、50%、70%、80%、90%与95%的乙醇溶液对样品进行脱水处理,每种浓度处理15min,再用100%的乙醇处理2次,每次20min;5)使用乙醇与醋酸异戊酯的混合液(v/v=1/1)处理样品30min,再用纯醋酸异戊酯处理样品1h或放置过夜;6)临界点干燥、镀膜、观察后完成前处理。
49.微生物采样分析前先对叶片进行前处理,前处理方法为:1)在同一组中取3个不同样点的植物叶片,将三份等量混匀成一个样本;2)将植物组织浸没于无菌pbs溶液中,180rpm孵育20min;3)取出样本,再次加入无菌pbs溶液,180rpm孵育20min;4)再次取出样本,加入无菌pbs溶液,超声波洗涤10min;5)将3次洗涤液汇总,过0.2μm滤膜,收集滤膜至于干冰盒中低温保存备用。
50.表1-植株生长情况
[0051][0052]
表2-新鲜蓝藻与蓝藻腐解液处理组的具体信息
[0053][0054][0055]
性能检测试验
[0056]
对上述经过新鲜蓝藻处理与经过蓝藻腐解液处理的苦草叶片与狐尾藻叶片进行以下性能检测。
[0057]
试验方法
[0058]
1、叶片细胞膜透性测定
[0059]
取叶片适量,用去离子水清洗干净,用吸水纸吸干叶片表面水分后将叶片剪碎;称取鲜重0.1g,置于25ml比色管中,加去离子水10ml,塞上玻璃塞置于室温浸泡12h,用电导仪测定浸提液电导值r1,然后90℃水浴加热30min,冷却室温后摇匀,再次测量浸提液电导值r2,计算相对电导率为r0,其计算公式为:将检测结果记录在图1中。
[0060]
2、植物抗逆性评价
[0061]
采用模糊数学中的隶属函数法,通过苦草及狐尾藻的实验过程中不同生理指标变化,进行综合评价。对应的每种生理指标求出其隶属值,与抗逆性正相关的计算公式为:呈负相关的计算公式为:最终将各指标的隶属值进行加和,得到不同物种的抗逆性综合指标,综合值越大,表示其抗逆性越强。
[0062]
其中,x(μ)为隶属值,x0为该指标某一测定值(取平均值),x
max
为该指标对应的最大值测定值,x
min
为该指标对应的最小值测定值。将计算结果记录在表3、图1中。
[0063]
3、植物应激指标的测定
[0064]
使用上述检测出的上清液检测植物应激指标。其中,超氧化物歧化酶(sod)活性采用nbt还原法测定;过氧化物酶(pod)活性测定采用愈创木酚法;过氧化氢酶(cat)活性采用
钼酸铵法测定;丙二醛(mda)含量硫代巴比妥酸法测定。植物叶片组织中的叶绿素a浸提后用紫外分光光度计测定叶片单位鲜重的叶绿素含量;生物量采用鲜重法表示。将检测结果记录在表3、图1中。
[0065]
表3-水生植不在不同处理下的生理指标及综合抗逆性评价
[0066][0067]
4、显微镜细胞形态观察
[0068]
将上述制备好的切片置于显微镜下,观察其细胞形态,将其记录在图2中。
[0069]
5、扫描电镜及透射电镜
[0070]
对前处理完成的样品分别进行扫描电镜处理与透射电镜处理,苦草叶表面扫描电镜图如图3所示,狐尾藻叶表面扫描电镜图如图4所示,苦草及狐尾藻叶片组织透射电镜图如图5所示。
[0071]
6、微生物采样分析
[0072]
将低温保存的样品干冰降温快递至上海欧易生物医学科技有限公司分析检测,将检测结果记录在图6~图10中。
[0073]
试验结果分析
[0074]
根据图1a可知,苦草和狐尾藻mad含量变化,不同处理组之间mad含量差异显著(p<0.05),且随着胁迫时间的延长发生显著变化(p<0.05)。新鲜蓝藻处理下表现为苦草>狐尾藻,蓝藻腐解液处理实验组则二者差别不显著(p>0.05)。分析1d、7d及14d总体平均值可得,新鲜蓝藻处理实验组表现为狐尾藻g3>g2>g4>g1,苦草k3>k4>k2>k1;蓝藻腐解液处理实验组狐尾藻h3>h2>h4>h1,苦草l3>l4>l2>l1。试验第1d、7d、14d新鲜蓝藻处理的苦草和狐尾藻中mad增幅均值分别为16.56%和46.63%、70.92%和47.57%、21.36%和7.98%;蓝藻腐解液处理的实验组中狐尾藻和苦草平均增幅为82.72%和115.89%、131.11%和188.21%、7.59%和20.10%。结果表明水生植物在受胁迫前期增幅比较显著。其中,第14d的g1的增幅为-12.76%。
[0075]
根据图1b可知,苦草和狐尾藻pod含量变化,在新鲜蓝藻处理的狐尾藻中各实验组之间差异不显著(p>0.05),而在腐解液处理的实验组之间则存在显著差异(p<0.05),而在苦草实验组中新鲜蓝藻及蓝藻腐解液处理的实验组之间均存在显著差异(p<0.05),表明苦草和狐尾藻在对蓝藻及其腐解液的胁迫产生的应激反应存在差异,但以上两种水生植物中pod含量均表现出对蓝藻腐解液的应激更强一些。第1d、7d、14d,新鲜蓝藻处理的苦草和狐尾藻中pod增幅均值分别为17.56%和20.58%、19.61%和5.49%、10.96%和3.13%;蓝藻腐解液处理的实验组中狐尾藻和苦草平均增幅为43.86%和56.31%、44.77%和
35.09%、12.75%和10.26%。其中14d的k1(-4.71%)、l1(-7.36%)、g1(-2.23%)、h1(-2.13%)。
[0076]
根据图1c可知,随着蓝藻及其腐解液浓度增加及处理时间的延长,植物组织中的相对电导率逐渐升高,与对照组之间均存在极显著差异(p<0.01),其中新鲜蓝藻处理实验组变化弱于蓝藻腐解液处理组。新鲜蓝藻处理实验中苦草与狐尾藻的相对电导率变化相当,腐解液处理组则表现为苦草>狐尾藻。表明新鲜蓝藻的分泌物对两种水生植物细胞膜通透性的影响相似,蓝藻腐解液产物对细胞膜的破坏程度大于新鲜蓝藻的分泌物,对苦草细胞膜通透性的影响强于狐尾藻。实验处理第1d、7d、14d,新鲜蓝藻处理的苦草和狐尾藻中相对电导率增幅均值分别为74.88%和122.6%、35.42%和49.58%、20.58%和7.39%;蓝藻腐解液处理的实验组中狐尾藻和苦草平均增幅为286.75%和268.6%、48.46%和72.95%、11.96%和13.24%。其中第14d的g1(-12.66%)、h1(-11.22%)说明随着时间的延长,低浓度的狐尾藻植株有恢复趋势。
[0077]
根据图1d可知,在不同实验组处理下,sod随着蓝藻浓度增加及处理时间的延长表现出逐渐增加的趋势,与对照组相比均存在显著差异(p<0.5),其中狐尾藻sod变化较苦草强一些。处理第1d、7d、14d,新鲜蓝藻处理的苦草和狐尾藻中sod增幅均值分别为42.27%和19.93%、30.07%和36.99%、5.33%和20.41%;蓝藻腐解液处理的实验组中狐尾藻和苦草平均增幅为160.2%和114.15%、45.54%和34.33%、12.62%和3.56%。其中第14d的k1(-4.73%)、k2(-21.62%)、l1(-0.875%)、h1(-4.79%)、h2(-6.17%)。
[0078]
根据图1e所示,在新鲜蓝藻处理实验组的狐尾藻与对照组之间存在显著差异(p<0.05),苦草的低浓度组k1、k2与对照组差异不显著(p>0.05);蓝藻腐解处理实验组苦草及狐尾藻实验组与对照组均差异显著(p<0.05)。处理第1d、7d、14d,新鲜蓝藻处理的苦草和狐尾藻中cat增幅均值分别为45.53%和179.83%、72.06%和46.86%、41.79%和29.91%;蓝藻腐解液处理的实验组中狐尾藻和苦草平均增幅为303.15%和550.12%、99.40%和76.45%、30.21%和9.68%。其中第14天的l1(-0.28%)。
[0079]
根据图1f所示,实验组处理下叶绿素均有所降低,但低浓度新鲜蓝藻处理组(g1、k1)变化不明显,且在k1组实验后期,叶绿素出现回升。高浓度新鲜蓝藻处理组及蓝藻腐解液处理组叶绿素随着浓度增加及处理时间的延长,出现较大幅度降低,尤其在1 7d时间段更加明显。实验处理第1d、7d、14d新鲜蓝藻处理的苦草和狐尾藻中叶绿素a增幅均值分别为-1.48%和-0.40%、-30.79%和-16.72%、-13.12%和-10.17%;蓝藻腐解液处理的实验组中狐尾藻和苦草平均增幅分别为-18.98%和-6.32%、-51.69%和-38.89%、-29.49%和-19.87%,第14d的k1(13.48%)、l1(27.78%)。
[0080]
根据表3可知,苦草和狐尾藻在新鲜蓝藻及腐解液处理情况下表现出的抗逆性强弱相当,苦草略高于狐尾藻,对比不同处理方式发现两种水生植物对新鲜蓝藻的抗逆性均略高于蓝藻腐解液,这一结果同生物量变化规律基本一致。表3指标的变化表明实验组的苦草及狐尾藻的抗氧化酶系统的活性受到了干扰,活性氧清除能力下降,氧化胁迫加剧,细胞膜脂过氧化程度增加。
[0081]
根据图2可知,在对照组状态下的苦草(v0)及狐尾藻(m0),其叶片翠绿,长势健康,对应的细胞形态(v0&m0)较清晰,组织结构较缜密,且在细胞分布较多的细胞质基质及叶绿体等(植物表皮细胞排列紧密,具保护内部组织的功能,通常不含叶绿体,但在蕨类和水生
植物中则含有叶绿体)。在高浓度新鲜蓝藻实验组(k3&g3)的第14d处理后,苦草(v1)及狐尾藻(m1)出现死亡,且在植物表层出现较多的絮状覆盖物,水质较浑浊,对应的组织细胞形态为细胞中空无色素,细胞器消失,部分细胞破损,在细胞表面有蓝藻群落附着。在高浓度新鲜蓝藻腐解液实验组(l3&h3)的第14d处理后,苦草(v2)及狐尾藻(m2)也出现死亡,植株的大部分叶片死亡,通过显微镜观察组织细胞形态同k3&g3相似,但组织表面相对清洁,形态较清晰。
[0082]
根据图3可知,在对照组中(图3v0)苦草叶片主要分布球菌和杆状菌,实验组(图3k3&l3)的苦草叶片表面主要分布杆状菌且附着大量的有机物等颗粒,其中新鲜蓝藻(图3k3)实验组有机物颗粒聚集较多。虽然对照组a0叶片表面也存在微生物附着,但相对量较少。在k3组和l3组的叶片表面生物膜在视觉上比a0组有更多的黏附物,并衍生出有机物(k3-3和l3-3),表面附着物量大小为k3>l3>v0,表明少量的蓝藻的提取物和分泌物都可以作为细菌和浮游植物生长的营养源,可以导致植物叶片表面更加粗糙。
[0083]
根据图4可知,对照组(图4m0)狐尾藻叶片表面同样存在包括球菌和杆菌等的颗粒,狐尾藻对照组m0叶片表面微生物附着,但相对狐尾藻实验组g3和h3组狐尾藻的表面附着物较少。实验组(图4g3&m0)叶片表面均以球状菌为优势菌类,且表面均有有机物颗粒附着,表面附着物量大小为g3>h3>m0。
[0084]
比较图3、图4可知,在添加高浓度新鲜蓝藻的实验组(k3&g3)叶片表面的附着物量最大,分析原因可能由于新鲜蓝藻细胞会产生胞外分泌物,如多糖、壳聚糖等,不仅可以作为微生物的营养源,同时会增加水体微生物之间的粘黏性,导致微生物群落或细胞颗粒更容易附着在植物叶片表面,此外蓝藻分泌物会增大植物叶片粗糙程度,利于微生物附着。对比v0和m0发现,苦草表面附着物略多于狐尾藻,可能由于两种植物自身叶片形状的区别,苦草叶片呈扁平带形,状利于微生物附着,而狐尾藻单个叶片为圆柱体附着性相对较低。
[0085]
根据图5可知,处理组的苦草细胞间隙被阻塞及细胞内出现核固缩现象(l3-a),细胞内的叶绿体出现损伤,且表现出贴壁沉积(l3-b),同时细胞内线粒体出现破损碎裂(l3-c);在狐尾藻透射电镜中发现叶绿体膨胀,体积增大、形状趋向于不规则(h3-a),线粒体与内质网一些细胞器出现拥挤,类囊体片层或消失或变得模糊不清(h3-b),粗面内质网排列松散混乱(h3-c)。结果表明在高浓度蓝藻腐解液处理下,水生生物苦草及狐尾藻均表现出明显的细胞损伤形态学特征,即出现核碎裂,叶绿体贴壁沉积、线粒体、内质网松散、质体小球增多等病理变化。
[0086]
根据图7~10可知,对苦草与狐尾藻的两类(蓝藻&腐解液)实验的空白组、高浓度实验组、有半透膜实验组分别进行三元相分析,比较不同三元相图中优势种的相对含量及占比发现,半透膜对新鲜蓝藻的影响强于对腐解液的影响;半透膜改变了一些微生物的相对丰度。
[0087]
综上所述,本发明的有益效果为:
[0088]
通过本发明的评估方法评估蓝藻水华对水生植物苦草与狐尾藻的生物效应的影响,具体进行了水生植物的生物量、细胞通透性、应激指标与抗逆性、组织细胞结构以及水生植物表层附着微生物变化与多样性分析,为我国蓝藻水华灾害的生态安全阈值指标体系完善提供了评估方法与理论支撑。
[0089]
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人
员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1