一种镀金免疫磁微球修饰方法及其在免疫分析中的应用
1.本发明属于医学诊断技术领域,具体涉及一种镀金免疫磁微球修饰方法及其在免疫分析中的应用。
背景技术:
2.电化学发光是由电化学反应引起的发光过程,因此不受光漂白和自荧光的影响。由于其背景低、灵敏度高、响应速度快、时空可控等特点,电化学发光在从基础研究到商业临床和生物学应用的多个领域内成为一种多功能和强大的分析技术。
3.目前已经实现商业化的电化学发光方法包括罗氏(roche)诊断和meso scale discovery(msd)。其中罗氏诊断是将发光分子通过免疫夹心反应标记在磁微球的表面,实现对疾病标志物的检测。受低氧化电位路径的电化学发光原理的限制,该方法存在的问题是:(1)采用的磁微珠是不导电的,电化学发光效率低;(2)采用的设备是电子倍增管,收集的是所有磁珠的ecl,造成一次只能检测一种标志物,检测通量低。(3)采用的磁微珠粒径多为~2.8 μm,不利于使用电化学发光成像的方法进行免疫分析。
4.因此,突破低氧化电位路径的电化学发光原理限制、开发一种高发光效率的电化学免疫分析方法具有重要的意义。
技术实现要素:
5.为解决上述问题,本发明公开了一种镀金免疫磁微球修饰方法及其在免疫分析中的应用,突破了低氧化电位路径的电化学发光原理的限制;相较于不导电的磁微珠,基于导电的镀金免疫磁微球的电化学发光光强提高了近20倍,显著地提高了电化学发光效率;结合电化学发光成像技术,实现了基于粒径分辨的多重免疫分析方法;相较于罗氏诊断,该方法提高了检测通量。
6.为达到上述目的,本发明的技术方案如下:一种基于导电的镀金免疫磁微球修饰方法,具体步骤如下:(1)将镀金磁微球用等离子体清洗,然后浸泡于3-巯基丙酸的乙醇溶液中,并于4 ℃条件下静置18 h,最后经过超声分散后收集并洗涤得到羧基功能化的镀金磁微球;(2)将步骤(1)中得到的羧基功能化的镀金磁微球用去离子水和吗啉乙磺酸缓冲液洗涤,然后与羧基活化剂在室温条件下孵育30 min,经磁分离与洗涤后,得到活化的羧基功能化的镀金磁微球;(3)将步骤(2)中得到的活化的羧基功能化的镀金磁微球与捕获抗体在37 ℃条件下孵育3 h,经过磁分离、洗涤后与6-巯基-1-己醇在37 ℃条件下孵育1 h,最后经过磁分离后洗涤得到捕获抗体修饰的镀金磁微球;(4)将步骤(3)中得到的捕获抗体修饰的镀金磁微球与抗原及生物素标记的检测抗体在37 ℃条件下孵育30 min,经过磁分离、洗涤后与发光分子ru(bpy)
32+
标记的链霉亲和素在37 ℃条件下孵育10 min,最后经过磁分离后洗涤得到ru(bpy)
32+
标记镀金磁微球。
7.作为本发明的一种改进,所述步骤(1)中等离子体清洗的条件为空气气氛,清洗时间为3 min。
8.作为本发明的一种改进,所述步骤(1)中3-巯基丙酸的乙醇溶液浓度为1 mm。
9.作为本发明的一种改进,所述步骤(2)中羧基活化剂为含有10 mg/ml的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和10 mg/ml的n-羟基硫代琥珀酰亚胺钠盐的吗啉乙磺酸缓冲液。
10.作为本发明的一种改进,所述步骤(3)中6-巯基-1-己醇的浓度为1 mm。
11.本发明还提供了一种由上述方法制得的基于导电的镀金免疫磁微球。
12.本发明还有一个目的是提供上述方法制备的基于导电的镀金免疫磁微球在电化学发光免疫分析中的应用。
13.作为本发明的一种改进,所述基于导电的镀金免疫磁微球作为电化学发光免疫分析的载体在提升电化学发光效率中的应用。
14.本发明的有益效果为:1. 本发明的基于导电的镀金免疫磁微球突破了低氧化电位路径的电化学发光原理的限制,相较于罗氏诊断中使用的磁珠,镀金磁微球的电化学发光强度提高了近20倍,显著地提高了电化学发光效率。
15.2. 由于突破了低氧化电位路径的电化学发光原理的限制,建立了基于粒径分辨的电化学发光多重免疫分析方法,提高了检测通量。
附图说明
16.图1为本发明的基于镀金磁微球与非导电磁珠免疫分析的电化学发光成像图。
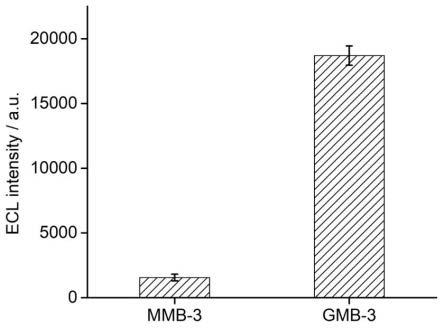
17.图2为本发明的基于镀金磁微球与非导电磁珠免疫分析的电化学发光强度统计图。
18.图3为本发明的基于镀金磁微球的粒径分辨多重免疫分析的电化学发光成像图。
具体实施方式
19.下面结合附图和具体实施方式,进一步阐明本发明,应理解下述具体实施方式仅用于说明本发明而不用于限制本发明的范围。
20.实施例1:基于导电的镀金免疫磁微球的制备(1)将镀金磁微球用等离子体清洗,然后浸泡于浓度为1 mm的3-巯基丙酸的乙醇溶液中,并于4 ℃条件下静置18 h,最后经过超声分散后收集并洗涤得到羧基功能化的镀金磁微球,优选的,等离子体清洗的条件为空气气氛,清洗时间为3min;(2)将步骤(1)中得到的羧基功能化的镀金磁微球用去离子水和吗啉乙磺酸缓冲液洗涤,然后与羧基活化剂在室温条件下孵育30 min,经磁分离与洗涤后,得到活化的羧基功能化的镀金磁微球,优选的,羧基活化剂为含有10 mg/ml的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和10 mg/ml的n-羟基硫代琥珀酰亚胺钠盐的吗啉乙磺酸缓冲液;(3)将步骤(2)中得到的活化的羧基功能化的镀金磁微球与捕获抗体在37 ℃条件下孵育3 h,经过磁分离、洗涤后与浓度为1 mm的6-巯基-1-己醇在37 ℃条件下孵育1 h,最后经过磁分离后洗涤得到捕获抗体修饰的镀金磁微球;
(4)将步骤(3)中得到的捕获抗体修饰的镀金磁微球与抗原及生物素标记的检测抗体在37 ℃条件下孵育30 min,经过磁分离、洗涤后与发光分子ru(bpy)
32+
标记的链霉亲和素在37 ℃条件下孵育10 min,最后经过磁分离后洗涤得到ru(bpy)
32+
标记镀金磁微球。
21.实施例2:ru(bpy)
32+
标记的镀金磁微球的电化学发光成像测试:通过免疫夹心反应将发光分子ru(bpy)
32+
分别标记在镀金磁微球(ru@gmb)和非导电磁珠(ru@mmb)表面,并分散于磷酸盐缓冲液(pbs,ph 7.4)。取5 μl分散液滴于玻碳电极表面。在自制的电解池中加入含100 mm 三正丙胺(tpra)的0.1 m pbs(ph 7.4),施加电位为1.3 v vs ag/agcl,同时采用配备电子倍增电荷耦合器件(emccd,品牌andor,型号ixon ultra 897)的正置显微镜 (品牌nikon,型号eclipse ni-u)进行电化学发光图像采集。如图1所示,在ru@gmb上观察到了明显的电化学发光。如图2所示,通过对光强的统计,表明ru@gmb组的光强是ru@mmb组的~12倍。
22.通过icp-oes(品牌agilent,型号icpoes730)测试对单个微球表面的ru(bpy)
32+
含量进行分析,如表1所示,结果表明ru@mmb表面ru(bpy)
32+
含量约是ru@gmb表面的2倍,因此镀金磁微球将电化学发光的光强提高了近20倍,显著地提高了电化学发光效率。
23.表1 单个镀金磁微球与非导电磁珠表面负载发光分子ru(bpy)
32+
的含量。beadsn
beads
[ru]/(μg/l)n
ru
gmb-37.79e+06947.10e+07mmb-37.78e+061881.43e+08
[0024]
其中:n
beads
为样品中微球的数量,[ru]为微球表面负载的ru(bpy)
32+
的总含量,n
ru
为单个微球表面负载的ru(bpy)
32+
的数量。
[0025]
实施例3:基于导电的镀金免疫磁微球的粒径分辨多重免疫分析电化学发光成像测试:采用3、5、8、11 μm的镀金磁微球分别对心肌肌钙蛋白i(ctni)、脂肪酸结合蛋白(fabp)、c-反应蛋白(crp)、肌红蛋白(myo)四种心肌梗死标志物进行检测。将捕获抗体修饰的镀金磁微球放入含有ctni(2.0 ng/ml)、fabp(6 ng/ml)、crp(10 ng/ml)和myo(50 ng/ml)及对应的生物素标记的检测抗体混合溶液孵育30 min,用pbs洗涤3次后再与ru(bpy)
32+
标记的链霉亲和素孵育10 min。将产物用pbs洗涤3次并分散在pbs中。采用实施例2中的电化学发光成像测试方法进行图像采集。如图3所示,该成像方法可以一次捕捉到4种粒径的镀金磁微球从而实现靶标种类的定性分析;同时从电化学发光图中也可以清晰的看到四种粒径的镀金磁微球的发光图像。
[0026]
需要说明的是,上述仅仅是本发明的较佳实施例,并非用来限定本发明的保护范围,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,在上述实施例的基础上还可以做出若干改进和润饰,这些改进和润饰均落入本发明权利要求书的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1