Cilp1作为肾纤维化生物标志物的应用
cilp1作为肾纤维化生物标志物的应用
技术领域
1.本发明涉及肾纤维化诊断治疗技术领域,具体涉及cilp1作为肾纤维化生物标志物的应用。
背景技术:
2.肾脏纤维化是各种病因所致慢性肾脏病(chronic kidney disease,ckd)进展过程中的主要共同病理环节,包括肾小球硬化和肾间质纤维化,其病理特征表现为肾脏固有细胞损伤、炎症细胞浸润、肌成纤维细胞和成纤维细胞的活化和增殖、细胞外基质(胶原纤维、纤连蛋白、层粘连蛋白)堆积、肾脏固有细胞丢失、肾小管萎缩塌陷和血管稀疏化,最终导致肾脏正常结构破坏。肾纤维化标志着不可逆性肾损伤,因此早期诊断肾纤维化和针对病因进行治疗是延缓ckd进展的关键。
3.目前,超声和核磁共振成像等影像学方法常用于评估患者肾脏纤维化,但是这些技术只能从宏观水平上诊断肾纤维化,无法敏锐捕捉肾纤维化炎症反应期的微观病变信息,而生物标志物既能评估或定量测量某种疾病的生物学和病理学进程,同时也可作为疾病的治疗靶点,生物标志物参与了疾病进程的各个环节,其水平随疾病进程的活动或进展程度发生变化,因此,明确肾纤维化的生物标志物,有助于早期准确诊断肾纤维化和靶向治疗。
4.刘秋玉等.肾纤维化诊断生物标志物研究进展[j].分子生物医学,2019.报道了包括肾损伤类标志物、炎症和促纤维化因子类标志物、微rnas类标志物和新型生物标志物,筛选出敏感性、特异性高的肾纤维化诊断标志物,有望取代经典肾脏病理诊断。
[0005]
软骨中间层蛋白1(cartilage intermediate layer protein 1,cilp1)是抑制心肌间质纤维化作用的细胞外基质蛋白,可为干预心肌纤维化进程提供新策略;文献报道,cilp1是转化生长因子(tgf)-β的拮抗剂,是一种参与心肌纤维化信号传导的细胞外基质(ecm)蛋白。cilp1 rna在左心室(lv)压力超负荷和左室心肌梗死的动物模型中表达上调,主动脉瓣狭窄或心肌梗死患者心肌组织中cilp1蛋白水平显着升高;cilp1作为rv和lv病理重塑的新型生物标志物的潜在作用,其与肺动脉高压环境中的rv适应不良和心室动脉解偶联相关,但是,现有技术还未报道cilp1与肾纤维化相关的研究。
技术实现要素:
[0006]
本发明的目的在于,提供cilp1作为肾纤维化生物标志物的应用,证实了cilp1与肾纤维化且显著呈正相关,cilp1可作为肾脏纤维化的无创诊断性生物标志物,具备高敏感性和高特异性。
[0007]
为实现上述技术目的,达到上述技术效果,本发明是通过以下技术方案实现:
[0008]
cilp1作为肾纤维化生物标志物的应用。
[0009]
进一步的,所述生物标志物cilp1相对于未发生肾纤维化的对象,肾纤维化对象肾组织、肾小管上皮细胞和患者血清中cilp1的相对表达水平上调。
[0010]
本发明cilp1作为肾纤维化生物标志物的应用,通过收集正常人及慢性肾脏病(1-5期)患者血清,elisa试剂盒检测cilp1在血清中的含量;
[0011]
慢性肾衰患者与健康人血清cilp1差异比较,慢性肾衰患者与健康人血清cilp1的elisa结果,慢性肾衰患者cilp1的血清浓度高于正常人;结果可以证实cilp1可以作为评价指标。
[0012]
本发明cilp1作为肾纤维化生物标志物的应用,通过对收集的符合标准的慢性肾脏病(1-5期)患者肾脏组织,进行masson染色检测肾脏纤维化程度,并通过免疫荧光技术检测cilp1在肾脏的表达情况,并以tgf-β1作为纤维化指标评估cilp1的预测情况;
[0013]
肾脏疾病患者肾脏组织的masson(马松染色),计算纤维化百分比,反应组织纤维化程度;对应患者cilp1的免疫荧光强度,进行相关性分析,相关系数r=0.3063;
[0014]
同时,肾脏疾病患者肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较,进一步验证了cilp1作为肾纤维化生物标志物。
[0015]
本发明cilp1作为肾纤维化生物标志物的应用,针对性的建立动物模型进行验证,通过uuo大鼠试验,包括:
[0016]
s1:构建假手术组、uuo试验组大鼠模型;
[0017]
具体包括:将大鼠适应性喂养一周后,给予两组大鼠腹腔注射5%水合氯醛麻醉,局部剃毛后常规消毒铺孔巾,沿腹正中线依次切开皮肤和肌肉,游离肾脏和输尿管,用组织钳托起左侧输尿管中段部位,假手术组常规缝合肌肉和皮肤,uuo组止血钳夹住输尿管,在两端用4-0号丝线分两次结扎左侧输尿管近肾盂段,剪断输尿管,然后常规缝合肌肉和皮肤;
[0018]
s2:21天后处死大鼠,收集肾脏组织标本,he、masson染色观察肾脏纤维化程度,通过免疫荧光技术检测cilp1在肾脏的表达情况,并以tgf-β1作为纤维化指标评估cilp1的预测情况;
[0019]
通过uuo大鼠肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较,免疫荧光结果表明cilp1荧光强度随纤维化程度增加而增加;
[0020]
放射性肾损伤小鼠试验,包括:
[0021]
s1:将c57小鼠30只,按体重分层随机数字表法,分为3组,每组10只,分为正常对照组、10gy放射剂量组和20gy放射剂量组。
[0022]
s2:将小鼠适应性喂养一周后,正常对照组小鼠正常不进行干预,放射组小鼠单次10gy放射剂量组(10gy)和20gy放射剂量组分别用电子线一次性照射小鼠腹腔,2个月后处死两组小鼠;
[0023]
s3:收集小鼠肾脏组织,he、masson染色观察肾脏纤维化程度,通过免疫荧光技术检测cilp1在肾脏的表达情况,并以tgf-β1作为纤维化指标评估cilp1的预测情况。
[0024]
首先,计算各个组小鼠肾脏组织的masson(马松染色),计算纤维化百分比,反应组织纤维化程度;对应小鼠肾脏组织表达cilp1的免疫荧光强度,进行相关性分析:
[0025]
二者有相关性,相关系数r=0.686;
[0026]
针对放射性肾损伤小鼠肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较,免疫荧光结果表明cilp1荧光强度随纤维化程度增加而增加;
[0027]
验证cilp1可以作为肾纤维化生物标志物的应用。
[0028]
本发明cilp1作为肾纤维化生物标志物的应用,肾小管上皮细胞系(hk-2)通过tgf-β1进行诱导纤维化(上皮间质转分化)造模,比较正常细胞组与诱导干预组中cilp1表达情况,用western blotting和qpcr技术进行检测。
[0029]
本发明的另一目的在于,提供cilp1作为肾纤维化生物标志物在诊断肾纤维化产品中的应用;
[0030]
所述诊断肾纤维化产品包括但不限于试剂、试剂盒。
[0031]
一种用于诊断肾纤维化的试剂盒,所述试剂盒包含检测肾组织、肾小管上皮细胞和患者血清中cilp1的相对表达水平上调的试剂。
[0032]
本发明的另一目的在于,提供cilp1在预测肾脏纤维化及其严重程度中的应用。
[0033]
本发明的有益效果:
[0034]
本发明提供cilp1作为肾纤维化生物标志物的应用,本发明证实了cilp1与肾纤维化且显著呈正相关,cilp1可作为肾脏纤维化的无创诊断性生物标志物,具备高敏感性和高特异性;
[0035]
提供cilp1作为肾纤维化生物标志物在诊断肾纤维化产品中的应用,通过检测肾组织、肾小管上皮细胞和患者血清中cilp1的相对表达水平,为肾纤维化早期诊断提供依据。
[0036]
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有优点。
附图说明
[0037]
图1为本发明实施例1所述慢性肾衰患者组与健康人群组血清cilp1的elisa结果;
[0038]
图2为本发明实施例2所述肾脏疾病患者肾脏组织中masson的面积百分比(%)与cilp1免疫荧光强度相关性分析;
[0039]
图3为本发明实施例2所述肾脏疾病患者肾脏组织中masson的面积(%)与cilp1免疫荧光强度结果;
[0040]
图4为本发明实施例3所述uuo大鼠肾脏组织中masson的面积(%)与cilp1免疫荧光强度结果;
[0041]
图5为本发明实施例4所述放射性肾损伤小鼠肾脏组织中masson的面积(%)与cilp1免疫荧光强度结果;
[0042]
图6为本发明实施例4所述放射性肾损伤小鼠肾脏组织中masson的面积百分比(%)与cilp1免疫荧光强度相关性分析;
[0043]
图7为本发明实施例4所述hk-2细胞中clip1蛋白的western blotting结果;
[0044]
图8为本发明实施例4所述hk-2细胞中clip1基因表达的qpcr结果;
具体实施方式
[0045]
为了更清楚地说明本发明实施例的技术方案,下面将结合附图对实施例对本发明进行详细说明。
[0046]
实施例1
[0047]
临床试验数据分析
[0048]
收集正常人及慢性肾脏病(1-5期)患者血清,elisa试剂盒检测cilp1在血清中的
含量;通过收集正常人及慢性肾脏病(1-5期)患者血清各20例,通过elisa试剂盒检测cilp1在血清中的含量,结果如图1所示:
[0049]
图1中,横坐标为分组信息(健康人群组与慢性肾衰患者组);纵坐标为cilp1的血清浓度;两组间clip1含量有差异。
[0050]
慢性肾衰患者组与健康人群组的血清中cilp1差异比较,慢性肾衰患者与健康人血清cilp1的elisa结果显示慢性肾衰患者cilp1的血清浓度高于正常人;结果可以证实cilp1可以作为评价指标。
[0051]
实施例2
[0052]
本实施例选择符合标准的12例肾脏疾病患者;
[0053]
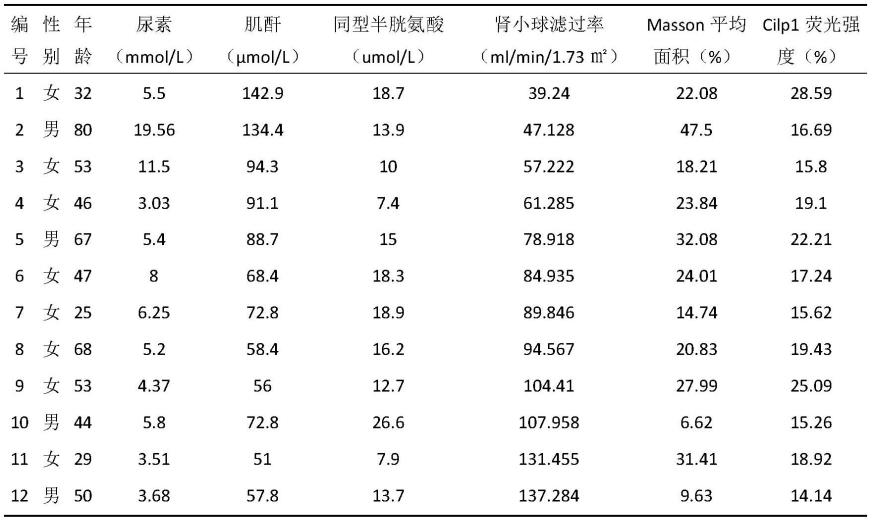
通过对收集的符合标准的慢性肾脏病(1-5期)患者肾脏组织,进行masson染色检测肾脏纤维化程度,并通过免疫荧光技术检测cilp1在肾脏的表达情况,并以tgf-β1作为纤维化指标评估cilp1的预测情况,并且与临床指标(血肌酐、血尿素氮等指标)相结合阐述;
[0054]
收集肾脏疾病患者数据情况如下表:
[0055]
表1肾脏疾病患者数据情况
[0056][0057]
如图2所示,肾脏疾病患者肾脏组织的masson(马松染色),计算纤维化百分比,反应组织纤维化程度;对应患者cilp1的免疫荧光强度,进行相关性分析,相关系数r=0.3063;
[0058]
如图3所示,选取编号为2、6、12的上述患者,肾脏疾病患者肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较;
[0059]
从图3的左侧视图中可以看出,三个患者的masson染色结果表示纤维化程度依次递增(从上到下依次为编号2、6、12的上述患者);
[0060]
从图3的右侧视图中可以看出,免疫荧光结果表明cilp1荧光强度随纤维化程度增加而增加,右侧视图中dapi:细胞核;cilp1:绿色;tgf-β1:红色;merge:cilp1与tgf-β1重叠展示(从上到下依次为编号2、6、12的上述患者);
[0061]
基于肾脏疾病患者肾脏组织中masson的面积百分比(%)与cilp1免疫荧光强度相
关性分析,以及肾脏疾病患者肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较,可以看出,进一步验证了cilp1作为肾纤维化生物标志物。
[0062]
实施例3
[0063]
uuo大鼠试验
[0064]
s1:构建假手术组、uuo试验组大鼠模型;
[0065]
具体包括:将大鼠适应性喂养一周后,给予两组大鼠腹腔注射5%水合氯醛麻醉,局部剃毛后常规消毒铺孔巾,沿腹正中线依次切开皮肤和肌肉,游离肾脏和输尿管,用组织钳托起左侧输尿管中段部位,假手术组常规缝合肌肉和皮肤,uuo组止血钳夹住输尿管,在两端用4-0号丝线分两次结扎左侧输尿管近肾盂段,剪断输尿管,然后常规缝合肌肉和皮肤;
[0066]
s2:21天后处死大鼠,收集肾脏组织标本,he、masson染色观察肾脏纤维化程度,通过免疫荧光技术检测cilp1在肾脏的表达情况,并以tgf-β1作为纤维化指标评估cilp1的预测情况;
[0067]
如图4所示,uuo大鼠肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较:从图4可以看出,正常对照组(control)、uuo模型组(uuo)的肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较,免疫荧光结果表明cilp1荧光强度随纤维化程度增加而增加。(dapi:细胞核;cilp1:绿色;tgf-β1:红色;merge:cilp1与tgf-β1重叠展示。
[0068]
图4中,control为正常组,uuo为模型组,依次对应上下内容,同时进行dapi:细胞核;cilp1:绿色;tgf-β1:红色;merge:cilp1与tgf-β1共染对比,结果也证实了免疫荧光结果表明cilp1荧光强度随纤维化程度增加而增加;
[0069]
验证了cilp1作为肾纤维化生物标志物的应用。
[0070]
实施例4
[0071]
放射性肾损伤小鼠试验
[0072]
s1:将c57小鼠30只,按体重分层随机数字表法,分为3组,每组10只,分为正常对照组、10gy放射剂量组和20gy放射剂量组。
[0073]
s2:将小鼠适应性喂养一周后,正常对照组小鼠正常不进行干预,放射组小鼠单次10gy放射剂量组(10gy)和20gy放射剂量组分别用电子线一次性照射小鼠腹腔,2个月后处死两组小鼠;
[0074]
s3:收集小鼠肾脏组织,he、masson染色观察肾脏纤维化程度,通过免疫荧光技术检测cilp1在肾脏的表达情况,并以tgf-β1作为纤维化指标评估cilp1的预测情况。
[0075]
首先,计算各个组小鼠肾脏组织的masson(马松染色),计算纤维化百分比,反应组织纤维化程度;对应小鼠肾脏组织表达cilp1的免疫荧光强度,进行相关性分析:
[0076]
如图5所示,二者有相关性,相关系数r=0.686;
[0077]
针对放射性肾损伤小鼠肾脏组织中masson的面积(%)与cilp1免疫荧光强度比较,如图6所示:
[0078]
放射性肾损伤小鼠分为正常对照组(control)、10gy放射剂量组(10gy)、20gy放射剂量组(20gy);
[0079]
通过dapi:细胞核;cilp1:绿色;tgf-β1:红色;merge:cilp1与tgf-β1共染实验,从上之下依次为正常组、10gy放射剂量组(10gy)、20gy放射剂量组(20gy),通过结果可以得
出,放射剂量的相关性,同时免疫荧光结果表明cilp1荧光强度随纤维化程度增加而增加;
[0080]
验证了cilp1作为肾纤维化生物标志物的应用。
[0081]
实施例5
[0082]
肾小管上皮细胞系(hk-2)通过tgf-β1进行诱导纤维化(上皮间质转分化)造模,比较正常细胞组与诱导干预组中cilp1蛋白表达情况,用western blotting和qpcr技术进行检测;
[0083]
如图7所示,hk-2细胞western blotting结果:
[0084]
第4-5代hk-2(肾小管上皮细胞)分为两组,对照组及tgf-β1诱导组,对照组不做处理,tgfβ组以2ng/ml、5ng/ml、10ng/ml、20ng/ml的tgf-β1细胞因子诱导24h,计算两组cilp1的蛋白表达量;
[0085]
与正常对照组相比,随着tgf-β1浓度的升高,cilp1的表达量逐渐增加;
[0086]
如图8所示,hk-2细胞qpcr结果:
[0087]
第4-5代hk-2(肾小管上皮细胞)分为两组,对照组及tgfβ1诱导组,对照组不做处理,tgf-β1组以10ng/ml的tgf-β1细胞因子诱导24h,计算两组cilp1的mrna表达量;
[0088]
与正常对照组相比,cilp1的的mrna表达量较正常升高,两组cilp1的mrna表达量有差异,且有统计学意义(p≤0.05)。
[0089]
本发明提供cilp1作为肾纤维化生物标志物的应用,本发明证实了cilp1与肾纤维化且显著呈正相关,cilp1可作为肾脏纤维化的无创诊断性生物标志物,具备高敏感性和高特异性;
[0090]
提供cilp1作为肾纤维化生物标志物在诊断肾纤维化产品中的应用,通过检测肾组织、肾小管上皮细胞和患者血清中cilp1的相对表达水平,为肾纤维化早期诊断提供依据。
[0091]
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1