瑞氏-姬姆萨复合染色液及其制备方法和用途
1.本发明涉及医疗检测技术领域,特别涉及一种瑞氏-姬姆萨复合染色液及其制备方法和用途。
背景技术:
2.外周血涂片形态学检查是血常规检查的主要内容之一,人工显微镜检查乃是血细胞形态学检查的金标准,但由于各种原因导致临床检验人员该检验技能薄弱。血涂片染色是血细胞形态学检查中一个非常重要的环节,染色好坏直接影响结果的判断。随着血细胞分析仪流水线的引进,血涂片染色也逐步向自动化迈进,但手工染色仍是目前各级医院的主要手段。
3.血涂片的染色有多种方法,目前国际标准化委员会(icsh)推荐使用的标准染色为罗曼诺夫斯基(romanowsky)染色,但由于该染色的染料价格高而难以普及,我国多采用以罗氏染色演变过来的瑞氏(wright)染色法、瑞特-姬姆萨(wright-giemsa)染色法,另外还有一些快速的染色方法主要用于急诊。目前,许多医院进行分步染色,即先使用染液染色,再使用缓冲液调整ph值,导致血涂片ph不稳定、染色操作繁琐、染色时间长、血涂片染色质量不稳定,因此,亟需一种能够成分可标准化控制的染色液,也需要一种简单、快速且染色效果稳定的血涂片染色方法。
技术实现要素:
4.本发明为了解决上述技术问题,提供瑞氏-姬姆萨复合染色液及其制备方法和用途。
5.第一方面,本发明提供一种瑞氏-姬姆萨复合染色液,是采用以下技术方案得以实现的。
6.一种瑞氏-姬姆萨复合染色液,其特征在于,包括以下重量份的组分:
[0007][0008][0009]
所述瑞氏-姬姆萨复合染色液的ph为6.5-6.7。
[0010]
优选的,一种瑞氏-姬姆萨复合染色液,包括以下重量份的组分:
[0011][0012]
第二方面,本发明提供一种瑞氏-姬姆萨复合染色液的制备方法,是采用以下技术方案得以实现的。
[0013]
一种上述瑞氏-姬姆萨复合染色液的制备方法,包括下步骤:
[0014]
s1.称取瑞氏染料、姬姆萨染料、天青ⅱ、甘油,溶于甲醇中,再加入聚乙烯吡咯烷酮,使其全部溶解,得到溶液a;
[0015]
s2.称取无水磷酸二氢钾和无水磷酸氢二钠,溶于蒸馏水中,得到溶液b;
[0016]
s3.将步骤s1所得溶液a与步骤s2所得溶液b混合,配置得到的瑞氏-姬姆萨复合染色液。
[0017]
第三方面,本发明提供一种瑞氏-姬姆萨复合染色液的用于一步快速细胞染色的用途,是采用以下技术方案得以实现的。
[0018]
一种瑞氏-姬姆萨复合染色液的用于一步快速细胞染色的用途,其特征在于:包括下步骤:
[0019]
s1.制血膜,水平放置至血涂片晾干;
[0020]
s2.采用甲醇固定血涂片3-5秒后,弃去多余液体;
[0021]
s3.滴加权利要求1或2所述的瑞氏-姬姆萨复合染色液,染色2-3分钟;
[0022]
s4.用清水冲洗染色后的血涂片,干燥后镜检。
[0023]
综上所述,相比于现有技术,本技术具有以下技术效果。
[0024]
1.本技术将染液和磷酸盐缓冲液按一定比例混合后,复合染液成分和ph稳定,具有较好的均一性和稳定性,保证了细胞着色的均匀度,有效保障了染液的质量控制,且能够长期、反复使用;
[0025]
2.本技术的瑞氏-姬姆萨复合染色液ph控制在6.5-6.7,由于控制了特定的稳定的ph,细胞染色效果大大提升;
[0026]
3.本技术先配置复合染液,再进行一步染色,有效的提升了操作流程的标准化程度,便于建立新的质控标准,防止分步染色时人为原因造成的系统的误差;
[0027]
4.本技术单纯采用甲醇对血涂片进行固定,改变了多年来采用瑞氏染液或瑞姬染液作为a液来固定血涂片的传统染色模式,既节约成本也缩短了固定时间,大大提高了染色
效率;
[0028]
5.本技术的瑞氏-姬姆萨复合染色液的用于一步快速细胞染色的用途可在3分钟内完成,极大地提高临床效率;
[0029]
6.本技术瑞氏-姬姆萨复合染色液中染液浓度较低,将其用于血细胞分析仪中,可有效防止管道堵塞情,并且,甲醇可回收再利用于冲洗管道喷头,降低了使用成本。
[0030]
上述各项改进综合作用,共同发挥作用,取得了预料不到的技术效果,这是单独采用某一技术手段所无法获得,也无法预期的。
附图说明
[0031]
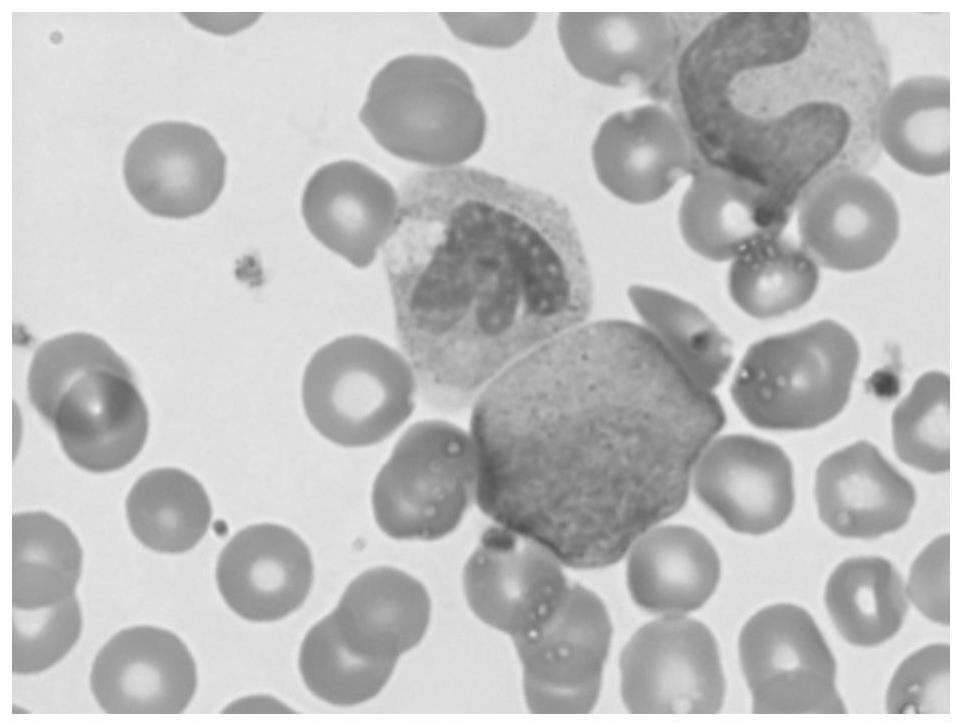
图1是本发明染液进行染色的中性细胞的染色效果图,可见清楚的特异性颗粒的染色效果;
[0032]
图2是本发明染液进行染色的幼稚粒系细胞的染色效果图;
[0033]
图3是本发明染液进行染色的嗜酸性粒细胞的染色效果图;
[0034]
图4是本发明染液进行染色的淋巴细胞及中性分叶粒细胞的染色效果图;
[0035]
图5是本发明染液进行染色的嗜碱性粒细胞的染色效果图;
[0036]
图6是本发明染液进行染色的嗜酸性粒细胞及血小板的染色效果图;
[0037]
图7是本发明染液进行染色的白血病患者的幼稚细胞的染色效果图,可见明显的核仁及特异性颗粒的染色效果;
[0038]
图8是本发明染液进行染色的慢粒患者各阶段幼稚粒细胞及血小板的染色效果图;
[0039]
图9是本发明染液进行染色的中性粒细胞及血小板的染色效果图;
[0040]
图10是本发明染液进行染色的幼稚粒细胞的各阶段细胞的染色效果图,可见幼稚粒细胞特有细胞结构内的奥氏小体(auer小体)染色效果;
[0041]
图11是本发明染液进行染色的可见中性粒细胞内的特异性中毒颗粒的染色效果图;
[0042]
图12是本发明染液进行染色的中性粒细胞、均一染色的红细胞及散在的血小板的染色效果图;
[0043]
图13是本发明染液进行染色的中性粒细胞及有核红细胞的染色效果图;
[0044]
图14是本发明染液进行染色的嗜碱性粒细胞及嗜酸性粒细胞的染色效果图;
[0045]
图15是本发明染液进行染色的白血病患者的原始细胞的染色效果图;
[0046]
图16是本发明染液进行染色的异常早幼粒细胞含有明显的特异性颗粒及奥氏小体(auer小体)的染色效果图;
[0047]
图17是本发明染液进行染色的急性早幼粒白血病患者的异常早幼粒细胞(在我院门急诊中必须报的危急值,处理及时可挽救患者生命的重要指标)的染色效果图;
[0048]
图18是本发明染液进行染色的成熟单核细胞的染色效果图;
[0049]
图19是本发明二次使用过的染液进行染色的幼稚单核细胞及异常淋巴细胞的染色效果图;
[0050]
图20是本发明二次使用过的染液进行染色的均一的红细胞及过分叶的中性粒细胞的染色效果图;
[0051]
图21是普通快速染液进行染色的淋巴细胞及血小板的效果图;
[0052]
图22是普通快速染液进行染色略深的淋巴细胞及血小板的效果图;
[0053]
图23是普通快速染液配比不当深染的淋巴细胞(不好观察血细胞胞浆和内部细胞结构)及中性分叶细胞的效果图;
[0054]
图24是普通快速染液进行染色时淋巴细胞及未溶于染液的沉渣覆盖在血细胞表面的效果图;
[0055]
图25是骨髓染液进行染色的原始细胞、幼稚单核细胞的效果图;
[0056]
图26是骨髓染液进行染色的幼稚单核细胞的效果图,可见白细胞染色尚可,而红细胞出现淡染;
[0057]
图27是骨髓染液进行染色的嗜酸性粒细胞的效果图,其特异性颗粒不明显,血小板染色清晰;
[0058]
图28是骨髓染液配比不当进行染色清晰的中性杆状粒细胞及淡染的红细胞造成染色不均一的效果图。
[0059]
图29是未进行甲醇固定进行染色中性杆状粒细胞及被破坏的红细胞造成染色不均一的效果图
具体实施方式
[0060]
下面结合附图和实施例对本发明进行进一步的说明。
[0061]
实施例1
[0062]
瑞氏-姬姆萨复合染色液的制备方法,包括以下步骤:
[0063]
s1.称取瑞氏染料2.5g、吉姆萨染料0.6g、天青ⅱ0.6g;25ml甘油溶于500ml甲醇;再加入10g聚乙烯吡咯烷酮使其全部溶解;
[0064]
s2.称取无水磷酸二氢钾6.64g和无水磷酸氢二钠0.25g加蒸馏水至1000ml;
[0065]
s3.将步骤s1所得溶液与步骤s2所得溶液进行混合,配置得到ph在6.53的瑞氏-姬姆萨复合染色液,配置后3周内可室温避光保存。
[0066]
一步血细胞染色方法,包括以下步骤:
[0067]
s1.采血、制血膜、水平放置血涂片晾干;
[0068]
s2.采用200ul甲醇固定血涂片5秒钟后弃去多余液体;
[0069]
s3.滴加1500-2000ul上述瑞氏-姬姆萨复合染色液,染色3分钟;
[0070]
s4.用清水冲洗染色后的血涂片,干燥后镜检。
[0071]
对比例1
[0072]
普通快速染液(购自珠海贝索生物技术有限公司瑞氏-吉姆萨染色液)
[0073]
染色步骤:
[0074]
1.滴加瑞氏吉姆萨a液(约0.5ml-0.8ml)涂片上,并让染液覆盖整个标本染色1min;
[0075]
2.再将瑞氏吉姆萨b液加于a液上面(滴加量为a液的2-3倍),用洗耳球吹出微风使液面产生涟漪状,使两液充分混合,染色3-10min(染血片时间可略短,染骨髓片时间应视细胞量多少而异);
[0076]
3.水洗(应以流水冲去,以防有沉渣沉淀在标本上),干燥、镜检。
[0077]
对比例2
[0078]
骨髓染液(购自濮阳鑫彩生物科技有限公司瑞氏染色液)
[0079]
染色步骤:
[0080]
1.滴加瑞氏染液一毫升于涂片上,并让染液覆盖整个标本涂片,染色1-2分钟;
[0081]
2.将等量的磷酸盐缓冲液滴加于瑞氏染液上面,用洗耳球使两液充分混合,染色1小时;
[0082]
3.水洗,冲洗时不能先倒掉染色液,可缓慢从玻片一端冲洗,以防有沉渣沉淀在标本上;
[0083]
4.干燥、镜检。
[0084]
对比例3
[0085]
一步血细胞染色方法,包括以下步骤
[0086]
s1.采用不加甲醇固定血涂片,直接滴加1500-2000ul实施例1中制备的瑞氏-姬姆萨复合染色液,染色3分钟;
[0087]
s2.用清水冲洗染色后的血涂片,
[0088][0089]
s3.干燥后镜检。
[0090]
对比例4
[0091]
不同ph值的实验对比下表
[0092]
一步血细胞染色方法,包括以下步骤:
[0093]
s1.采血、制血膜、水平放置血涂片晾干;
[0094]
s2.采用200ul甲醇固定血涂片5秒钟后弃去多余液体;
[0095]
s3.滴加1500-2000ul实施例1中制备的瑞氏-姬姆萨复合染色液,染色3分钟;
[0096]
s4.用清水冲洗染色后的血涂片,干燥后镜检。
[0097]
ph值6.376.536.756.93白细胞染色时间3分钟3分钟3分钟3分钟染色效果-+
‑‑
[0098]
表中(-)表示不佳;(+)表示最佳
[0099]
对比例5
[0100]
普通快速血细胞染色方法,包括以下步骤
[0101]
1.采用200ul甲醇固定血涂片5秒钟后弃去多余液体滴加甲醇
[0102]
2.滴加实施例1中制备的溶液a(约0.5ml-0.8ml)涂片上,并让染液覆盖整个标本染色1min;
[0103]
3.再将实施例1中制备的溶液b滴加于溶液a上面(滴加量为a液的2-3倍),用洗耳球吹出微风使液面产生涟漪状,使两液充分混合,染色3-10min(染血片时间可略短,染骨髓片时间应视细胞量多少而异);
[0104]
4.水洗(应以流水冲去,以防有沉渣沉淀在标本上),干燥、镜检。
[0105]
性能检测
[0106]
采用实施例1和对比例1-5的染液对血涂片进行染色,实验结果参见图1-29。
[0107]
对比例1和对比例2中,将本发明一步法染液对比普通快速染液及骨髓染液,将患
者白细胞数量按高中低分组进行染色,采用普通快速染液进行染色,可以看出染色深浅不一,特别是白细胞里的特异性颗粒染色不理想,有时候还会有沉杂产生见图24。采用骨髓染液进行染色,存在染色时间比较长,红细胞着色不均一等问题,且染液昂贵。
[0108]
对比例3的染色方法中只加了复合染液,可以看出染色后血片上的细胞均被溶解,无法观察细胞形态,因此甲醇固定的环节不能省略;
[0109]
对比例4中将不同ph的染色效果进行了对比,可见,ph为6.53时,染色时间在3分钟内为最佳的,染色可在3分钟内完成;其他比例ph值的在同等时间内的效果均出现了染色过深及过浅的现象。
[0110]
对比例5相对于实施例1,用普通快速溶液a液和溶液b分别染色,虽然染色结果尚可,但可以看出,工艺顺序的改变,导致无法精准控制两种溶液的添加比例,极易导致染色亮度降低。
[0111]
综上,快速染液配比不当深染的可能性大而骨髓染液出现浅染的机率较大。而本技术最大的亮点是在血涂片染色中,首次单纯采用甲醇固定,改变了用a液固定的传统方法,既节约成本,也可以快速固定,可以大大提高固定效率,且改变多年来瑞士、瑞姬染液应用ab液两步法模式,将其混合一步到位。一步染色将a和b液按一定比例混合能够长期、反复使用,这样能够保证细胞着色均匀、稳定,有效的保障染液的质量控制。本技术通过大量试验发现染液ph值在6.53左右着色效果最好,把染液的ph值控制在6.5-6.7为宜,染液具有较好的均一性和稳定性,提供了有效的质量保证,更加方便推广使用。
[0112]
本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1