一种测定糖化血红蛋白百分比的试剂及其检测方法与流程
1.本发明涉及一种测定糖化血红蛋白百分比的试剂及其检测方法。
背景技术:
2.糖尿病由于其高发病率和相关并发症,被认为是一个严重的公共卫生问题。全球有4.22亿成年人患有糖尿病,预计到2040年,这一数字将上升到6.4亿。在过去的30年里,2型糖尿病的增加主要介导了这一流行病,对个人和全球都有相当大的影响。糖尿病患者的心血管疾病相关死亡风险是同龄正常血糖患者的两到十倍;而且在全因死亡、心血管并发症(如冠心病、心力衰竭、中风和外周动脉疾病)和微血管并发症(包括视网膜病变、神经病变和肾病)、等方面,糖尿病患者的风险也明显更高。
3.糖化血红蛋白(ghb)是红细胞中的血红蛋白与血清中的糖类(主要指葡萄糖)通过非酶反应相结合的产物。形成糖化血红蛋白的非酶反应具有持续、缓慢、不可逆的特点,因此糖化血红蛋白的含量是由过去的而非即时的血糖浓度决定的,与检测前是否空腹、是否注射胰岛素、是否服用降糖药物等因素无关。通常认为,糖化血红蛋白浓度可有效地反映过去8-12周平均血糖水平。健康成人血液中有三种血红蛋白:hba、hbf和hba0。ghb由hba1a、hba1b、hba1c等组成,其中hba1c占约70%,且结构较为稳定,临床上常用作糖尿病控制的监测指标,其浓度用占成人血红蛋白的百分比表示。hba0则是血液中的主要成分,占比80-90%。hbf则是主要的干扰组分。
4.糖化血红蛋白水平可作为糖尿病的诊断检测手段。中国2型糖尿病防治指南(2020年版)将“糖化血红蛋白”首次正式纳入到糖尿病诊断标准中,糖化血红蛋白≥6.5%可作为确诊糖尿病的依据。但低于6.5%的结果并不能排除糖尿病的可能性,还应该参考葡萄糖测定的结果。若糖化血红蛋白》9.0%,说明患者持续存在高血糖。
5.目前测试hba1c的检测方法主要包括电泳法、免疫法、亲和层析法、色谱法、酶法等。其中电泳法需要特定的仪器设备,价格昂贵,不适用于中小型医院的使用;免疫法虽成本较低,仪器易于操作,但存在精密度低,检测结果单一的缺点;亲和层析法操作简单、快速,但误差大,检测结果准确性低,且其测定的是ghb的总量;酶法利用氧化还原反应检测糖化血红蛋白,需要多种酶的参与。色谱法包括高效液相阳离子交换色谱法和高效液相硼酸亲和色谱法等。作为目前hba1c检测的金标法,高效液相离子层析法具有精密度高、操作简单、重复性好的特点,在临床上使用频率最高,而且准确度高,但是目前检测血液样本中糖化血红蛋白组分的比例时,很多hplc检测试剂并不能将各个组分有效分离,从而影响hba1c的检测结果。
6.综上所述的几种方法,要么仪器成本高、准确度低,要么测定的是ghb的总量,要么hplc检测试剂不能将各个组分有效分离,因此,需要对现有的测定糖化血红蛋白比例的试剂和方法进行改进,提供一种新的试剂及其检测方法来解决这些问题。
技术实现要素:
7.为了克服现有技术中存在的缺点和不足,本发明的目的在于提供一种测定糖化血红蛋白百分比的试剂,该试剂可以有效测定糖化血红蛋白百分比,在不需要单独测定样本中总血红蛋白的条件下,可以直接对糖化血红蛋白百分比进行测定。
8.本发明的另一目的在于提供一种测定糖化血红蛋白百分比的方法,该方法利用高效液相离子层析法测定全血中的hba1c,测定结果准确度高。
9.为达到上述目的,本发明提供了如下技术方案:
10.第一方面,本发明提供了一种测定糖化血红蛋白百分比的试剂,所述试剂包括洗脱液a和洗脱液b;
11.所述洗脱液a包括hepes和mes,所述洗脱液a中hepes和所述洗脱液a中mes的浓度各自独立地为0.05~20g/l;
12.所述洗脱液b包括hepes和mes,所述洗脱液b中hepes和所述洗脱液b中mes的浓度各自独立地为0.05~40g/l;
13.所述洗脱液a中hepes和所述洗脱液b中hepes的浓度不同;
14.所述洗脱液a中mes和所述洗脱液b中mes的浓度不同。
15.优选地,所述洗脱液a中hepes的浓度为3~18g/l,例如4.3g/l或15g/l,所述洗脱液a中mes的浓度为0.1~8g/l,例如0.2g/l或5g/l。
16.优选地,所述洗脱液b中hepes的浓度为2~20g/l,例如3.8g/l或18g/l,所述洗脱液b中mes的浓度为0.1~10g/l,例如0.8g/l或8g/l。
17.本发明中,优选地,所述洗脱液a和洗脱液b的ph值为4.5~6,优选地为5~5.8,例如5.2~5.5。
18.本发明中,优选地,所述洗脱液a和洗脱液b还各自独立地包括盐溶液、质子酸和防腐剂中的一种或多种。
19.其中,所述盐溶液可为氯化钠、硫酸钠、硝酸钠中的一种或一种以上。
20.较佳地,所述洗脱液a中盐溶液为氯化钠。所述洗脱液a中盐溶液的浓度较佳地为1~50g/l。
21.更佳地,所述洗脱液a中氯化钠的浓度为10g/l。
22.较佳地,所述洗脱液b中盐溶液为氯化钠。所述洗脱液a中盐溶液的其较佳地浓度为1~100g/l。
23.更佳地,所述洗脱液b中氯化钠的浓度为20g/l。
24.其中,所述质子酸可为三氟乙酸、甘氨酸、稀硝酸、稀盐酸中的一种或一种以上,例如三氟乙酸。
25.较佳地,所述洗脱液a中质子酸为三氟乙酸。所述洗脱液a中质子酸的浓度较佳地为0.01~20g/l。更佳地,所述洗脱液a中三氟乙酸的浓度为1g/l。
26.较佳地,所述洗脱液b中质子酸为三氟乙酸。所述洗脱液a中质子酸的浓度较佳地为0.01~20g/l。更佳地,所述洗脱液b中三氟乙酸的浓度为1g/l。
27.其中,所述防腐剂可为叠氮化钠、proclin300、硫柳汞中的一种或一种以上。
28.较佳地,所述洗脱液a中防腐剂为叠氮化钠。所述洗脱液a中防腐剂的浓度较佳地小于10g/l。
29.更佳地,所述洗脱液a中叠氮化钠的浓度为1g/l。
30.较佳地,所述洗脱液b中防腐剂为叠氮化钠。所述洗脱液b中防腐剂的浓度较佳地小于10g/l。
31.更佳地,所述洗脱液b中叠氮化钠的浓度为1g/l。
32.本发明中,优选地,所述试剂除包括洗脱液a和洗脱液b外,还包括溶血剂。
33.其中,所述溶血剂在洗脱之前与所述洗脱液a、所述洗脱液b是独立的两个体系,可独立存在于洗脱液体系中。所述溶血剂可以包括缓冲液。
34.所述缓冲液可为mes缓冲液、hepes缓冲液、磷酸盐缓冲液中的一种或一种以上。
35.较佳地,所述溶血剂中缓冲液为mes缓冲液。所述溶血剂中缓冲液的浓度较佳地为0.01~1g/l。
36.更佳地,所述溶血剂中mes缓冲液的浓度为0.5g/l。
37.优选地,所述溶血剂还可以包括质子酸和/或防腐剂。
38.所述质子酸可为三氟乙酸、甘氨酸、稀硝酸、稀盐酸中的一种或一种以上。
39.较佳地,所述溶血剂中质子酸为三氟乙酸。所述溶血剂中质子酸的浓度较佳地为0.001g/l~5g/l。
40.更佳地,所述溶血剂中三氟乙酸的浓度为0.1g/l。
41.所述防腐剂可为叠氮化钠、proclin300、硫柳汞中的一种或一种以上。
42.较佳地,所述溶血剂中防腐剂为叠氮化钠。所述溶血剂中叠氮化钠的浓度较佳地小于10g/l。
43.更佳地,所述溶血剂中叠氮化钠的浓度为1g/l。
44.在本发明一较佳实施例中,所述试剂包括:洗脱液a中包括0.2g/l的mes,4.3g/l的hepes,10g/l的氯化钠,1g/l的三氟乙酸和1g/l的叠氮化钠;洗脱液b中包括0.8g/l的mes,3.8g/l的hepes,20g/l的氯化钠,1g/l的三氟乙酸和1g/l的叠氮化钠;溶血剂中包括0.5g/l的mes,0.1g/l的三氟乙酸和1g/l的叠氮化钠。
45.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
46.第二方面,本发明提供了一种测定糖化血红蛋白百分比的方法,其采用如前所述的测定糖化血红蛋白百分比的试剂,该方法为下述方法一或方法二:
47.方法一:当所述试剂包括洗脱液a和洗脱液b时,其包括如下步骤:
48.(1)将溶血后的样本在分析柱中用所述洗脱液a和洗脱液b洗脱得到hba1c组分和hba0组分后进行检测;
49.(2)计算得到hba1c的检测结果。
50.方法二:当所述试剂包括洗脱液a、洗脱液b和溶血剂时,其包括如下步骤:
51.(1)在全血样本中加入所述溶血剂进行溶血;
52.(2)将步骤(1)溶血后的样本在分析柱中用所述洗脱液a和所述洗脱液b洗脱得到hba1c组分和hba0组分后进行检测;
53.(3)计算得到hba1c的检测结果。
54.所述分析柱的填料可为阳离子交换固定相。
55.所述检测的波长可为415nm。
56.所述分析柱的柱温可为37℃。
57.以洗脱液a和洗脱液b的总体积为100%计,所述洗脱梯度可为1s~6s洗脱液a体积可为70%,洗脱液b体积可为30%;7s~25s洗脱液a体积可为50%,洗脱液b体积可为50%;26s~50s洗脱液a体积可为0%,洗脱液b体积可为100%,或者,所述所述洗脱梯度可为1s~3s洗脱液a体积可为70%,洗脱液b体积可为30%;3s~18s洗脱液a可为体积50%,洗脱液b体积可为50%;18s~30s洗脱液a体积可为0%,洗脱液b体积可为100%。
58.所述洗脱液a和所述洗脱液b的流速可为1ml/min~2ml/min,例如1.5ml/min或1.8ml/min。
59.进样量可为5μl。
60.本发明所用试剂和原料除特别说明外,均市售可得。
61.本发明的积极进步效果在于:
62.(1)本发明提供了具有分离效果的糖化血红蛋白检测试剂,该试剂可以有效测定糖化血红蛋白百分比。在不需要单独测定样本中总血红蛋白的条件下,可以直接对糖化血红蛋白百分比进行测定。
63.(2)在洗脱液a、洗脱液b和溶血剂中均添加了添加剂,可以避免样本的测定值随着样本的保存时间的推移而发生变动,同时本发明可以直接全血测试,机内混合稀释,减少了样本前处理的复杂过程,溶血剂与洗脱液属于类似体系,不会出现不相容排斥现象,从而实现糖化血红蛋白的高效、准确检测。
64.(3)本发明提供的测定糖化血红蛋白的方法,对保存后的样本也能够实现快速、准确的检测。因此,对于血样采集地点和测试地点不同、或收集一定数量样本后集中检测,需要对样本进行保存后再检测的情况来说,本发明提供的试剂盒和测定方法都具有十分重要的实际应用价值。
附图说明
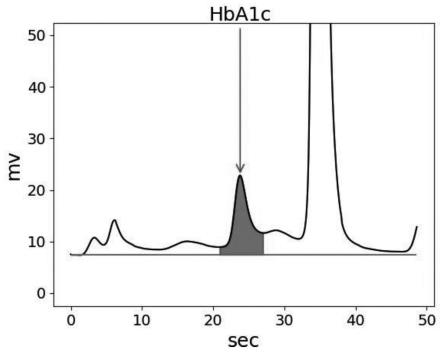
65.图1为实施例1中hplc试剂测试临床样本的效果图。
66.图2为实施例2中hplc试剂测试临床样本的效果图。
67.图3为实施例4中的hplc试剂与东曹hplc法测试结果相关性趋势图。
68.图4为实施例6中hplc试剂测试临床样本的效果图。
69.图5为对比例1中hplc试剂测试临床样本的效果图。
具体实施方式
70.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
71.下面对本发明作进一步描述。
72.本发明是利用高效液相离子层析法测定全血中糖化血红蛋白的方法,首先,血液样本经溶血剂稀释后经过高效液相分析柱时,不同电荷的组分与分析柱有不同的吸附能力;采用不同比例的混合洗脱液(洗脱液a和洗脱液b)对样本中各组分进行分离。被洗脱的蛋白依次通过检测器,检测器自动记录其在415nm的光吸收强度变化,并将光信号转化为电
信号,得到物质信号谱图,对收集到的谱图数据进行分析计算得出hba1c、hba0等峰的面积,hba1c峰面积占总血红蛋白hb峰面积的百分含量即为人全血样本中hba1c的检测结果。
73.下述实施例中使用的原料如下:
74.hepes缓冲液、mes缓冲液、氯化钠、三氟乙酸、叠氮化钠、纯化水、质控品和校准品(均为糖化血红蛋白血样冻干粉),质控品和校准品均为糖化血红蛋白血样冻干粉(购自bio-rad),校准品的糖化血红蛋白血样冻干粉可以通过ifcc溯源。
75.实施例1
76.一种测定糖化血红蛋白百分比的试剂,洗脱液a中包括浓度为0.2g/l的mes、4.3g/l的hepes、10g/l的氯化钠、1g/l的叠氮化钠、1g/l的三氟乙酸;洗脱液b中包括0.8g/l的mes、浓度为3.8g/l的hepes、20g/l的氯化钠、1g/l的三氟乙酸;溶血剂中包括0.5g/l的mes、0.1g/l的三氟乙酸和1g/l的叠氮化钠;样本为全血样本或全血冻干样本。
77.一种测定全血中糖化血红蛋白的方法,包括以下几个步骤:样本中加入溶血剂进行溶血,溶血后的样本在分析柱中用洗脱液洗脱得到hba1c组分和hba0组分后进行检测,计算得到hba1c的检测结果;洗脱液为上述洗脱液a和上述洗脱液b。
78.洗脱条件为:分析柱的填料为阳离子交换固定相,填料粒径为5μm,柱长33mm,柱内径4.0mm;检测波长:415nm;柱温为37℃;洗脱梯度:1s~6s洗脱液a体积70%,洗脱液b体积30%;7s~25s洗脱液a体积50%,洗脱液b体积50%;26s~50s洗脱液a体积0%,洗脱液b体积100%;流速1.5ml/min,进样量5μl。
79.本发明实施例1中hplc试剂测试临床样本的效果图见图1,图1中各个特征峰所对应的物质的百分含量具体如下表,其中24.2s处为hba1c的特殊峰:
80.时间百分比含量时间百分比含量3.5s0.9%24.2s7.5%7.3s1.1%28.8s3.2%16.8s2.5%33.2s84.8%
81.实施例2
82.同实施例1,所不同的是实施例2的试剂盒中不包括质子酸。
83.实施例1和实施例2的试剂盒中洗脱液a,洗脱液b和溶血剂的配制情况具体见表1。
84.表1洗脱液a,洗脱液b和溶血剂的配制情况表
85.[0086][0087]
本发明实施例2中hplc试剂测试临床样本的效果图见图2,图2中各个特征峰所对应的百分含量具体如下表,其中23.2s处为hba1c的特殊峰:
[0088]
时间百分比含量时间百分比含量3.3s0.9%23.2s7.8%6.7s0.7%26.2s3.4%9.9s1.4%33.2s85%15.4s0.8%
ꢀꢀ
[0089]
实施例3
[0090]
样本为质控品,质控品为糖化血红蛋白血样冻干粉。
[0091]
利用实施例1和实施例2的试剂盒对质控品中的hba1c进行检测,检测仪器为糖化血红蛋白仪,洗脱条件同实施例1。
[0092]
取bio-rad的质控品,低值质控品1和高值质控品2,将质控品复溶后,得到质控品溶液,按照体积比为1:300的比例,分别向两组体积为20μl的质控品溶液中加入实施例1和实施例2中的溶血剂进行溶血;溶血后的质控品立即利用分析柱进行洗脱分离和检测,得到hba1c的检测结果,并在2℃~8℃冰箱中保存后检测第3天和第7天的hba1c。检测结果详见表2。
[0093]
表2实施例1和实施例2中hba1c的检测结果(hba1c%)
[0094][0095][0096]
由表2可知,随着保存时间的推移,利用实施例1的试剂盒以及本实施例的测定方法检测质控品时,hba1c的结果基本不发生变动,而利用实施例2的试剂盒进行检测时,hba1c的结果会发生变动。因此,实施例1中添加的三氟乙酸能有效防止hba1c的测定结果发
生变动。
[0097]
实施例4
[0098]
样本为edta抗凝静脉全血,样本采集后立即进行检测。样本共49例,每例取20μl,g8糖化血红蛋白测试系统自动按照1:300比例加入实施例1的溶血剂进行溶血。
[0099]
取上述样本12例,进行如下实验:
[0100]
一种测定糖化血红蛋白百分比的试剂,将实施例1的试剂在实施例3提供的测定方法下检测样本中的hba1c,临床样本从医院取回,用本发明中的试剂及方法测定临床样本,并与医院的测定进行对比,检测结果详见表3。
[0101]
表3实施例4和医院测值中hba1c的检测结果(hba1c%)
[0102][0103]
由表3可知,实施例1的试剂盒检测得到的hba1c值与ifcc标准实验室给定的ifcc靶值基本一致。因此,实施例1提供的试剂和实施例3提供的检测方法可以准确测定保存一段时间后的冷冻样本。
[0104]
取上述剩余样本37例,进行如下实验:
[0105]
测定方法采用日本东曹株式会社的g8糖化血红蛋白测试系统的hplc分析方法,试剂盒为日本东曹株式会社的g8糖化血红蛋白测试试剂盒。
[0106]
实施例4和日本东曹株式会社的g8糖化血红蛋白测试系统的检测结果详见表4。对实施例4和日本东曹株式会社的g8糖化血红蛋白测试系统的检测结果进行相关性分析,得到一元线性方程:y=0.9944x+0.0877,r2=0.9869,如图3所示。
[0107]
表4实施例4和日本东曹株式会社的g8糖化血红蛋白测试系统hba1c的检测结果
[0108][0109][0110]
由表4和图3可知,在2℃~8℃条件下保存7天的全血样本经实施例1的试剂和实施例3的测定方法测定得到的结果与日本东曹株式会社的g8糖化血红蛋白测试系统的检测结果基本一致,相关性很好。因此,本发明的试剂及测定方法具有很高的临床应用价值。
[0111]
实施例5
[0112]
洗脱液a中包括浓度为5g/l的mes、15g/l的hepes、10g/l的氯化钠、1g/l的叠氮化钠、1g/l的三氟乙酸;洗脱液b中包括8g/l的mes、浓度为18g/l的hepes、20g/l的氯化钠、1g/l的叠氮化钠、1g/l的三氟乙酸;溶血剂中包括0.5g/l的mes、0.1g/l的三氟乙酸和1g/l的叠氮化钠;样本为全血样本或全血冻干样本。
[0113]
洗脱条件为:分析柱的填料为阳离子交换固定相,填料粒径为5μm,柱长33mm,柱内径4.0mm;检测波长:415nm;柱温为37℃;洗脱梯度:1s~3s洗脱液a体积70%,洗脱液b体积30%;3s~18s洗脱液a体积50%,洗脱液b体积50%;18s~30s洗脱液a体积0%,洗脱液b体积100%;流速1.8ml/min,进样量5μl。
[0114]
本发明实施例6中hplc试剂测试临床样本的效果图见图4,图4中各个特征峰所对应的百分含量具体如下表,其中12.6s处为hba1c的特殊峰:
[0115]
时间百分比含量时间百分比含量
2.6s2%15.1s1.7%4.9s0.5%18.2s6.6%7.7s1%33.2s83.4%12.6s4.8%
ꢀꢀ
[0116]
对比例1
[0117]
洗脱液a中包括浓度为7g/l的柠檬酸、30g/l的柠檬酸钠、1g/l的叠氮化钠;洗脱液b中包括28g/l的柠檬酸钠、1g/l的叠氮化钠;溶血剂中包括2g/l的柠檬酸钠和1g/l的叠氮化钠;样本为全血样本或全血冻干样本。
[0118]
洗脱条件为:分析柱的填料为阳离子交换固定相,填料粒径为5μm,柱长33mm,柱内径4.0mm;检测波长:415nm;柱温为37℃;洗脱梯度:1s~5s洗脱液a体积80%,洗脱液b体积20%;6s~15s洗脱液a体积50%,洗脱液b体积50%;16s~30s洗脱液a体积0%,洗脱液b体积100%;流速1.8ml/min,进样量5μl。
[0119]
本发明对比例1中hplc试剂测试临床样本的效果图见图5,图5中各个特征峰所对应的百分含量具体如下表,其中15.2s处为hba1c的特殊峰:
[0120]
时间百分比含量时间百分比含量2.8s2.2%20s85.1%7.1s0.9%27.8s3.4%15.2s8.4%
ꢀꢀ
[0121]
效果实施例
[0122]
以hba1c样本的医院检测值为参考,将实施例1、实施例2、实施例5及对比例1制得的试剂的检测值与医院检测值进行对比,具体如表5:
[0123]
表5
[0124]
样品医院检测值实际检测值偏差实施例17.7%7.5%2.59%实施例27.7%7.8%1.29%实施例54.9%4.8%2.04%对比例17.7%8.4%9.09%
[0125]
从图1、图2、图4及图5的效果图可以得出,实施例1、实施例2、实施例5及对比例1中的hplc试剂在测试临床样本时均可以基本实现hba1c特征峰与其他物质的特征峰分离。
[0126]
本领域技术人员可以理解,实际检测值与医院检测值的偏差在3%以内是可接受的。
[0127]
由表5可知,与对比例1、实施例1及实施例5相比,实施例2中的试剂检测的hba1c值与医院的检测值的偏差最小,结果的准确程度最高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1