一种高通量测定配体与蛋白之间结合能量的方法及装置
1.本发明涉及定量蛋白质组学技术领域,具体涉及一种高通量测定配体与蛋白之间结合能量的方法及装置。
背景技术:
2.配体与蛋白之间的相互作用在信号传导、细胞调节和酶催化等多种生物学过程扮演重要角色。配体与蛋白之间的相互作用机理一般被简化为包含配体与蛋白的结合和解离,但是在复杂的生物体系中,例如细胞、组织和血液中,配体与蛋白的相互作用还可能伴随着蛋白-蛋白复合物的形成、解离以及蛋白的变构。结合能量如δg、δh、δs等是决定分子间反应本质的关键因素,因此定量测量结合能量常被用来研究配体-蛋白之间的相互作用机理。多种技术都可以用于测量配体与蛋白之间的结合能量,如核磁共振、表面等离子共振、荧光测定、等温滴定量热、光学镊子、理论计算等。但是这些方法主要针对纯化蛋白或者基于特定条件下蛋白质的荧光标记物等,适用范围有限且不适用于高通量研究如包含蛋白与蛋白复合物相互作用,甚至包含蛋白变构的配体蛋白相互作用机制。因此高效的、高通量的研究配体-蛋白相互作用机理是目前药理学及药物发现的一个巨大挑战。
3.细胞热位移分析(cellular thermal shift assay,cetsa)是2013年提出的一种应用生物物理技术研究药物靶标的方法,其原理如下:每种蛋白质都有自身的熔解曲线,随着温度的升高,蛋白质会变性产生沉淀;当蛋白质结合药物小分子以后,该复合蛋白稳定性增加,熔解曲线会右移,即相同温度下,未降解蛋白的量会提高,加热后蛋白质会变性产生沉淀;通过用不同检测方法来检测热力学稳定性差异的蛋白,即根据比较加药与不加药蛋白质热熔解温度tm的变化判断是否为药物靶标。2014年savitski等首次将cetsa与定量质谱蛋白质组学技术联合运用建立了tpp(thermal proteome profiling,热蛋白质组分析)方法,这项工作利用经验公式拟合了可溶性蛋白比例和温度的关系,从而定量测量了加药与不加药蛋白质热熔解温度tm,且利用这种定量方法鉴定到广谱激酶抑制剂staurosporine的51个靶点,并鉴定出血红素生物合成酶铁螯合酶(ferrochelatase,fech)为该激酶抑制剂的脱靶靶点(off-t arget)。在tpp的基础上还发展了等温计量反应itdr和二维tpp,其中itdr是指在同一温度点下加入不同浓度的配体,二维tpp是多温度点的itdr的组合。
4.近年来发展的基于细胞热位移测定的热蛋白质组分析方法可用于高通量研究细胞裂解液和活细胞中配体与蛋白之间的相互作用,但因没有具体的理论模型,故其函数的参数没有明确的物理意义,所以不能定量测量配体蛋白之间的结合能量,也不能精确地识别包含蛋白复合物形成与解离甚至包含蛋白变构的配体蛋白相互作用。此外,现有的测量蛋白配体相互作用方法通常只能通过ec50(半最大效应浓度)值来反映二者结合强弱,但ec50不属于配体蛋白相互作用的本质参数,该值会随着蛋白的浓度变化而变化。因此,如何高通量定量测量复杂生物样品中的结合能量并精准地识别复杂的配体与蛋白相互作用,已成为目前亟待解决的问题。
技术实现要素:
5.根据第一方面,在一实施例中,提供一种高通量测定配体与蛋白之间结合能量的方法,包括:
6.解离平衡常数计算步骤,包括使用配体-蛋白共沉淀理论模型方程关联不同温度、不同浓度条件下的可溶性蛋白比例和自由配体浓度,计算得到不同温度时的解离平衡常数;
7.结合能量参数计算步骤,包括根据吉布斯-赫姆霍兹方程(亦称吉布斯赫姆霍兹方程)计算得到结合能量参数;
8.识别步骤,包括根据所述结合能量参数识别配体与蛋白之间的相互作用类型。
9.根据第二方面,在一实施例中,提供一种高通量测定配体与蛋白之间结合能量的装置,包括:
10.解离平衡常数计算模块,用于使用配体-蛋白共沉淀理论模型方程关联不同温度、不同浓度条件下的可溶性蛋白比例和自由配体浓度,计算得到不同温度时的解离平衡常数;
11.结合能量参数计算模块,用于根据吉布斯-赫姆霍兹方程计算得到结合能量参数;
12.识别模块,用于根据所述结合能量参数识别配体与蛋白之间的相互作用类型。
13.根据第三方面,在一实施例中,提供一种高通量测定配体与蛋白之间结合能量的装置,包括:
14.存储器,用于存储程序;
15.处理器,用于通过执行所述存储器存储的程序以实现第一方面任意一项的方法。
16.根据第四方面,在一实施例中,提供一种计算机可读存储介质,所述介质上存储有程序,所述程序能够被处理器执行以实现第一方面任意一项的方法。
17.依据上述实施例的一种高通量测定配体与蛋白之间结合能量的方法及装置,本发明可实现包括细胞裂解液、活细胞、组织、血液等复杂生物样本中配体-蛋白多种结合能量的高通量测定。
附图说明
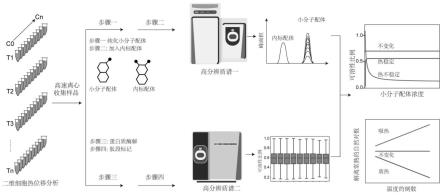
18.图1为一种实施例中高通量测定配体-蛋白之间结合能量的流程图;
19.图2为不同温度下cdk5、prkar2b、stk3可溶性蛋白比例与自由配体浓度拟合曲线拟合图与解离平衡常数拟合图。
具体实施方式
20.下面通过具体实施方式结合附图对本发明作进一步详细说明。在以下的实施方式中,很多细节描述是为了使得本技术能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他材料、方法所替代。在某些情况下,本技术相关的一些操作并没有在说明书中显示或者描述,这是为了避免本技术的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,他们根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
21.另外,说明书中所描述的特点、操作或者特征可以以任意适当的方式结合形成各种实施方式。同时,方法描述中的各步骤或者动作也可以按照本领域技术人员所能显而易见的方式进行顺序调换或调整。因此,说明书和附图中的各种顺序只是为了清楚描述某一个实施例,并不意味着是必须的顺序,除非另有说明其中某个顺序是必须遵循的。
22.本文中为部件所编序号本身,例如“第一”、“第二”等,仅用于区分所描述的对象,不具有任何顺序或技术含义。
23.如本文所用,“室温”是指23
±
2℃。
24.根据第一方面,在一实施例中,提供一种高通量测定配体与蛋白之间结合能量的方法,包括:
25.解离平衡常数计算步骤,包括使用配体-蛋白共沉淀理论模型方程关联不同温度、不同浓度条件下的可溶性蛋白比例和自由配体浓度,计算得到不同温度时的解离平衡常数;
26.结合能量参数计算步骤,包括根据吉布斯-赫姆霍兹方程(亦称吉布斯赫姆霍兹方程)计算得到结合能量参数;
27.识别步骤,包括根据所述结合能量参数识别配体与蛋白之间的相互作用类型。
28.在一实施例中,本发明无需借助溶剂,只通过加热,且可以一次性定量测量药物与多个靶点的亲和力,此外,现有的方法测得的是ec50值,该值会随着蛋白的浓度变化而变化,而本发明是利用新的公式拟合得到配体与蛋白的解离常数kd,该值不随配体及蛋白的浓度变化而变化,是配体-蛋白相互作用的本征参数。
29.现有的方法不适用于复杂的生物环境,一般是一种或多种纯化蛋白,需要知道待测蛋白的浓度,而本发明的方法适用于细胞裂解液、活细胞、组织等复杂生物环境,这些样品中包含成千上万中蛋白。
30.在一实施例中,解离平衡常数计算步骤中,配体-蛋白共沉淀理论模型的构建包含:1)天然蛋白的变性沉淀过程;2)配体与蛋白形成配体蛋白复合物的过程;3)所述配体蛋白复合物作为独立整体的变性沉淀过程。
31.在一实施例中,解离平衡常数计算步骤中,共沉淀模型公式为s=s0+(s
∞-s0)
×a×
[l]/(1+a
×
[l]),kd=s0/(a*s
∞
);s为可溶性蛋白比例,s0为待测温度下不加配体时的可溶性蛋白比例,该值可通过实验测得;s
∞
为待测温度下配体浓度无穷大时的可溶性蛋白比例,该值由共沉淀模型公式拟合获得;kd为解离常数;[l]为自由配体浓度;a为拟合常数。本发明首次提出该共沉淀模型公式,实现对可溶性蛋白比例的计算,从而实现对解离平衡常数的计算。并且,配体与蛋白之间的解离常数kd及由kd计算得到的结合能量不会随着蛋白的浓度变化而变化,属于配体蛋白相互作用的本质参数。
[0032]
在一实施例中,解离平衡常数计算步骤中,所述可溶性蛋白比例和自由配体浓度是通过二维细胞热位移分析方法检测得到。
[0033]
在一实施例中,解离平衡常数计算步骤中,二维细胞热位移分析方法包括在不同温度和不同配体浓度下进行配体与药物的结合和加热实验。
[0034]
在一实施例中,解离平衡常数计算步骤中,温度为37~67℃中的至少3种,配体浓度为0~100μm中的至少8种。
[0035]
在一实施例中,解离平衡常数计算步骤中,通过二维细胞热位移分析方法检测可
溶性蛋白比例时,包括通过定量质谱获得不同温度及不同浓度条件下的蛋白质相对丰度以及对照温度下的蛋白质相对丰度,将所述不同温度及不同浓度条件下的蛋白质相对丰度除以对照温度下的蛋白质相对丰度,获得的可溶性蛋白比例。在一实施例中,对照温度可以为37℃。
[0036]
在一实施例中,定量质谱包括在不同蛋白样品中添加同位素标签。
[0037]
在一实施例中,所述同位素标签包括同量异序标签、相对和绝对定量的等压标签(itra q)、二甲基化标签中的至少一种。
[0038]
在一实施例中,自由配体浓度是指配体与蛋白结合之后,溶液中未与蛋白结合的配体的浓度,该浓度等于配体的初始浓度减去与蛋白结合的配体浓度。
[0039]
在一实施例中,自由配体浓度的检测方法包括但不限于内标法、外标法中的至少一种,使用前述方法可测量得到溶液中未结合的配体(即自由配体)的浓度。利用高分辨质谱、液相色谱中的一种或者两种测量配体峰面积,利用峰面积与浓度绘制标准曲线。
[0040]
在一实施例中,解离平衡常数计算步骤中,利用配体-蛋白共沉淀理论模型方程关联可溶性蛋白比例和自由配体浓度时,包括利用共沉淀模型公式关联可溶性蛋白比例及自由配体浓度,得到不同温度下的解离常数kd,再根据吉布斯-赫姆霍兹方程(gibbs-helmholtz equatio n,亦称吉布斯-亥姆霍兹方程),计算得到结合能量参数。
[0041]
在一实施例中,所述结合能量参数包括但不限于焓变(δh)、熵变(δs)、吉布斯自由能(δg)等等中的至少一种。
[0042]
在一实施例中,识别步骤中,配体与蛋白之间的相互作用类型包括但不限于如下反应中的至少一种:(1)经典的配体与蛋白质相互作用:即蛋白质与配体仅存在结合与解离反应;(2)伴随蛋白复合物形成的配体与蛋白质相互作用:即配体在与靶蛋白结合的过程中,靶蛋白与另一蛋白发生结合反应;(3)伴随蛋白复合物解离的配体与蛋白质相互作用:即靶蛋白初始以复合物的形式存在,配体在与靶蛋白结合的过程中,蛋白复合物发生了解离反应;(4)伴随蛋白质变构的配体与蛋白质相互作用:即配体在与靶蛋白结合的过程中,靶蛋白的结构发生了变化。
[0043]
在一实施例中,识别步骤中,识别配体与蛋白之间的相互作用类型时,使用以下识别标准中的至少一种:(1)经典的配体与蛋白质相互作用:焓变小于0kcal
·
mol-1
,且吉布斯自由能变在-15kcal
·
mol-1
到-7kcal
·
mol-1
之间(包含两端的端点值-15kcal
·
mol-1
、-7kcal
·
m ol-1
);(2)伴随蛋白复合物形成的配体与蛋白质相互作用:焓变小于0kcal
·
mol-1
,且吉布斯自由能变小于-20kcal
·
mol-1
;(3)伴随蛋白复合物解离的配体与蛋白质相互作用:焓变大于0kcal
·
mol-1
;(4)伴随蛋白质变构的配体与蛋白质相互作用:焓变小于0kcal
·
mol-1
,且吉布斯自由能变小于-20kcal
·
mol-1
,或焓变大于0kcal
·
mol-1
,且吉布斯自由能变大于0kcal
·
mol-1
。
[0044]
在一实施例中,识别步骤中,所述配体与蛋白之间的相互作用包括但不限于细胞裂解液、细胞、组织或者血液样品的蛋白质与配体相互作用。
[0045]
在一实施例中,识别步骤中,包括根据所述结合能量参数识别不同类型靶点或变构抑制剂。
[0046]
在一实施例中,识别步骤中,所述变构抑制剂的识别具体指针对同一蛋白质靶点,不同的配体对蛋白质的结构会产生不同的影响,变构抑制剂指对蛋白质结构产生巨大变化
的配体,其识别标准与伴随蛋白质变构的配体与蛋白质相互作用识别标准一致。
[0047]
根据第二方面,在一实施例中,提供一种高通量测定配体与蛋白之间结合能量的装置,包括:
[0048]
解离平衡常数计算模块,用于使用配体-蛋白共沉淀理论模型方程关联不同温度、不同浓度条件下的可溶性蛋白比例和自由配体浓度,计算得到不同温度时的解离平衡常数;
[0049]
结合能量参数计算模块,用于根据吉布斯-赫姆霍兹方程计算得到结合能量参数;
[0050]
识别模块,用于根据所述结合能量参数识别配体与蛋白之间的相互作用类型。
[0051]
根据第三方面,在一实施例中,提供一种高通量测定配体与蛋白之间结合能量的装置,包括:
[0052]
存储器,用于存储程序;
[0053]
处理器,用于通过执行所述存储器存储的程序以实现第一方面任意一项的方法。
[0054]
根据第四方面,在一实施例中,提供一种计算机可读存储介质,所述介质上存储有程序,所述程序能够被处理器执行以实现第一方面任意一项的方法。
[0055]
在一实施例中,提供一种高通量测定配体-蛋白之间结合能量的方法,该方法利用配体-蛋白共沉淀理论模型方程关联不同温度和不同浓度条件下二维细胞热位移分析技术测量得到的可溶性蛋白比例和自由配体浓度,得到不同温度时的解离平衡常数,再根据吉布斯赫姆霍兹方程计算得到结合能量参数,最后利用所得到的结合能量识别配体-蛋白之间的相互作用类型。
[0056]
在一实施例中,配体-蛋白共沉淀理论模型的构建包含三个过程,一是天然蛋白的变性沉淀过程,二是配体与蛋白形成配体蛋白复合物的过程,三是配体蛋白复合物作为独立整体的变性沉淀过程。共沉淀模型公式为s=s0+(s
∞-s0)
×a×
[l]/(1+a
×
[l]),其中kd=s0/(a*s
∞
);s0为待测温度下不加配体时的可溶性蛋白比例,该值可通过实验测得;s
∞
为待测温度下配体浓度无穷大时的可溶性蛋白比例,该值由共沉淀模型公式拟合获得;kd为解离常数;[l]为自由配体浓度;a为拟合常数。
[0057]
在一实施例中,二维细胞热位移分析技术包括在不同温度和不同配体浓度下进行配体与药物的结合和加热实验。温度为37~67℃中的三种及三种以上,配体浓度为0-100μm中的八种及八种以上。
[0058]
在一实施例中,通过二维细胞热位移分析技术测量可溶性蛋白比例时,具体通过高分辨定量质谱技术获得不同温度及不同浓度条件下的蛋白质相对丰度,以及对照温度(例如37℃)下的蛋白质相对丰度,将不同温度及不同浓度条件下的蛋白质相对丰度除以对照温度下的蛋白质相对丰度,获得可溶性蛋白比例。
[0059]
在一实施例中,高分辨定量质谱技术包括同量异序标记技术tmt10plex、tmt11plex、t mt16plex,相对和绝对定量的等压标签技术(itraq),二甲基化标记技术中的一种或两种以上。
[0060]
在一实施例中,自由配体浓度是指配体与蛋白结合之后,溶液中未与蛋白结合的配体浓度,它等于配体的初始浓度减去与蛋白结合的配体浓度。
[0061]
在一实施例中,关于自由配体浓度的检测,可以使用内标法、外标法中的一种或者两种。检测得到溶液中未与蛋白结合的配体(即自由配体)浓度。利用高分辨质谱、液相色谱
中的一种或者两种测量配体峰面积,利用峰面积与浓度绘制标准曲线。
[0062]
在一实施例中,利用配体-蛋白共沉淀理论模型方程关联可溶性蛋白比例和自由配体浓度时,具体包括利用共沉淀模型公式关联可溶性蛋白比例及自由配体浓度得到不同温度下的解离常数kd,再根据吉布斯-赫姆霍兹方程得到焓变(δh)、熵变(δs)、吉布斯自由能(δg)等多种能量参数。
[0063]
在一实施例中,配体-蛋白之间的相互作用类型包括以下几类反应:(1)经典的配体与蛋白质相互作用:即蛋白质与配体仅存在结合与解离反应;(2)伴随蛋白复合物形成的配体与蛋白质相互作用:即配体在与靶蛋白结合的过程中,靶蛋白会与另一蛋白发生结合反应;(3)伴随蛋白复合物解离的配体与蛋白质相互作用:即靶蛋白初始以复合物的形式存在,配体在与靶蛋白结合的过程中,蛋白复合物发生了解离反应;(4)伴随蛋白质变构的配体与蛋白质相互作用:即配体在与靶蛋白结合的过程中,靶蛋白的结构发生了巨大的变化;(5)以上几种类型的组合中的一种或多种以上。
[0064]
在一实施例中,识别配体-蛋白之间的相互作用类型,包括以下识别标准:(1)经典的配体与蛋白质相互作用:焓变是小于0kcal
·
mol-1
,吉布斯自由能变在-15kcal
·
mol-1
到-7kcal
·
mol-1
之间;(2)伴随蛋白复合物形成的配体与蛋白质相互作用:焓变小于0kcal
·
mol-1
,吉布斯自由能变小于-20kcal
·
mol-1
;(3)伴随蛋白复合物解离的配体与蛋白质相互作用:焓变大于0kcal
·
mol-1
;(4)伴随蛋白质变构的配体与蛋白质相互作用:吉布斯自由能变小于-20kcal
·
mol-1
或焓变大于0kcal
·
mol-1
。
[0065]
在一实施例中,本发明提供的高通量测定配体-蛋白之间结合能量的方法可应用于细胞裂解液、细胞、组织或者血液样品的蛋白质与配体相互作用分析。
[0066]
在一实施例中,可将配体-蛋白之间结合能量测量方法用于复杂生物样本中配体与靶点解离常数及结合能量的测量、不同类型靶点的识别和变构抑制剂的识别。
[0067]
在一实施例中,变构抑制剂的识别具体指针对同一蛋白质靶点,不同的配体对蛋白质的结构会产生不同的影响,变构抑制剂指对蛋白质结构产生巨大变化的配体,其识别标准与伴随蛋白质变构的配体与蛋白质相互作用识别标准一致。
[0068]
在一实施例中,提供一种结合二维细胞热位移分析技术和共沉淀模型高通量测定配体-蛋白之间结合能量的方法,可用于复杂生物环境中(细胞裂解液、活细胞等)蛋白质与配体之间结合能量高通量的定量测量。
[0069]
在一实施例中,本发明提供一种高通量测定配体-蛋白之间结合能量的方法,该方法利用配体-蛋白共沉淀理论模型方程关联不同温度和不同浓度条件下二维细胞热位移分析测量得到的可溶性蛋白比例和自由配体浓度,得到不同温度时的解离平衡常数,再根据吉布斯赫姆霍兹方程计算得到结合能量,最后利用所得到的结合能量解释配体-蛋白之间的相互作用机理。具体过程为:(1)通过高分辨质谱测量配体-蛋白结合之后自由配体的浓度;(2)通过高分辨定量质谱技术测量每种蛋白在不同温度、不同浓度下的可溶性比例;(3)建立配体-蛋白共沉淀理论模型;(4)利用沉淀理论模型关联自由配体浓度和可溶性蛋白比例得到能量相关参数,包括解离常数(kd)、吉布斯自由能(δg)、焓变(δh)、熵变(δs)等;(5)依据结合能量识别配体-蛋白相互作用类型,包括蛋白复合物的结合与解离、蛋白的变构等。本发明提供的方法可实现包括细胞裂解液、活细胞、组织、血液等复杂生物样本中配体-蛋白多种结合能量的高通量测定。
[0070]
在一实施例中,本发明提供了一种高通量测定配体-蛋白之间结合能量的方法。通过采用本发明提供的共沉淀模型所得公式,结合二维的细胞热位移分析技术,能够实现复杂生物样本中配体与蛋白质解离常数(kd)、吉布斯自由能(δg)、焓变(δh)、熵变(δs)等的测量,可实现高通量高准确性的配体蛋白相互作用的定量测量。此外,本发明提供的配体-蛋白之间结合能量测定方法可实现精准识别复杂生物样本中不同类型靶点、变构抑制剂等。
[0071]
在一实施例中,本发明采用以下技术方案:
[0072]
(1)二维细胞热位移实验:将一系列不同浓度(0-100μm,浓度数目为n)的配体药物与细胞裂解液、组织裂解液等在室温下一起孵育完成给药实验。随后在m个不同温度(46℃,48℃,50℃,52℃,54℃)下进行加热使裂解液中的蛋白质发生沉淀。每个温度下设置对照组37℃,给药浓度为0μm。m个不同温度共得到m
×
(n+1)个样品,分批进行高速离心,获取上清液。将每个样品的上清液一分为二。
[0073]
(2)蛋白质组样品前处理实验及质谱分析:将第一份m
×
(n+1)个样品的上清液分别取出10-30μg进行溶液酶解,获得肽段混合物。接着,对肽段混合物进行定量质谱标签标记。将每个温度下标记后的样品进行合并,分级。最后进行高分辨质谱采集,通过定量蛋白质组学技术获得每种蛋白质在不同浓度、不同温度下的可溶性比例。
[0074]
(3)配体纯化及自由配体浓度测定:将第二份m
×
(n+1)个样品的上清液分别用c18 tip小柱进行吸附,使配体药物通过疏水作用吸附在c18 tip小柱。清洗杂质之后,将吸附在c18 tip小柱上的配体药物进行洗脱,得到m
×
(n+1)个洗脱液。冻干之后进行高分辨质谱采集,计算峰面积,获得不同温度、不同浓度下的自由配体浓度。
[0075]
(4)利用共沉淀模型关联可溶性蛋白质比例与自由配体浓度,获取能量参数:将可溶性蛋白质比例与自由配体浓度代入共沉淀模型s=s0+(s
∞-s0)
×a×
[l]/(1+a
×
[l]),其中kd=s0/(a*s
∞
),得到解离常数kd,并将其代入吉布斯-赫姆霍兹方程,计算得到结合能量δg、δh、δs等参数。
[0076]
实施例1
[0077]
图1所示为本实施例中高通量测定配体-蛋白之间结合能量的流程图。
[0078]
具体步骤如下:
[0079]
(1)二维细胞热位移实验:将一系列不同浓度(100μm,25μm,6.25μm,1.5625μm,0.3906μm,0.0976μm,0.0244μm,0.006μm,0.0015μm,0μm)的广谱性蛋白激酶抑制剂(staurosporine)与k562细胞裂解液在室温下一起孵育完成给药实验。随后在5个不同温度(46℃,48℃,50℃,52℃,54℃)下进行加热使裂解液中的蛋白质发生沉淀。每个温度下设置对照组37℃,给药浓度为0μm。5个不同温度共得到55个样品,分批进行高速离心,获取上清液。将每个样品的上清液一分为二,第一份上清液用于蛋白质组样品前处理实验,第二份上清液用于自由配体的纯化。
[0080]
(2)蛋白质组样品前处理实验及质谱分析:将第一份55个样品的上清液分别取出20μg进行溶液酶解,获得肽段混合物。接着,对肽段混合物进行tmt11plex标记。除盐后,将每个温度下的11个样品的洗脱液进行合并,共得到5份合并后的洗脱液。冻干后,将5份洗脱液依次进行基于c18 tip小柱的分级实验,每份洗脱液分成6个级份,共30个级份。最后,将30个级份依次进行高分辨质谱采集,通过定量蛋白质组学技术获得每种蛋白质在不同浓
度、不同温度下的可溶性比例。
[0081]
(3)配体纯化及自由配体浓度测定:将第二份55个样品的上清液分别用c18 tip小柱进行吸附,使广谱性蛋白激酶抑制剂staurosporine通过疏水作用吸附至c18 tip小柱。清洗杂质之后,将吸附在c18 tip小柱上的广谱性蛋白激酶抑制剂staurosporine进行洗脱,得到55个洗脱液。冻干之后,在55个样品中加入等量的与staurosporine结构相似的内标物,随后进行高分辨质谱采集。绘制staurosporine标准曲线,通过配体与内标物的峰面积比,计算不同温度、不同浓度下的自由配体浓度。
[0082]
(4)利用共沉淀模型关联可溶性蛋白质比例与自由配体浓度,获取能量参数:将可溶性蛋白质比例与自由配体浓度代入共沉淀模型s=s0+(s
∞-s0)
×a×
[l]/(1+a
×
[l]),其中kd=s0/(a*s
∞
),得到解离常数kd,并将其代入吉布斯赫姆霍兹方程计算得到结合能量δg、δh、δs等参数。通过本发明的方法,在46℃,48℃,50℃,52℃,54℃均鉴定到超过60个激酶靶蛋白,且每个激酶靶蛋白的能量参数均可获得。其中,以cdk5、prkar2b、stk3蛋白为例,其可溶性蛋白比例与自由配体浓度拟合曲线及解离平衡常数拟合如图2所示。
[0083]
实施例2
[0084]
(1)二维细胞热位移实验:将一系列不同浓度(100μm,50μm,25μm,12.5μm,6.25μm,3.125μm,1.5625μm,0.7812μm,0.3906μm,0.1953μm,0.0976μm,0.0488μm,0.0244μm,0.0122μm,0μm)的akt蛋白正构抑制剂(at7867)与hke 293t细胞裂解液在室温下一起孵育完成给药实验。随后在4个不同温度(48℃,50℃,52℃,54℃)下进行加热使裂解液中的蛋白质发生沉淀。每个温度下设置对照组37℃,给药浓度为0μm。4个不同温度共得到64个样品,分批进行高速离心,获取上清液。将每个样品的上清液一分为二,第一份上清液用于蛋白质组样品前处理实验,第二份上清液用于自由配体的纯化。
[0085]
(2)蛋白质组样品前处理实验及质谱分析:将第一份64个样品的上清液分别取出20μg进行溶液酶解,获得肽段混合物。接着,对肽段混合物进行tmt16plex标记。除盐后,将每个温度下的16个样品的洗脱液进行合并,共得到4份合并后的洗脱液。冻干后,将4份洗脱液依次进行基于c18 tip小柱的分级实验,每份洗脱液分成8个级份,共32个级份。最后,将32个级份依次进行高分辨质谱采集,通过定量蛋白质组学技术获得每种蛋白质在不同浓度,不同温度下的可溶性比例。
[0086]
(3)配体纯化及自由配体浓度测定:将第二份64个样品的上清液分别用c18 tip小柱进行吸附,使akt蛋白正构抑制剂(at7867)通过疏水作用吸附在c18 tip小柱。清洗杂质之后,将吸附在c18 tip小柱上的akt蛋白正构抑制剂(at7867)进行洗脱,得到64个洗脱液。冻干之后,在64个样品中加入等量的与at7867结构相似的内标物,随后进行高分辨质谱采集。绘制at7867标准曲线,通过配体与内标物的峰面积比,计算不同温度、不同浓度下自由配体浓度。
[0087]
(4)利用共沉淀模型关联可溶性蛋白质比例与自由配体浓度,获取能量参数:将可溶性蛋白质比例与自由配体浓度代入共沉淀模型s=s0+(s
∞-s0)
×a×
[l]/(1+a
×
[l]),kd=s0/(a*s
∞
),得到解离常数kd,并将其代入吉布斯赫姆霍兹方程计算得到结合能量δg、δh、δs等参数。其中,以akti蛋白为例,其获得的能量参数如表1所示,通过能量参数判断at7867与akt1相互作用类型为非变构作用,即经典的配体与蛋白质相互作用,亦称经典的不含蛋白变构的相互作用。
[0088]
表1 akt1与at7867结合能量参数
[0089]
蛋白δhδsδg(298.15k)相互作用类型akt1-21.345kcal
·
mol-1-0.037kcal
·
mol-1-10.416kcal
·
mol-1
非变构
[0090]
实施例3
[0091]
(1)二维细胞热位移实验:将一系列不同浓度(100μm,20μm,4μm,0.8μm,0.16μm,0.032μm,0.0064μm,0.00128μm,0μm)的akt蛋白变构抑制剂(mk-2206)与hela细胞裂解液在室温下一起孵育完成给药实验。随后在5个不同温度(46℃,48℃,50℃,52℃,54℃)下进行加热使裂解液中的蛋白质发生沉淀。每个温度下设置对照组37℃,给药浓度为0μm。5个不同温度共得到50个样品,分批进行高速离心,获取上清液。将每个样品的上清液一分为二,第一份上清液用于蛋白质组样品前处理实验,第二份上清液用于自由配体的纯化。
[0092]
(2)蛋白质组样品前处理实验及质谱分析:将第一份50个样品的上清液分别取出20μg进行溶液酶解,获得肽段混合物。接着,对肽段混合物进行tmt10plex标记。除盐后,将每个温度下的10个样品的洗脱液进行合并,共得到5份合并后的洗脱液。冻干后,将5份洗脱液依次进行基于c18 tip小柱的分级实验,每份洗脱液分成6个级份,共30个级份。最后,将30个级份依次进行高分辨质谱采集,通过定量蛋白质组学技术获得每种蛋白质在不同浓度,不同温度下的可溶性比例。
[0093]
(3)配体纯化及自由配体浓度测定:将第二份50个样品的上清液分别用c18 tip小柱进行吸附,使akt蛋白变构抑制剂(mk-2206)通过疏水作用吸附在c18 tip小柱。清洗杂质之后,将吸附在c18 tip小柱上的akt蛋白变构抑制剂(mk-2206)进行洗脱,得到50个洗脱液。冻干之后,在50个样品中加入等量的与mk-2206结构相似的内标物,随后进行高分辨质谱采集。绘制mk-2206标准曲线,通过配体与内标物的峰面积比,计算不同温度、不同浓度下的自由配体浓度。
[0094]
(4)利用共沉淀模型关联可溶性蛋白质比例与自由配体浓度,获取能量参数:将可溶性蛋白质比例与自由配体浓度代入共沉淀模型s=s0+(s
∞-s0)
×a×
[l]/(1+a
×
[l]),其中kd=s0/a/s
∞
。,得到解离常数kd,并将其代入吉布斯赫姆霍兹方程计算得到结合能量δg、δh、δs等参数。通过本发明的方法,在46℃,48℃,50℃,52℃,54℃均鉴定到超过60个激酶靶蛋白,且每个激酶靶蛋白的能量参数均可获得。其中,以akti蛋白为例,其获得的能量参数如表2所示,通过能量参数判断mk-2206与akt1相互作用类型为变构作用,即伴随蛋白复合物形成的配体与蛋白质相互作用。
[0095]
表2 akt1与mk-2206结合能量参数
[0096]
蛋白δhδsδg(298.15k)相互作用类型akt1-389.788kcal
·
mol-1-1.163kcal
·
mol-1-43.034kcal
·
mol-1
变构
[0097]
本领域技术人员可以理解,上述实施方式中各种方法的全部或部分功能可以通过硬件的方式实现,也可以通过计算机程序的方式实现。当上述实施方式中全部或部分功能通过计算机程序的方式实现时,该程序可以存储于一计算机可读存储介质中,存储介质可以包括:只读存储器、随机存储器、磁盘、光盘、硬盘等,通过计算机执行该程序以实现上述功能。例如,将程序存储在设备的存储器中,当通过处理器执行存储器中程序,即可实现上述全部或部分功能。另外,当上述实施方式中全部或部分功能通过计算机程序的方式实现时,该程序也可以存储在服务器、另一计算机、磁盘、光盘、闪存盘或移动硬盘等存储介质
中,通过下载或复制保存到本地设备的存储器中,或对本地设备的系统进行版本更新,当通过处理器执行存储器中的程序时,即可实现上述实施方式中全部或部分功能。
[0098]
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1