一种液相色谱串联质谱法检测血液中18种抗生素的方法及试剂盒与流程
1.本发明涉及药物检测技术领域,尤其涉及一种液相色谱串联质谱法检测血液中18种抗生素的方法及试剂盒。
背景技术:
2.抗生素在杀灭病原菌的同时也会对人体造成损害。药物经口腔入胃、经肠道吸收入血输送到人体的各个细胞中,而只有到达病灶部位的药物才对病原菌能起到杀菌的作用,其它组织中的药物不但没有起到杀菌的作用,反而代谢产物要经肝肾排出体外,对肝肾等脏器有一定的损害作用,如氯霉素、林可霉素、四环素、红霉素等,都需要在肝内代谢。此外,许多抗生素如青霉素、链霉素等药物可引起变态反应,如过敏性休克,从轻微皮疹、发热到造血系统抑制等,甚至也会损害神经系统,如中枢神经系统、听力、视力、周围神经系统病变以及神经肌肉传导阻滞作用等。最后,抗生素的滥用也有可能引起菌群的失调、延误疾病的治疗。由于受到抗生素的影响,正常菌群中各种细菌的种类和数量都会发生变化。严重的菌群失调可以导致机体出现一系列临床症状,主要见于长期应用广谱抗生素治疗的患者,其体内对抗生素敏感的细菌被大量杀灭,而不敏感的细菌,如金葡菌、白色念珠菌等则乘机繁殖,引起假膜性肠炎、白色念珠菌性肺炎等,也就是临床上所谓的二重感染,进而给疾病的治疗带来很大的麻烦,产生严重的不良后果。
3.抗生素滥用和残留的危害主要有:细菌耐药性、对机体直接的不良反应增加、肠道功能失调发生紊乱以及二重感染率增加等。为控制抗生素滥用和残留,不仅需要通过立法加大监管力度,从源头上进行控制,还应建立有效的抗生素筛查体系,为检测抗生素滥用和残留提供技术上的保障。
4.由于抗生素的浓度相对较低,所以抗生素的检测一般都是微量或是痕量分析,常采用具有高灵敏度的仪器进行检测。常见需要进行抗生素检测的基质有水,禽畜的肉、蛋、奶以及血液,抗生素的检测技术主要有色谱法和其联用技术、酶免疫分析法、毛细管电泳法等。液质联用技术是液相色谱与质谱串联的检测技术,具有组分分离、结构鉴定和高通量筛查的功能,为抗生素的分析检测提供了有效的手段。液质联用技术的分离、鉴定和高通量筛查使抗生素的质量控制、滥用残留和药物代谢检测变得更加高效和便捷,已经广泛应用于抗生素的相关研究工作中。
5.已有技术的方法大多存在着前处理操作较复杂,样品量需求较大,分析时间较长等问题,尚不适于大通量的血液样本检测。样品前处理是分析抗生素残留的关键,合适的样品前处理方法能够提高样品回收率,减小基质效应。近几年,随着抗生素检测方法的不断改进,开发出多种前处理方法。目前主要的前处理方法包含液液萃取、固相萃取、基质分散固相萃取以及分子印迹固相萃取还有quechers。液-液萃取是基于分析物在不同溶剂间的分配系数的不同,达到分离的目的,该方法简单、方便,对仪器和实验条件要求不高,但是易产生乳化现象,操作时间长,产生废液量大。固相萃取、基质分散固相萃取以及分子印迹固相
萃取这三类前处理方法,净化效果好,能够对样本进行浓缩和富集适合痕量检测。但是前处理耗材昂贵,批量检测成本较高。quechers前处理方法,有着简单、高效的特点,广泛应用于食品、环境检测等领域。适合于大样本量的检测。然而对于的血液样本检测,由于样本珍贵,样本量少,quechers前处理方法很难满足检测的需要。同时quechers前处理通常使用的吸附剂需要提前称量或者购买商品化的前处理套装。增加了的检测的时间成本和经济成本。
6.鉴于此,特提出本发明。
技术实现要素:
7.为了解决上述技术问题,本发明提供了一种液相色谱串联质谱法检测血液中18种抗生素的方法及试剂盒。
8.本发明第一方面提供了一种液相色谱串联质谱法检测血液中18种抗生素的方法,18种抗生素为阿莫西林、磺胺噻唑、左氧氟沙星、林可霉素、磺胺嘧啶、诺氟沙星、磺胺吡啶、环丙沙星、四环素、头孢噻肟、土霉素、磺胺二甲嘧啶、氨苄西林、金霉素、头孢噻吩、青霉素、苯唑西林和氯霉素;方法至少包括以下步骤:s1、制备标准曲线方程,包括:s11、配制梯度浓度的混合标准工作液、混合内标工作液;混合标准工作液中含有18种抗生素的标准品,混合内标工作液中含有16种同位素内标的标准品;s12、将混合标准工作液和混合内标工作液混合,配制得到梯度浓度的标准溶液,利用高效液相色谱质谱联用仪对标准溶液进行检测,获得标准曲线方程;s2、处理得到待测样品,包括:取待测血液样本加入混合内标工作液,经前处理后得到待测样本;前处理包括:待测血液样本加入混合内标工作液后,加入前处理试剂混合、离心,取上清液干燥,加入复溶液混合,离心得到待测样本;前处理试剂包括乙腈和水;s3、检测待测样品,包括:使用高效液相色谱质谱联用仪对待测样本进行检测,将检测结果代入标准曲线方程,得到待测样本中抗生素的浓度。
9.本发明第二方面提供了一种检测血液中18种抗生素的试剂盒,包括蛋白沉淀液、复溶液、流动相、梯度浓度的混合标准工作液、梯度浓度的混合内标工作液;前处理试剂包括乙腈和水,乙腈和水的体积比为2 ~ 20:1;复溶液选自体积百分比浓度为50% ~ 100%的甲醇水溶液;流动相包括流动相a和流动相b,流动相a为含0.01% ~ 1%甲酸的水;流动相b为甲醇;混合标准工作液中含有阿莫西林标准品、磺胺噻唑标准品、左氧氟沙星标准品、林可霉素标准品、磺胺嘧啶标准品、诺氟沙星标准品、磺胺吡啶标准品、环丙沙星标准品、四环素标准品、头孢噻肟标准品、土霉素标准品、磺胺二甲嘧啶标准品、氨苄西林标准品、金霉素标准品、头孢噻吩标准品、青霉素标准品、苯唑西林标准品和氯霉素标准品,采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成;混合内标工作液采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成,16种同位素内标的标准品包括:阿莫西林-d4标准品、磺胺噻唑-13c6标准品、左氧氟沙星-d8标准品、林可霉素-d3标准品、磺胺嘧啶-13c6标准品、诺氟沙星-d5标准品、磺胺吡啶-13c6标准品、环丙沙星-d8标准品、四环素-d6标准品、头孢噻肟-d3标准品、磺胺二甲嘧啶-d4标准品、氨苄西林-d5标准品、金霉素-13c,d3标准品、青霉素-d7标准品、苯唑西林-d5标准品和氯霉素-d5标准品,采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成。
10.本发明第三方面提供了第一方面的方法在监测18种抗生素血药浓度中的应用,18种抗生素为阿莫西林、磺胺噻唑、左氧氟沙星、林可霉素、磺胺嘧啶、诺氟沙星、磺胺吡啶、环丙沙星、四环素、头孢噻肟、土霉素、磺胺二甲嘧啶、氨苄西林、金霉素、头孢噻吩、青霉素、苯唑西林和氯霉素。
11.本发明实施例提供的技术方案与现有技术相比具有如下优点:本发明提出一种简单、快速、高效的定量检测血液中微量抗生素的方法。
12.首先,本发明检测方法所需的样本量小,50 ~ 500 μl的血液样本均可完成检测,增加了受试者的依从性,降低了采样难度。
13.其次,本发明检测方法的成本低,不需要其他昂贵的前处理耗材,也不需要昂贵的试剂,同样可以达到准确度高、灵敏度高的检测效果。
14.再次,本发明检测方法简化了实验步骤,前处理以及仪器操作过程简便,方便实验人员操作,降低人员成本,在优选的技术方案中,质谱mrm正负混合采集模式,统一了分析方法,缩短了分析时间,整体检测时间为5 ~ 10 min。
15.最后,本发明检测方法无需购入其他前处理装置,实验室兼容性强。前处理使用均为液体试剂,取样方便,便于实验操作,同时便于后续批量化自动化样本检测。
附图说明
16.图1为本发明实施例1中标准溶液的色谱图;图2为本发明实施例1中添加血清样本的色谱图;图3为本发明实施例5中采用kinetex c18色谱柱的色谱图;图4为本发明实施例5中采用poroshell ec-c18色谱柱的色谱图;图5为本发明实施例6中流动相为1%甲酸水的色谱图;图6为本发明实施例6中流动相为0.01%甲酸水的色谱图;图7为本发明实施例7中b相比例第一分析阶段为25%变换到第三分析阶段为65%的色谱图;图8为本发明实施例7中b相比例第一分析阶段为30%变换到第三分析阶段为70%的色谱图;图9为本发明实施例7中b相比例第一分析阶段为35%变换到第三分析阶段为80%的色谱图;图10为本发明实施例7中b相比例第一分析阶段为40%变换到第三分析阶段为85%的色谱图;图11为本发明实施例8中流速为0.7 ml/min时的色谱图;图12为本发明实施例8中流速为0.6 ml/min时的色谱图;图13为本发明实施例8中流速为0.4 ml/min时的色谱图;图14为本发明实施例8中流速为0.3 ml/min时的色谱图;图15为本发明对比例2中采用kinetex f5色谱柱的色谱图;图16为本发明对比例2中采用kinetex phenyl-hexyl色谱柱的色谱图。
17.以上色谱图的横坐标的单位均为分钟。
具体实施方式
18.为了能够更清楚地理解本发明的上述目的、特征和优点,下面将对本发明的方案进行进一步描述。需要说明的是,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
19.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但本发明还可以采用其他不同于在此描述的方式来实施;显然,说明书中的实施例只是本发明的一部分实施例,而不是全部的实施例。
20.本发明实施例第一方面提出一种液相色谱串联质谱法检测血液中18种抗生素的方法,18种抗生素包括了常见的7大类抗生素:磺胺类抗生素、喹诺酮类抗生素、四环素类抗生素、青霉素类抗生素、氯霉素类抗生素、头孢菌素类抗生素、林可胺类碱性抗生素;具体的:磺胺类抗生素包括:磺胺噻唑(st)、磺胺嘧啶(sdz)、磺胺吡啶(spd)、磺胺二甲嘧啶(smz);喹诺酮类抗生素包括:诺氟沙星(nor)、环丙沙星(cip)、左氧氟沙星(lofl);四环素类类抗生素包括:四环素(tc)、土霉素(otc)、金霉素(ctc);氯霉素类抗生素包括:氯霉素(chl);青霉素类抗生素包括:青霉素(pen)、阿莫西林(amo)、氨苄西林(amp)、苯唑西林(oxa);头孢菌素类药物包括:头孢噻吩(cpt)、头孢噻肟(cfx);林可胺类碱性抗生素包括:林可霉素(lin)。
21.已有技术中有针对一类或者几种抗生素进行检测的报道,目前尚未有关于同时检测7类共18种抗生素的报道,分别检测会增加检测时间、增加检测成本。而本发明实施例通过对前处理条件以及液相色谱串联质谱条件进行深入研究后,提出了一种可同时定量检测7类共18种抗生素的检测方法。
22.该方法至少包括以下步骤:s1、制备标准曲线方程,包括:s11、配制梯度浓度的混合标准工作液、混合内标工作液;混合标准工作液中含有所述18种抗生素的标准品,混合内标工作液中含有16种同位素内标的标准品;s12、将混合标准工作液和所述混合内标工作液混合,配制得到梯同浓度的标准溶液,利用高效液相色谱质谱联用仪对所述标准溶液进行检测,获得标准曲线方程;s2、处理得到待测样品,包括:取待测血液样本加入混合内标工作液,经前处理后得到待测样本;s3、检测待测样品,包括:使用高效液相色谱质谱联用仪对待测样本进行检测,将检测结果代入标准曲线方程,得到待测样本中抗生素的浓度。
23.本发明实施例的检测血液中18种抗生素的方法,所需的样本量小,仅需要50 μl的血液样本即可完成检测。并且不需要其他昂贵的前处理耗材,也不需要昂贵的试剂,简化了实验操作,降低了检测成本。
24.作为本发明实施例的一种改进,在s11中,混合标准工作液采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成,并优选采用体积百分比浓度为50%~70%的甲醇水溶液
配制,更优选50%甲醇水溶液;混合内标工作液采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成,优选采用体积百分比浓度为50%~70%的甲醇水溶液配制,更优选50%甲醇水溶液。
25.作为本发明实施例的一种改进,混合内标工作液中,16种同位素内标的标准品包括:阿莫西林-d4标准品、磺胺噻唑-13c6标准品、左氧氟沙星-d8标准品、林可霉素-d3标准品、磺胺嘧啶-13c6标准品、诺氟沙星-d5标准品、磺胺吡啶-13c6标准品、环丙沙星-d8标准品、四环素-d6标准品、头孢噻肟-d3标准品、磺胺二甲嘧啶-d4标准品、氨苄西林-d5标准品、金霉素-13c,d3标准品、青霉素-d7标准品、苯唑西林-d5标准品和氯霉素-d5标准品。采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成。本技术实施例采用了内标物混用的设计,每种物质以自身同位素标准品作为内标,其中本实施例中给出一种可能,其中土霉素与四环素使用共同使用四环素-d6作为内标物,头孢噻吩与左氧氟沙星使用共同使用左氧氟沙星-d8作为内标物。在保证检测准确性和灵敏度的条件下,进一步简化了试剂和操作,提高了检测效率,降低了检测成本。
26.作为本发明实施例的一种改进,在s12中,混合标准工作液和混合内标工作液的体积比为1:1;混合的条件为2000 ~ 3000 r/min涡旋混合0.5 ~ 2分钟,并优选为2500 r/min涡旋混合1分钟。
27.作为本发明实施例的一种具体的实施方式,本发明实施例的混合标准工作液配制方法如下:1、采用体积百分比浓度为50 %的甲醇水溶液配制各个抗生素的标准储备液,各个抗生素标准品的浓度可以为100 μg/ml;采用-80℃保存。
28.2、将各个抗生素的标准储备液混合,采用体积百分比浓度为50%的甲醇水溶液配制得到混合标准中间液,混合标准中间液浓度各个抗生素浓度为1000 ng/ml。采用-80℃保存。
29.3、适量移取混合标准中间液于1.5 ml离心管中,再加入适量体积百分比浓度为50 %甲醇水稀释,混合均匀得到级别为l7的标准工作液,然后继续用体积百分比浓度为50%甲醇水溶液进行逐级稀释,得到级别为l1 ~ l6标准工作液,并在-20℃条件下保存,各抗生素各级混合标准工作液浓度分别为1.0 ng/ml,2.0 ng/ml,4.0 ng/ml,8.0 ng/ml,16.0 ng/ml,32.0 ng/ml,64.0 ng/ml。-80℃保存。
30.作为本发明实施例的一种改进,本发明实施例的内标储备液的配制方法如下:天平精密称量各个抗生素同位素内标的标准品,溶于适量体积百分比浓度为50%甲醇水溶液中,混合均匀得到浓度均为100 μg/ml各个抗生素同位素内标的单标储备液,-80℃保存。适量移取各个抗生素同位素内标的单标储备液于同一离心管中,再加入适量体积百分比浓度为50%甲醇水溶液,混合均匀得到混合内标工作液。-80℃保存。混合内标工作液中各个抗生素内标浓度均为8.0 ng/ml。
31.在本发明实施例中,前处理步骤采用了液-液萃取方法,具体为:待测血液样本加入混合内标工作液后,加入前处理试剂混合、离心、取上清液干燥,加入复溶液混合,离心得到待测样本。在本发明实施例中,血液蛋白沉淀后取上清液吹干复溶后直接进样,使检测过程简便快速,实验成本降低,分析时间短,更利于大通量的样本检测。
32.本发明实施例对前处理试剂进行了筛选,发现前处理试剂选自乙腈和水,具有提
取回收率最佳的技术效果。
33.同时,复溶液选自体积百分比浓度为50% ~ 100%的甲醇水溶液。复溶液与配制标准溶液的溶液一致,简化溶剂配制种类同时可以避免溶剂效应。
34.本技术实施例中的待测血液样本可以为血清或血浆样本,其处理方法采用现有常规方法进行处理。待测血液样本的体积为50 ~ 500 μl,优选50 ~ 100 μl。待测血液样本与混合内标工作液的体积比为1~ 10:1,并优选1 ~ 2:1。例如,每个检测体系中添加50 μl待测血液样本,加入50 μl内标工作液。
35.作为本技术实施例的一种改进,乙腈和水的体积比为2 ~ 20:1,优选4 ~ 20:1,更优选4 ~ 10:1,具体可选用5:1、6:1、7:1、8:1、9:1或10:1。研究过程发现,水能够起到样本分散,并降低蛋白沉淀反应速率的作用,如果前处理试剂中不添加水混匀的步骤,仅采用纯乙腈,会导致蛋白沉淀速率过快会,目标物的提取回收率低,无法满足检测要求。如果前处理试剂中的水添加量过大,蛋白沉淀效果不佳,肉眼可见的提取液浑浊,蛋白沉淀不完全,影响前处理净化效果。本技术进一步深入研究后发现,水和乙腈分分步混匀的方式,相比将直接添加乙腈水溶液,可进一步提高目标物的回收率。
36.作为本技术实施例的一种改进,待测血液样本与前处理试剂的体积比为1:3 ~ 30,并优选1:5 ~ 20,具体可选用1:6、1:7、1:8、1:9、1:10或1:11,更优选1:7。例如,每个检测体系中添加50 μl待测血液样本,加入50 μl内标工作液、50 μl水和300 μl乙腈。
37.加入前处理试剂混合的条件为2000 ~ 3000 r/min混匀1 ~ 20 min,并进一步优选为添加水2000 ~ 3000 r/min混匀1 ~ 3min,然后再添加乙腈2000 ~ 3000 r/min混匀8 ~ 15 min。进一步优选添加水2500 r/min混匀1 min,然后再添加乙腈2500 r/min混匀10 min。混合结束后进行低温离心,离心的条件为12000 ~ 16000 r/min离心1 ~ 20 min,离心时的温度为0 ~ 10℃;低温离心可以保证检测精密度。低温离心的条件进一步优选为14000 r/min离心5 ~ 20 min。
38.作为本技术实施例的一种改进,离心后取上清液干燥,优选为氮气吹干,然后加复溶液混合进行复溶,上清液和复溶液的体积比为2 ~ 20:1,优选为1 ~ 5:1,更优选为3:1。例如,离心完毕后取上清300 μl氮气吹干,加入100 μl复溶液复溶。加入复溶液混合的条件为2000 ~ 3000 r/min涡旋混合1 ~ 10分钟,优选为2500 r/min涡旋混合1 ~ 5分钟。混合后以12000 ~ 16000 r/min离心1 ~ 20 min,离心时的温度为0 ~ 10℃,优选以14000 r/min离心5 ~ 10 min。
39.综合验证试验,采用上述前处理方法的回收率和精密度等各项技术指标均符合要求,方法检测血液中抗生素含量,重现性良好,加样回收率高,提高了检测结果的准确度。
40.作为本技术实施例的一种改进,在s12和s3中,高效液相色谱质谱联用仪中,色谱分析所使用的色谱柱选自c18柱;经实验验证,本发明实施例的方法在多种c18柱上均能获得较好的检测结果,例如:poroshell 120 ec-c18(2.7 μm 100
×
3.0 mm);kinetex c18(2.6 μm 100
×
3.0mm);eclipse plus c18(3.5 μm,4.6
×
100 mm),并不限于此。
41.液相分析条件如下:流动相:a相:含0.01% ~ 1%(体积百分比)甲酸的水;b相:甲醇;流速:0.3 ~ 0.7 ml/min;柱温:30 ~ 50℃;
进样量:1 ~ 50 μl;分析时间:5 ~ 10 min。
42.作为本技术实施例的一种改进,在s12和s3中,梯度洗脱的具体条件为:第一分析阶段:a相75%~60%,b相25%~40%;第二分析阶段:a相75%~60%变化到35%~15%,b相25~40%变化到65%~85%;第三分析阶段:a相35%~15%,b相65~85%;柱清洗阶段:a相10% ~ 0%,b相90%~100%;再平衡阶段:a相75%~60%,b相25%~40%。
43.作为本技术实施例的一种改进,在s12和s3中,高效液相色谱质谱联用仪的质谱检测条件为:雾化气(nebulizing gas flow):1 ~ 3 l/min;加热气(heating gas flow):5 ~ 20 l/min;源温(interface temperature):200 ~ 400℃;脱溶剂管温度(dl temperature):100 ~ 300 ℃;加热块温度(heat block temperature):200 ~ 400 ℃;干燥器温度(drying gas flow):2 ~ 20 l/min。
44.采用mrm正负混合采集模式检测,所检测的离子对为:正离子模式:阿莫西林:366
→
114,ce:-23;阿莫西林-d4:370
→
353.2,ce:-10;磺胺噻唑:256
→
156,ce:-15;磺胺噻唑-13c6:262
→
162,ce:-15;左氧氟沙星:362
→
318.2,ce:-19;左氧氟沙星-d8:370
→
326.2,ce:-19;林可霉素:407.1
→
126.2,ce:-30;林可霉素-d3:410
→
362,ce:-19;磺胺嘧啶:251
→
92.1,ce:-28;磺胺嘧啶-13c6:257
→
162.1,ce:-16;诺氟沙星:320
→
302.1,ce:-18;诺氟沙星-d5:325
→
307.1,ce:-18;磺胺吡啶:250
→
156,ce:-15;磺胺吡啶-13c6:256
→
162,ce:-15;环丙沙星:332
→
314.2,ce:-23;环丙沙星-d8:340
→
322,ce:-23;四环素:445
→
410.1,ce:-20;四环素-d6:451
→
433.2,ce:-14;头孢噻肟:456.1
→
125.2,ce:-36;头孢噻肟-d3:459.1
→
125.2,ce:-36;土霉素:461
→
426.1,ce:-20;磺胺二甲嘧啶:279
→
186,ce:-16;磺胺二甲嘧啶-d4:283
→
186,ce:-16;氨苄西林:350.1
→
106.1,ce:-21;氨苄西林-d5:355.1
→
111.1,ce:-21;金霉素:479
→
444,ce:-22;金霉素-13c,d3:483
→
448,ce:-22;头孢噻吩:419
→
359,ce:-13;青霉素:335
→
176,ce:-13;青霉素-d7:342
→
183,ce:-13;苯唑西林:402
→
160,ce:-17;苯唑西林-d5:407
→
248.2,ce:-15;负离子模式:氯霉素:321.1
→
152.1,ce:16;氯霉素-d5:326.1
→
262,ce:11。本发明实施例的第二方面还提出了一种检测血液中18种抗生素的试剂盒,该试剂盒可用于同时检测18种抗生素,具体包括阿莫西林、磺胺噻唑、左氧氟沙星、林可霉素、磺胺嘧啶、诺氟沙星、磺胺吡啶、
环丙沙星、四环素、头孢噻肟、土霉素、磺胺二甲嘧啶、氨苄西林、金霉素、头孢噻吩、青霉素、苯唑西林和氯霉素。该试剂盒配合高效液相色谱质谱联用仪使用。具体的,该试剂盒包括蛋白沉淀液、复溶液、流动相、梯度浓度的混合标准工作液、混合内标工作液;前处理试剂包括乙腈和水;乙腈和水独立包装,每人份的体积比为2 ~ 20:1;复溶液选自体积百分比浓度为50% ~ 100%的甲醇水溶液;流动相包括流动相a和流动相b,流动相a为含0.01% ~ 1%甲酸的水,流动相b为甲醇;混合标准工作液中含有阿莫西林标准品、磺胺噻唑标准品、左氧氟沙星标准品、林可霉素标准品、磺胺嘧啶标准品、诺氟沙星标准品、磺胺吡啶标准品、环丙沙星标准品、四环素标准品、头孢噻肟标准品、土霉素标准品、磺胺二甲嘧啶标准品、氨苄西林标准品、金霉素标准品、头孢噻吩标准品、青霉素标准品、苯唑西林标准品和氯霉素标准品,采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成;梯度浓度的混合标准工作液的具体浓度梯度可以为:1.0 ng/ml,2.0 ng/ml,4.0 ng/ml,8.0 ng/ml,16.0 ng/ml,32.0 ng/ml,64.0 ng/ml。混合内标工作液采用体积百分比浓度为50% ~ 100%的甲醇水溶液配制而成,16种同位素内标的标准品包括:阿莫西林-d4标准品、磺胺噻唑-13c6标准品、左氧氟沙星-d8标准品、林可霉素-d3标准品、磺胺嘧啶-13c6标准品、诺氟沙星-d5标准品、磺胺吡啶-13c6标准品、环丙沙星-d8标准品、四环素-d6标准品、头孢噻肟-d3标准品、磺胺二甲嘧啶-d4标准品、氨苄西林-d5标准品、金霉素-13c,d3标准品、青霉素-d7标准品、苯唑西林-d5标准品和氯霉素-d5标准品。
45.该试剂盒的具体使用方法同本发明实施例第一方面提出的液相色谱串联质谱法检测血液中18种抗生素的方法。该试剂盒具有成本低、操作简便,检测的准确度和精密度良好的技术优势。
46.本发明实施例的第三方面还提出了上述第一方面的方法在监测18种抗生素血药浓度中的应用,18种抗生素为阿莫西林、磺胺噻唑、左氧氟沙星、林可霉素、磺胺嘧啶、诺氟沙星、磺胺吡啶、环丙沙星、四环素、头孢噻肟、土霉素、磺胺二甲嘧啶、氨苄西林、金霉素、头孢噻吩、青霉素、苯唑西林和氯霉素。在进行血药浓度检测时,具有灵敏度高、准确性高、检测速度快、高通量检测的技术优势。本发明实施例的应用可保障抗生素用药安全,为抗生素使用的监督管理提供有效的检测手段。
47.下面通过具体实施对本发明实施例的技术方案做进一步的解释和说明,本发明的原料均为市售。所采用的主要原料和仪器如下:1、仪器设备:(1)液质联用仪:lcms-8050cl,岛津,日本;(2)离心机:eppendorf 5804r 高速离心机,eppendorf ag,美国;sartorius α-14c 高速离心机,satorius,德国;(3)氮吹仪:md200-2,杭州奥盛,中国;(4)旋涡混匀器:mix-25p,miulab,中国;(5)超纯水仪:cascadaii i-10,pall,美国。
48.2、其他试剂来源:(1)乙腈:hplc级,fisher,4 l;
(2)甲醇:hplc级,merck,4 l;(3)甲酸:lcms级,fisher,50 ml。
49.实施例1本实施例提出液相色谱串联质谱法检测血液中18种抗生素的方法。
50.(一)标准溶液的标定首先用移液器分别移取50 μl标准工作液、50 μl内标工作液分别置于1.5ml离心管中混合制成7种不同浓度的标准溶液,将上述标准溶液分别在转速为2500 r/min涡旋混匀1 min,吸取混合液100
ꢀµ
l,转移至96孔板。
51.利用高效液相色谱质谱联用仪对上述溶液进行检测,得到7种不同浓度的抗生素和内标物的标准溶液色谱图,从上述抗生素和内标物的标准溶液色谱图中分别得到抗生素和内标物的峰面积,分别以上述7个不同浓度的抗生素标准溶液的峰面积与内标物峰面积的比值作为标准曲线方程的纵坐标y1,以上述抗生素标准工作液中的浓度与内标工作液浓度的比值为作为标准曲线方程的横坐标x1,将以上检测所得的18种不同浓度的数据进行线性回归,拟合得到18个标准曲线方程为y1=a1*x
1 + b1,y2=a2*x
2 + b2,
……
,y
18
=a
18
*x
18 + b
18
并且得出线性方程系数a1~a
18
、b1~b
18
;标准工作液为含有18种抗生素的混合溶液,内标工作液为含有16种同位素内标的混合溶液。
52.标准储备液的配制:天平精密称量各个抗生素的标准品,溶于适量50%甲醇水中,混合均匀得到浓度均为100 μg/ml各个抗生素标准品单标储备液,-80℃保存。
53.混合标准中间液的配制:适量移取各个抗生素标准品单标储备液于同一离心管中,再加入适量50%甲醇水,混合均匀得到混合标准中间液。-80℃保存。混合标准中间液浓度各个抗生素浓度为1000 ng/ml。-80℃保存。
54.混合标准工作液的配制:适量移取混合标准中间液于1.5 ml离心管中,再加入适量50%甲醇水稀释,混合均匀得到级别为l7的标准工作液,然后继续用上述50%甲醇水溶液进行逐级稀释,得到级别为l1~l6标准工作液,并在-20℃条件下保存,各抗生素各级混合标准工作液浓度分别为1.0 ng/ml,2.0 ng/ml,4.0 ng/ml,8.0 ng/ml,16.0 ng/ml,32.0 ng/ml,64.0 ng/ml。-80℃保存。
55.内标储备液的配制:天平精密称量各个抗生素同位素内标的标准品,溶于适量50%甲醇水中,混合均匀得到浓度均为100 μg/ml各个抗生素同位素内标的单标储备液,-80℃保存。
56.混合内标工作液的配制:适量移取各个抗生素同位素内标的单标储备液于同一离心管中,再加入适量50%甲醇水,混合均匀得到混合内标工作液。80℃保存。混合内标工作液中各个抗生素内标浓度均为8.0 ng/ml。
57.(二)待测样品处理用移液枪移取50 μl血清或血浆样本于1.5 ml离心管中,再加入50 μl内标工作液,加入50 μl水后2500 r/min混匀1 min,再加入300 μl乙腈后2500 r/min混匀10 min,再以14000 r/min低温离心10 min,离心完毕后取上清300 μl氮气吹干,加入100 μl的50%甲醇水复溶后2500 r/min混匀1 min,再以14000 r/min于低温离心10 min,取100 μl上清液转移至96孔板。
58.(三)待测样品的检测
使用高效液相色谱质谱联用仪对上述步骤(二)待测的样品进行检测,得出上述待测样品的18种抗生素与内标的色谱图,从上述18种抗生素与内标色谱图中可以得到18种抗生素目标物与内标物峰面积,分别将18种抗生素目标物与内标物峰面积的比值y1~y
18
代入上述步骤(一)的标准曲线方程y1=a1*x1+b1,y2=a2*x2+b2,
……
,y
18
=a
18
*x
18
+b
18
,通过计算得到待检测样品中18种抗生素目标物与内标物浓度的比值x1~x
18
,因内标物工作液浓度已知,由此可计算得到该待检测血液样本中的18种抗生素的浓度。
59.本发明实施例提出具体的检测条件如下:液相条件;流动相a:水(含0.1%甲酸);流动相b:甲醇;初始流速:0.5ml/min;色谱柱:eclipse plus c18(3.5 μm,4.6
×
100 mm);柱温:45℃;进样量:30 μl;梯度变化:第一分析阶段:0.00~2.00min,a相68%,b相32%;第二分析阶段:2.01~4.00min,a相68%变化到25%,b相32%变化到75%;第三分析阶段:4.01~6.50min,a相25%,b相75%;柱清洗阶段:6.51~7.50min,a相0%,b相100%;再平衡阶段:7.51~9.00min,a相68%,b相32%。
60.质谱检测条件:esi源参数:雾化气(nebulizing gas flow):3 l/min;加热气(heating gas flow):20 l/min;源温(interface temperature):350℃;脱溶剂管温度(dl temperature):250 ℃;加热块温度(heat block temperature):400 ℃;干燥器温度(drying gas flow):10 l/min。
61.mrm正负混合采集模式检测离子对:正离子模式:阿莫西林:366
→
114,ce:-23;阿莫西林-d4:370
→
353.2,ce:-10;磺胺噻唑:256
→
156,ce:-15;磺胺噻唑-13c6:262
→
162,ce:-15;左氧氟沙星:362
→
318.2,ce:-19;左氧氟沙星-d8:370
→
326.2,ce:-19;林可霉素:407.1
→
126.2,ce:-30;林可霉素-d3:410
→
362,ce:-19;磺胺嘧啶:251
→
92.1,ce:-28;磺胺嘧啶-13c6:257
→
162.1,ce:-16;诺氟沙星:320
→
302.1,ce:-18;诺氟沙星-d5:325
→
307.1,ce:-18;磺胺吡啶:250
→
156,ce:-15;磺胺吡啶-13c6:256
→
162,ce:-15;环丙沙星:332
→
314.2,ce:-23;环丙沙星-d8:340
→
322,ce:-23;四环素:445
→
410.1,ce:-20;四环素-d6:451
→
433.2,ce:-14;头孢噻肟:456.1
→
125.2,ce:-36;头孢噻肟-d3:459.1
→
125.2,ce:-36;土霉素:461
→
426.1,ce:-20;磺胺二甲嘧啶:279
→
186,ce:-16;磺胺二甲嘧啶-d4:283
→
186,ce:-16;氨苄西林:350.1
→
106.1,ce:-21;氨苄西林-d5:355.1
→
111.1,ce:-21;金霉素:479
→
444,ce:-22;金霉素-13c,d3:483
→
448,ce:-22;
头孢噻吩:419
→
359,ce:-13;青霉素:335
→
176,ce:-13;青霉素-d7:342
→
183,ce:-13;苯唑西林:402
→
160,ce:-17;苯唑西林-d5:407
→
248.2,ce:-15;负离子模式:氯霉素:321.1
→
152.1,ce:16;氯霉素-d5:326.1
→
262,ce:11。
62.采用上述方法检测标准溶液的色谱图如图1所示,检测添加血清样本的色谱图如图2所示。
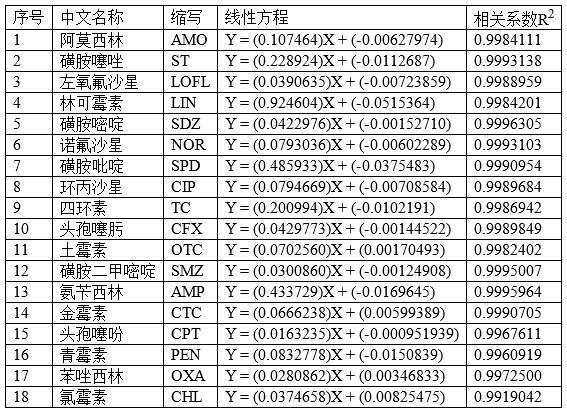
63.实施例2本实施例用于说明实施例1方法的线性范围:采用本发明实施例2中的方法,对标准标准溶液进行检测,计算得到的线性方程如表1所示:表118种抗生素的线性范围均为:1 ~ 64 ng/ml。
64.如表1所示,18种抗生素线性良好,相关系数r2》0.99。满足检测要求。
65.定量下限如表2所示:表2
如表2所示,18种抗生素线定量下限均为1 ng/ml,满足检测要求。
66.实施例3本实施例用于说明实施例1方法的回收率:分别取抗生素标准工作液配制成低、中、高3种浓度进行添加回收率实验,按实施例1的方法每个浓度样本平行前处理3个进行测定,抗生素回收率如表3~表5所示。
67.表3表4
表5本发明实施例中18种抗生素的平均回收率在85.43% ~ 112.23%,由此可见本发明实施例方法的回收率良好。
68.实施例4本实施例用于说明实施例1方法的精密度:分别取抗生素标准工作液配制成低、中、高3种浓度进行添加回收率实验,按实施例1的方法进行检测,得到精密度结果如表6~表8所示:表6表7表8根据表6~表8的结果可知,本技术18种抗生素的离心精密度(cv)在0.39% ~ 7.08%,由此可见本技术的精密度良好。
69.实施例5
相同检测条件下,不同品牌规格c18色谱柱的色谱图如图3,图4所示:按照实施例1的方法,采用kinetex c18(2.6 μm,100
×
3.0 mm)色谱柱进行检测,得到色谱图如图3所示。按照实施例1的方法,采用poroshell 120 ec-c18(2.7 μm,100
×
3.0 mm)色谱柱进行检测,得到色谱图如图4所示。
70.如图3、图4所示,出峰顺序和峰形与实施例1相似,证明本技术方法对于c18类型的色谱柱具有很好的耐用性。
71.实施例6按照实施例1的方法进行检测,区别在于改变流动相a的组成:1、流动相a采用1%甲酸水溶液,色谱图如图5所示:2、流动相a采用0.01%的甲酸水,色谱图如图6所示:实验发现本检测条件下,通过色谱图能发现,对于酸度耐用较好,在0.01%~1%的甲酸条件下均有良好的峰形。
72.实施例7本实施例用于说明不同梯度洗脱的耐用性效果。
73.采用按照实施例1的方法进行检测,区别仅在于:对比了尝试4种不同的洗脱梯度,具体设计如下:第一分析阶段:0 ~ 2.00 min,a相依次尝试75%,70%,65%,60%,相应的b相依次为25%,30%,35%,40%;第二分析阶段:2.01 ~4.00 min,a相依次尝试75%,70%,65%,60%变化到35%,30%,20%,15%,相应的b相依次为25%,30%,35%,40%变化到65%,70%,80%,85%;第三分析阶段:4.01 ~ 6.50 min,a相依次尝试35%,30%,20%,15%,相应的b相依次为65%,70%,80%,85%;柱清洗阶段:6.51 ~ 7.50 min,a相0%,b相100%;再平衡阶段:7.51 ~ 9.00 min,a相依次尝试75%,70%,65%,60%,相应的b相依次为25%,30%,35%,40%。
74.得到实验结果如图7~图10所示。根据4个色谱图,可发现在不同梯度下的出峰顺序基本一致,前后保留时间差别不大,梯度耐用性良好。
75.实施例8本实施例用于说明不同流速的耐用性效果。
76.采用按照实施例1的方法进行检测,区别仅在于:对比了尝试4种不同的流速,依次为0.7 ml/min,0.6 ml/min,0.4 ml/min,0.3 ml/min。得到实验结果如图11~图14所示。
77.根据4个色谱图,可发现在不同流速下的出峰顺序基本一致,前后保留时间差别不大,流速耐用性良好。
78.对比例1:本对比例用于比较低温离心的对精密度的影响。
79.按照实施例1的方法进行检测,区别仅在于前处理条件中离心步骤在室温下进行。得到精密度实验数据如表9~表11所示。
80.表9
表10表11根据表9~表11可知,常温离心精密度(cv)在1.55%~12.04%,由此可见本技术的前处理使用低温离心能够有效的增加检测方法的精密度。
81.对比例2:本对比例用于比较不同色谱柱对检测的影响。
82.按照实施例1的方法进行检测,区别仅在于选择相同规格不同填料的色谱柱,在相同的检测条件下对比。图15为kinetex f5(2.6 μm,100
×
3.0 mm)色谱柱检测结果,图16为kinetex phenyl-hexyl(2.6 μm,100
×
3.0 mm)色谱柱检测结果。
83.由色谱图得知,18种抗生素在五氟苯基柱和苯基己基柱下的保留行为与c18柱截然不同,同时峰有所展宽,响应降低。
84.对比例3:本对比例用于比较不同前处理试剂的前处理效果。
85.采用按照实施例1的方法进行检测,区别仅在于:对比7种不同的前处理方式,对前处理试剂的具体设计如下:1、甲醇组:具体前处理方式为:用移液枪移取50 μl血清或血浆样本于1.5 ml离心管中,再加入50 μl内标工作液,加入300 μl甲醇后2500 r/min混匀10 min,然后按照实施例1方法继续处理;2、乙醇组:具体前处理方式为:用移液枪移取50 μl血清或血浆样本于1.5 ml离心
管中,再加入50 μl内标工作液,加入300 μl乙醇后2500 r/min混匀10 min,然后按照实施例1方法继续处理;3、异丙醇组:具体前处理方式为:用移液枪移取50 μl血清或血浆样本于1.5 ml离心管中,再加入50 μl内标工作液,加入300 μl异丙醇后2500 r/min混匀10 min,然后按照实施例1方法继续处理;4、乙腈组:具体前处理方式为:用移液枪移取50 μl血清或血浆样本于1.5 ml离心管中,再加入50 μl内标工作液,加入300 μl乙腈后2500 r/min混匀10 min,然后按照实施例1方法继续处理;5、水+甲醇组:具体前处理方式为:用移液枪移取50 μl血清或血浆样本于1.5 ml离心管中,再加入50 μl内标工作液,加入50 μl水后2500 r/min混匀1 min,再加入300 μl甲醇后2500 r/min混匀10 min;然后按照实施例1方法继续处理;6、水+乙醇组:具体前处理方式为:用移液枪移取50 μl血清或血浆样本于1.5 ml离心管中,再加入50 μl内标工作液,加入50 μl水后2500 r/min混匀1 min,再加入300 μl乙醇后2500 r/min混匀10 min;然后按照实施例1方法继续处理;7、水+异丙醇组:具体前处理方式为:用移液枪移取50 μl血清或血浆样本于1.5 ml离心管中,再加入50 μl内标工作液,加入50 μl水后2500 r/min混匀1 min,再加入300 μl异丙醇后2500 r/min混匀10 min;然后按照实施例1方法继续处理;8、水+乙腈组:为实施例1方法。
86.取抗生素标准工作液配制成浓度为16 ng/ml的样本进行提取回收率实验,得到不同前处理试剂下的提取回收率如表12~表14所示。
87.表12表13
表14由表12~表14可知,水+乙腈组对于18种抗生素的提取回收率在12.86% ~ 98.24%之间,前处理效果最好。
88.以上所述仅是本发明的具体实施方式,使本领域技术人员能够理解或实现本发明。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所述的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1