细胞流式分选装置
1.本发明涉及生物颗粒检测及操控技术领域,尤其是涉及细胞流式分选装置。
背景技术:
2.循环肿瘤细胞(circulating tumor cell,ctc)是指由于主动脱落或手术操作等内外部因素,从肿瘤原发灶或转移部位掉落至外周循环血中的肿瘤细胞,在肿瘤转移中发挥决定性作用。由于ctc保留了完整的来源组织信息,且与肿瘤转移关系密切,加之其主要存在于外周血中,取样简单无创,可重复检测,因此ctc检测在肿瘤的早期诊断、疗效监测、预后评估以及转移机制研究等方面均具有重要价值。进一步的,进行外周血单个ctc分选和单细胞dna测序分析,可以从单细胞水平探究肿瘤转移机制。
3.从细胞分选技术来看,根据不同的细胞特性和丰度,可被分为无标记法分选和有标记法分选。无标记法利用细胞的物理性质如大小、形状、密度、黏附力、可变形性、介电性、表面亲和力等进行区分。分离方法包括膜过滤法、密度梯度离心、流体动力法、介电泳法等。此类方法的缺点在于无法区分物理性质类似但生物特性不同的细胞。有标记法包括采用生物标记的磁激活细胞分选法(magnetically-activated cell sorting,macs)、荧光激活细胞分选法(fluorescence-activated cell sorting,facs)。荧光激活细胞分离的主要缺陷在于较高的系统工作压力影响细胞活性,影响后续的生化和基因检测。磁性激活细胞分选过程中需要涉及多次的细胞冲洗操作,使得细胞的捕获效率较低。
4.强生公司开发的cellsearch设备得到了美国食品药品监督管理局(food and drug administration,fda)的批准投入临床应用。设计原理综合了荧光激活细胞与磁性激活细胞分选技术,利用免疫纳米磁颗粒来富集上皮来源细胞。由于纳米磁颗粒外部包被有抗epcam的特异性抗体,利用抗原抗体反应,纳米磁颗粒会吸引血液中所苻表达epcam的细胞,同时结合荧光染料抗体与荧光染色剂来识别循环肿瘤细胞,实现循环肿瘤细胞的富集与检测。该仪器富集后的循环肿瘤细胞会失去活性,不能用于后续的细胞生物特性研究。
5.基于微流控芯片的ctc检测技术因具有高通量、集成化、低成本、易于即时检验等优势而逐渐成为研究的热点。然而,常见的几种方法,例如密度梯度分离和基于ctc表面标志物上皮细胞黏附分子(epithelial cell adhesion molecule,ep cam)的分离等,仍具有一定的局限性,包括分离效率不高,纯度不高、细胞丢失以及流体剪切力等因素造成的细胞损伤,为分离ctc的进一步研究,如单细胞测序带来难题。
技术实现要素:
6.为了克服现有技术的不足,本发明的目的之一在于提供一种可用于单细胞测序的细胞流式分选装置,能够避免分离效率不高,纯度不高、细胞丢失、细胞损伤等问题。
7.本发明的目的之一采用如下技术方案实现:
8.一种细胞流式分选装置,设有流道,所述流道设有粗筛区、精筛区以及配分区,所述粗筛区、所述精筛区以及所述配分区依次连通,所述粗筛区与进样口连通,样品从所述进
样口进入所述粗筛区,所述粗筛区将特定尺寸的细胞筛选出,特定尺寸的细胞进入所述精筛区,所述精筛区设有识别结构,所述识别结构从所述特定尺寸的细胞中识别待分选细胞,待分选细胞进入所述配分区,所述配分区包括挤压部以及喷嘴,包含待分选细胞的液体在所述挤压部以及所述喷嘴的作用下形成滴液流出。
9.进一步的,所述粗筛区还设有鞘液入口,鞘液通过所述鞘液入口进入所述粗筛区,鞘液对所述特定尺寸的细胞进行清洗。
10.进一步的,所述鞘液入口位于所述粗筛区的中部,所述进样口位于所述粗筛区的侧部,特定尺寸的细胞穿过鞘液后聚集在粗筛区的特定位置。
11.进一步的,所述粗筛区还包括第一驱动器,所述第一驱动器安装于所述粗筛区的流道上,所述第一驱动器驱动特定尺寸的细胞聚集在粗筛区的特定位置。
12.进一步的,所述第一驱动器为压电驱动器,在所述压电驱动器的激励下,粗筛区的流道在宽度方向上产生振动,流道内建立起驻波,特定尺寸的细胞产生向驻波节线的移动。
13.进一步的,所述识别结构为激光检测结构,所述激光检测结构采用流式荧光检测来识别待分选细胞。
14.进一步的,所述精筛区还设有第二驱动器,所述第二驱动器位于所述精筛区的流道上,所述第二驱动器驱动待分选细胞进入所述配分区。
15.进一步的,所述配分区包括挤压部、与所述挤压部连通的主流道以及与所述主流道连接的喷嘴,所述挤压部的横截面尺寸大于所述主流道的横截面尺寸,所述配分区还包括第三驱动器以及第四驱动器,所述第三驱动器安装于所述挤压部并挤压所述挤压部,所述第四驱动器安装于所述主流道,所述第三驱动器以及所述喷嘴使所述流道中的液体呈滴液流出,所述第四驱动器产生驻波声场将细胞聚焦于流道中心位置。
16.进一步的,所述配分区还包括探测装置,所述探测装置探测滴液中是否包括待分选细胞。
17.进一步的,所述细胞流式分选装置还包括孔板,所述孔板的驱动结构与所述探测装置通信连接,所述驱动结构驱动所述孔板收集含有待分选细胞的滴液。
18.相比现有技术,本发明细胞流式分选装置使用时样品从进样口进入粗筛区,粗筛区将特定尺寸的细胞筛选出,特定尺寸的细胞进入精筛区,精筛区设有识别结构,识别结构从特定尺寸的细胞中识别待分选细胞,待分选细胞进入配分区,配分区包括挤压部以及喷嘴,包含待分选细胞的液体在挤压部以及喷嘴的作用下形成滴液流出,通过上述设计,实现全血中的循环肿瘤细胞的检测、分选与配发,最终从全血样本中得到单液滴包裹的循环肿瘤细胞,在实现循环肿瘤细胞计数的同时能够得到活性较高的细胞,用于后续生物学检测;并且可采用全血上样直接获得目标单细胞,人工操作简单。
附图说明
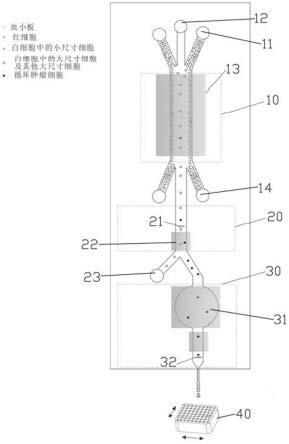
19.图1为本发明细胞流式分选装置的结构示意图;
20.图2为本发明细胞流式分选装置的细胞粗筛过程示意图;
21.图3为本发明细胞流式分选装置的精筛过程示意图;
22.图4为本发明细胞流式分选装置的目标细胞配发过程示意图。
23.图中:10、粗筛区;11、进样口;12、鞘液入口;13、第一驱动器;14、第一废液口;20、
精筛区;21、识别结构;22、第二驱动器;23、第二废液口;30、配分区;31、挤压部;32、探测装置;33、主流道;34、喷嘴;35、第三驱动器;36、第四驱动器;40、孔板。
具体实施方式
24.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
25.需要说明的是,当组件被称为“固定于”另一个组件,它可以直接在另一个组件上或者也可以存在另一中间组件,通过中间组件固定。当一个组件被认为是“连接”另一个组件,它可以是直接连接到另一个组件或者可能同时存在另一中间组件。当一个组件被认为是“设置于”另一个组件,它可以是直接设置在另一个组件上或者可能同时存在另一中间组件。本文所使用的术语“垂直的”、“水平的”、“左”、“右”以及类似的表述只是为了说明的目的。
26.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
27.如图1所示,本发明细胞流式分选装置用于从样品中分选特定细胞,并使特定细胞最终形成单液滴包裹的状态,以便于后续生物学检测。在本实施例中,样品为全血,特定细胞为循环肿瘤细胞。
28.本发明细胞流式分选装置包括主体以及孔板40,主体包括基片和盖片,基片采用硅片或者玻璃片,底面开设有管道凹槽。盖片密封贴附于基片上,使处于盖片和基片之间的管道凹槽形成流道结构。盖片可为玻璃、塑料或聚合物等材质,需透光。流道结构内的流体始终保持层流状态。流道上依次设有粗筛区10、精筛区20以及配分区30。
29.请继续参阅图2,粗筛区10用于实现流道内的尺寸较大的颗粒穿越鞘液层后聚焦在流道的特定位置。粗筛区10的一端设有进样口11以及鞘液入口12,粗筛区10的另一端设有第一废液口14,并且粗筛区10的另一端与精筛区20连通。进样口11用于血液进入,鞘液入口12用于鞘液进入。具体的,进样口11的数量为两个,鞘液入口12位于两进样口11之间,这种位置设计使尺寸较大的颗粒聚焦在流道的特定位置过程中需要穿越鞘液,得到清洗。粗筛区10还包括第一驱动器13,第一驱动器13为压电驱动器,第一驱动器13产生一个维度方向上的声体驻波,驱动颗粒移动到位于流道中特定位置的驻波节点。在压电驱动器的激励下,流道在宽度方向上产生振动,流道内建立起驻波,颗粒会产生向驻波节线的移动。由于第一驱动器13激励波长为宽度尺寸的2倍,会在流道宽度中心位置建立起一条驻波节线,颗粒就会向该位置移动,如图2。去除特定尺寸细胞的血液通过第一废液口14被排出或存储。
30.具体的,染色后的血样从进样口11进入,鞘液从鞘液入口12进入,按照层流,分别在各自的流线上流动。由于声波的作用,细胞会受到声辐射力的作用产生向驻波节线的移动,声辐射力与细胞体积成正比,尺寸较大的细胞受到的声辐射力也越大,所以只要控制好压电驱动器的驱动电压和声波作用区的长度,就能保证在粗筛环节只有尺寸较大的细胞
(直径大于15μm)会穿越鞘液层到达驻波节线位置。
31.循环肿瘤细胞的尺寸通常大于15μm,这些尺寸较大的细胞到达节线后会呈现列队前进的聚焦状态。同时他们在穿过鞘液层时可以起到洗涤抗体的作用。尺寸较小的细胞以及血小板进入两边的第一废液口14。基于细胞尺寸的粗筛也可以有多种别的办法,例如采用惯性流和介电力的方法。
32.请继续参阅图3,精筛区20用于筛选特定尺寸细胞中的待选细胞。精筛区20包括识别结构21、第二驱动器22以及第二废液口23。识别结构21为激光检测点,采用流式荧光检测来识别循环肿瘤细胞(待分选细胞);当检测到目标细胞时,产生脉冲分选信号对细胞进行靶向分选。本实施例中,由于大尺寸的细胞在粗筛前级已经形成了单列流动的聚焦状态,进入精筛区20后可直接进行激光检测,针对循环肿瘤细胞的特异性抗体组合为epcam+ck+dapi+cd45-,满足上述条件的细胞才会被分选出来。本实施例中,在流道上设置有一个第二驱动器22(压电驱动器单元),加载电压后其在主流道宽度范围内形成两条驻波节线(如图3),用于使目标颗粒受力流入到目标支路中,废液从废液口23流出从而实现分选。此处的靶向分选也可采用介电或者其他方式。
33.在其他实施例中,精筛区20的检测方案还可通过一检测模块实现,该检测模块包括光斑激发调制系统、光信号检测系统、数据采集分析与控制模块、压电驱动模块,该方案在专利“稀有细胞筛选的微流控芯片系统”中得到应用,实现特定细胞的筛选。
34.请继续参阅图4,配分区30用于将包含待分选细胞的液体形成滴液流出。配分区30包括挤压部31、探测装置32、主流道33、喷嘴34、第三驱动器35以及第四驱动器36。挤压部31、主流道33以及喷嘴34依次设置。挤压部31的截面积大于主流道33的截面积,喷嘴34位于配分区30末端。在本实施例中,挤压部31呈圆形。第三驱动器35以及第四驱动器36分别为压电驱动器,第三驱动器35安装于挤压部31对应的主体表面,在压电驱动器的往复振动下,挤压部31会发生往复形变。第三驱动器35以及喷嘴34使包含待分选细胞的液体流出喷嘴后会被打散为液滴,细胞被包裹在液滴中。第四驱动器36安装于主流道33,第四驱动器36为压电驱动器,第四驱动器36产生驻波声场(驱动器激励波长为宽度尺寸的2倍)将细胞聚焦于主流道33中心位置。探测装置32产生激光,细胞受激光照射发出散射光,对前向散射光进行探测从而可以感知到细胞到来。通过建立液滴生成时序与细胞检测时序之间的关系判断细胞所处的液滴。喷嘴34直接从主体侧面引出,喷口周围的侧壁可做疏水处理避免液滴粘连。
35.孔板40设有若干收集孔,孔板40的驱动结构与探测装置32电信连接,根据探测装置32的判断结果,驱动结构驱动孔板40移动,收集含有待分选细胞的滴液。
36.本发明细胞流式分选装置使用时样品从进样口11进入粗筛区10,粗筛区10将特定尺寸的细胞筛选出,特定尺寸的细胞进入精筛区20,精筛区20设有识别结构21,识别结构21从特定尺寸的细胞中识别待分选细胞,待分选细胞进入配分区30,配分区30包括挤压部31以及喷嘴34,包含待分选细胞的液体在挤压部31以及喷嘴34的作用下形成滴液流出,通过上述设计,实现全血中的循环肿瘤细胞的检测、分选与配发,最终从全血样本中得到单液滴包裹的循环肿瘤细胞,在实现循环肿瘤细胞计数的同时能够得到活性较高的细胞,用于后续生物学检测;并且可采用全血上样直接获得目标单细胞,人工操作简单。
37.以上实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在
不脱离本发明构思的前提下,还可以做出若干变形和改进演变,都是依据本发明实质技术对以上实施例做的等同修饰与演变,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1