化合物下拉靶点蛋白的方法
1.本发明涉及生物技术领域,特别涉及一种化合物下拉靶点蛋白的方法。
背景技术:
2.蛋白质是组成人体一切细胞、组织的重要成分,是细胞功能的主要行使者,其调节转录、翻译、细胞周期、dna复制等功能,对维持正常的细胞功能、控制细胞之间的通讯并允许细胞适应环境的变化具有重要意义。外源化合物影响机体的重要作用途径,是通过与蛋白质等大分子相互作用,扰动生物分子间相互作用网络动态调整机制,随之触发后续的细胞信号传导等一系列级联响应和细胞、组织、器官等多层次的关键事件而产生的。外源化合物蛋白作用靶点的研究能够为其作用机理提供突破口。
3.在日益突出的环境问题中,污染物在生物体内潜在蛋白靶点的甄别,远远落后于对其毒性效应的检测;在新药研发中,寻找未知蛋白靶点是药物研发中药理和毒理解释不可或缺的环节。生物素—亲和素系统是70年代末发展起来的一种新型生物反应放大系统,由于其优越的灵敏度、特异性、稳定性等在外源化合物靶点蛋白的探索中显示出巨大的潜力。然而,此系统在化合物—靶点蛋白相互作用中的应用还很局限,尤其是以化合物下拉蛋白,本身难以实现,成功率低,难以富集到足量的蛋白以供检测,因而使得其应用受到局限而使用者寥寥。目前还没有达到统一或最佳条件的规则,需要通过大量实验探索其起作用的实验方案。
技术实现要素:
4.有鉴于此,本发明的主要目的是提供一种化合物下拉靶点蛋白的方法,以期至少部分地解决上述提及的技术问题中的至少一种。
5.为实现上述目的,本发明的技术方案如下:
6.作为本发明的一个方面,提供一种化合物下拉靶点蛋白的方法,包括以下步骤:利用裂解液处理细胞得到细胞总蛋白,其中裂解液包括蛋白酶抑制剂;利用蛋白g/a磁珠对细胞总蛋白进行预处理,得到待测细胞总蛋白,以去除细胞总蛋白中非特异结合的蛋白;在含有牛血清蛋白的下拉缓冲液中利用生物素标记化合物对亲和素磁珠进行预处理,得到结合有生物素标记化合物的亲和素磁珠体,其中生物素标记化合物为生物素标记的化合物;将预处理后得到的亲和素磁珠体加至待测细胞总蛋白中进行孵育处理,得到捕获有特异性靶点蛋白的亲和素磁珠体;利用生物素或未被生物素标记的化合物对孵育处理后得到的亲和素磁珠体进行处理,得到目标下拉靶点蛋白。
7.基于上述技术方案,本发明提供的一种化合物下拉靶点蛋白的方法至少包括以下有益效果:
8.本发明提供的一种化合物下拉靶点蛋白的方法,基于生物素亲和素系统通过将蛋白g/a磁珠和亲和素磁珠连用,先利用含有蛋白酶抑制剂的裂解液获得细胞总蛋白,再利用蛋白g/a磁珠去除细胞总蛋白中的非特异性结合蛋白,避免了非特异性蛋白非特性的结合
到亲和素珠子上,为后续亲和素珠子包被生物素标记的低分子化合物来特异性捕获靶点蛋白提供有利条件,特异性高,再利用含有牛血清蛋白的下拉缓冲液处理生物素标记的低分子化合物和亲和素磁珠特异性捕获靶点蛋白,通过该方法的整个流程的优化实现了化合物下拉靶点蛋白,并进一步实现了以低分子量化合物下拉靶点蛋白。捕获靶点蛋白特异性高,周期短,操作简单,为化合物未知靶点的研究提供新的可行性方法。
附图说明
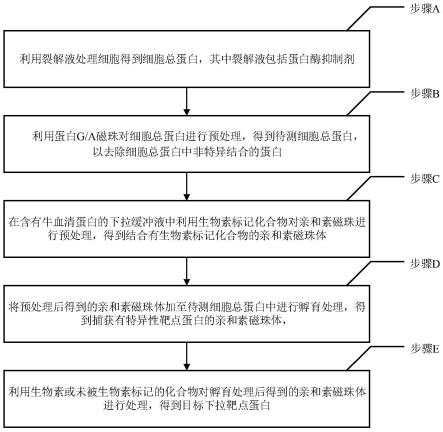
9.图1是本发明中化合物下拉靶点蛋白的方法的流程框图;
10.图2是本发明实施例中人诱导多能干细胞传代图;
11.图3是本发明实施例中人诱导多能干细胞生长状态图;
12.图4是本发明实施例和对比例以及蛋白标准品的蛋白条带银染图。
具体实施方式
13.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
14.在实现本发明的过程中发现,如何实现化合物下拉靶点蛋白,并且富集到足够检测的蛋白量是基于生物素亲和素系统的对下拉蛋白质靶点的特异性捕获的技术难点。本发明提供了一种化合物下拉靶点蛋白的方法,基于生物素亲和素系统通过将蛋白g/a磁珠和亲和素磁珠连用的方法,利用蛋白g/a磁珠去除细胞总蛋白中的非特异性结合蛋白,避免了非特异性蛋白非特性的结合到亲和素珠子上,为后续亲和素珠子包被生物素标记的低分子化合物来特异性捕获靶点蛋白提供有利条件,特异性高,再利用含有牛血清蛋白的下拉缓冲液处理生物素标记的化合物和亲和素磁珠体特异性捕获靶点蛋白,并进一步确定并优化了,使用何种细胞或组织类型、何种裂解缓冲液、用裂解液孵育珠子的时间以及洗涤的严格程度,通过该方法的整个流程实现了化合物下拉靶点蛋白,捕获靶点蛋白特异性高,特异性高,周期短。
15.为了进一步阐明本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为了进一步说明本发明的特征和优点,而不是对本发明权利要求的限制,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
16.除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中的较佳实施方法与材料仅作示范之用。此外,本文省略了对公知技术的描述,以避免不必要地混淆本发明的概念。
17.具体而言,根据本发明的一些实施例,提供了一种化合物下拉靶点蛋白的方法,包括以下步骤a~e(图1)。
18.步骤a:利用裂解液处理细胞得到细胞总蛋白,其中裂解液包括蛋白酶抑制剂。
19.根据本发明的实施例,本步骤中利用裂解液处理细胞得到细胞总蛋白是通过以下步骤a1~a2实现的。
20.在步骤a1中,利用低温离心的方法对培养后的细胞进行收集,其中,细胞的培养密
度优选为≥3.8
×
105个细胞/cm2,细胞包括哺乳动物细胞,优选为,人多能诱导干细胞
21.根据本发明的实施例,将长势良好的细胞从培养箱取出,弃去培养基,并加入磷酸盐缓冲液晃动清洗;弃去磷酸盐缓冲液,加入新的磷酸盐缓冲液,并使用细胞刮刀将细胞从培养皿底挂下,收集至离心管中;将细胞置于低温离心机,离心收集细胞;弃去离心后的上清液,并重新加入磷酸盐缓冲液重悬细胞,再次离心。
22.在步骤a2中,将收集的细胞利用裂解液进行裂解,得到细胞总蛋白,裂解的时间为10~30分钟。
23.根据本发明的实施例,弃尽上述离心后的上清液,加入含有蛋白酶抑制剂的ripa裂解液,吹打混匀,置于冰上裂解,将裂解完成的细胞置于低温离心机,高速离心,去除不可溶沉淀;取离心后上清液,为细胞总蛋白。
24.根据本发明的实施例,裂解时间过短(<10分钟),细胞裂解不彻底,裂解时间过长(>30分钟),蛋白会降解,不利于得到完整的蛋白,因此,裂解时间合适的范围为10~30分钟,例如为10分钟,20分钟,30分钟。
25.根据本发明的实施例,向裂解液中加入蛋白酶抑制剂用来抑制蛋白的降解,以保证蛋白的完整性。此外,使用含有蛋白酶抑制剂的ripa裂解液,还有利于充分裂解细胞膜蛋白,提高总蛋白含量,且避免由于蛋白收集损失带来的靶点检测误差。
26.根据本发明的实施例,使用的人诱导多能干细胞,该细胞更接近人早期胚胎发育阶段蛋白种类及占比,蛋白丰度好,有助于化合物下拉靶点蛋白过程中微量结合的靶点蛋白的检测。
27.步骤b:利用蛋白g/a磁珠对细胞总蛋白进行预处理,得到待测细胞总蛋白,以去除细胞总蛋白中非特异结合的蛋白。
28.根据本发明的实施例,本步骤中利用蛋白g/a磁珠对细胞总蛋白进行预处理,得到待测细胞总蛋白是通过以下步骤b1~b2实现的。
29.在步骤b1中:利用下拉缓冲液对细胞总蛋白进行稀释,得到细胞总蛋白的稀释液。
30.将下拉缓冲液置于冰上预冷,取预冷后的下拉缓冲液,加至细胞总蛋白中,吹吸混匀后,将稀释后的细胞总蛋白置于4℃离心机中以去除不可溶沉淀,取离心后上清液,为细胞总蛋白稀释液,置于冰上备用。其中,离心转速为12000~14000rpm,时间为25~35分钟。
31.在步骤b2中:将细胞总蛋白的稀释液加入经清洗后的蛋白g/a磁珠中,在低温环境中进行孵育,孵育时间为2~8小时,低温环境的温度范围为4~8℃。
32.根据本发明的实施例,孵育阶段的时间过短(<2小时),细胞总蛋白中残留的非特异结合的蛋白不利于后续亲和素磁珠体特异捕获靶点蛋白,孵育阶段的时间过长(>8小时)不利于保证蛋白的完整性,因此,孵育阶段合适的时间范围为2~8小时,例如为2小时,6小时,4小时,8小时。
33.根据本发明的实施例,取蛋白g/a磁珠于离心管中,加入下拉缓冲液,上下颠倒数次,弃去下拉缓冲液,并重复此步骤2~3次,得到清洗后的蛋白g/a磁珠。将在步骤b1中制备好的细胞总蛋白稀释液加至清洗完成的蛋白g/a磁珠中,置于低温环境下进行上下颠倒孵育,以去除细胞总蛋白中非特异结合的蛋白。孵育阶段完成后,去除蛋白g/a磁珠,上清液则为待测细胞总蛋白,将其置于冰上备用。
34.根据本发明的实施例,利用蛋白g/a磁珠去除细胞总蛋白中的非特异性结合蛋白,
避免了蛋白非特性的结合到亲和素珠子上,为后续亲和素珠子包被生物素标记的低分子化合物来特异性捕获靶点蛋白提供有利条件,利于实现化合物下拉靶点蛋白。
35.步骤c:在含有牛血清蛋白的下拉缓冲液中利用生物素标记化合物对亲和素磁珠进行预处理,得到结合有生物素标记化合物的亲和素磁珠体,其中,生物素标记化合物为生物素标记的化合物。
36.根据本发明的实施例,在含有牛血清蛋白的下拉缓冲液中利用生物素标记化合物对亲和素磁珠进行预处理,得到结合有生物素标记化合物的亲和素磁珠体,包括:将亲和素磁珠和生物素标记化合物置于含有牛血清蛋白的下拉缓冲溶液中在低温条件下进行孵育处理,以便将生物素标记化合物包被至亲和素磁珠体表面的同时,封闭亲和素磁珠体的潜在非特异性蛋白结合位点,得到结合有生物素标记化合物的亲和素磁珠体,其中,牛血清蛋白的含量百分比为0.5~5%,孵育处理时间为3~8小时,低温的温度范围为4~8℃。
37.进一步地,将亲和素磁珠和生物素标记化合物置于含有牛血清蛋白的下拉缓冲溶液中在低温条件下进行孵育处理,得到结合有生物素标记化合物的亲和素磁珠体包括:取亲和素磁珠于离心管中,加入下拉缓冲液,上下颠倒数次,弃去缓冲液,并重复此步骤2~3次,以洗净亲和素磁珠。向清洗完成的亲和素磁珠中加入含有牛血清蛋白的下拉缓冲溶液的下拉缓溶液,并加入生物素标记的化合物,置于低温上下颠倒,孵育,将生物素标记的化合物包被至珠子上,得到结合有生物素标记化合物的亲和素磁珠体。结合完成后,弃去其中缓冲液,加入下拉缓冲液,上下颠倒数次,弃去下拉缓冲液,并重复此步骤2~3次,清洗珠子,以去除未结合的生物素标记化合物。
38.根据本发明的实施例,孵育处理时间过低(<3小时),不足以得到充分结合有生物素标记化合物的亲和素磁珠体,孵育时间过高(>8小时),不会更多的在亲和素磁珠体上结合生物素标记化合物,因此,在该孵育处理时间范围内,使得生物素标记化合物与亲和素磁珠体结合的足够充分,利于实现化合物下拉靶点蛋白。因此,合适的孵育处理时间为3~8小时,例如为3小时,4小时,5小时,6小时,7小时,8小时。
39.根据本发明的实施例,在下拉缓冲溶液中加入牛血清蛋白有利于提高靶点蛋白捕获的特异性。
40.根据本发明的实施例,亲和素磁珠表面生物素标记化合物的载量可以灵活调整。
41.步骤d:将预处理后得到的亲和素磁珠体加至待测细胞总蛋白中进行孵育处理,得到捕获有特异性靶点蛋白的亲和素磁珠体。
42.根据本发明的实施例,将预处理后得到的亲和素磁珠体加至待测细胞总蛋白中进行孵育处理,得到捕获有特异性靶点蛋白的亲和素磁珠体,包括:将预处理后得到的亲和素磁珠体至待测细胞总蛋白中,置于低温环境中进行孵育处理,以便对化合物对应的特异性靶点蛋白进行捕获,得到捕获有特异性靶点蛋白的亲和素磁珠体,其中孵育处理时间为2~10小时,低温环境的温度范围为4~8℃。
43.根据本发明的实施例,孵育处理时间在2~10小时范围之中,例如为2小时,4小时,6小时,8小时,10小时,保证了预处理后的亲和素磁珠体能够有效捕获靶点蛋白的同时,确保了靶点蛋白在被捕获的过程中不被降解,保护靶点蛋白的完整性。
44.步骤e:利用生物素或未被生物素标记的化合物对孵育处理后得到的亲和素磁珠体进行处理,得到目标下拉靶点蛋白。
45.根据本发明的实施例,利用生物素或未被生物素标记的化合物对孵育处理后得到的亲和素磁珠体进行处理,得到目标下拉靶点蛋白,包括:将生物素或未被生物素标记的化合物与孵育处理后得到的亲和素磁珠体在下拉缓冲液中进行混合后,置于冰上轻弹混匀处理以完成竞争性洗脱,收集上清液,得到目标下拉靶点蛋白,其中,处理时间为20~40分钟,例如为20分钟,30分钟,40分钟。
46.根据本发明的实施例,采用生物素或未被生物素标记的化合物进行竞争性洗脱,有利于降低由于生物素和中间连接的化合物与蛋白结合而带来的假阳性靶点,使靶点的鉴定更特异。
47.根据本发明的实施例,本发明还包括对目标下拉靶点蛋白进行分析,确定目标下拉靶点蛋白的种类,具体包括步骤f和g。
48.步骤f:利用聚丙烯酰胺凝胶电泳对目标下拉靶点蛋白进行分离洗脱,得到目标下拉靶点蛋白条带,并基于银染染色检测实现目标下拉靶点蛋白条带可视化。
49.步骤g:利用液相色谱—质谱联用仪对目标下拉靶点蛋白条带进行检测,确定目标下拉靶点蛋白的种类。
50.根据本发明的实施例,在步骤f中,银染染色检测能够快速预先判断有无靶标蛋白的钓出,从而使得步骤g中进行液相色谱—质谱检测之前对结果初步判定,进而避免不必要的后续实验。此外,在步骤f中,银染染色检测能够非常灵敏的检测并截留住极其微量的目标下拉靶点蛋白,因此使得目标下拉靶点蛋白的检测范围更广。
51.根据本发明的实施例,下拉缓冲液包括hepes,甘油,kcl,mgcl2和edta。其中,hepes的浓度为5~20mm,甘油的体积百分比为15~30%,kcl的浓度为95~105mm,mgcl2的浓度为1~2mm,edta的浓度为0.1~0.3mm。
52.根据本发明的实施例,相应浓度的hepes提供了蛋白的缓冲环境,kcl浓度的设置有利于在降低非特异性结合背景的同时,保证靶蛋白的结合;对应比例甘油的添加在保护蛋白的同时,保证了靶点蛋白的结合效率;相应比例mgcl2和edta的添加保证了蛋白的活性。
53.根据本发明的实施例,化合物包括低分子量化合物,该化合物的分子量为400~1500;低分子量化合物的种类包括全氟磺酸类化合物,全氟羧酸类化合物,双酚a及抑制剂jq1。其中抑制剂jq1为(s)-(+)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂卓-6-基)乙酸叔丁酯。
[0054]
根据本发明的实施例,亲和素磁珠包括链霉亲和素磁珠。
[0055]
根据本发明的实施例,链霉亲和素磁珠更易与生物素结合,且结合牢固,为实现化合物下拉靶点蛋白质提供基础。
[0056]
根据本发明的实施例,在步骤b中,利用蛋白g/a磁珠去除细胞总蛋白中非特异结合的蛋白,避免了细胞总蛋白中非特异结合的蛋白结合到亲和素磁珠表面,为步骤d提供有利的捕获条件。
[0057]
根据本发明的实施例,步骤a~e的实施过程中不需要依赖于仪器的高偶联程序方法经济且易推广。
[0058]
以下列举多个具体实施例来对本发明的技术方案作详细说明。需要说明的是,下文中的具体实施例仅用于示例,并不用于限制本发明。
[0059]
下面实施例中,部分试剂和检测仪器说明如下:
[0060]
以下各实施例中,人多能诱导干细胞(ipsc)来自中国科学院细胞库干细胞技术平台;蛋白g磁珠、链霉亲和素磁珠、蛋白标准品购自赛默飞世尔科技(中国)有限公司;ripa裂解液、kcl、mgcl2购自北京索莱宝科技有限公司;hepes、甘油以及其他未提及试剂和药品均购自赛默飞世尔科技(中国)有限公司或是采用现有方法进行实验室制备而容易得到的。
[0061]
实施例
[0062]
1.细胞总蛋白的获取
[0063]
(1)将一个6厘米培养皿长势良好的人诱导多能干细胞(ipsc)传代至四个10厘米培养皿,其中一个培养皿中ipsc如图2所示,使用mtesr
tm plus培养4天,得到培养密度为3.8
×
105个细胞/cm2的ipsc,其生长状态如图3所示。
[0064]
(2)将培养完成的细胞从37℃培养箱取出,弃去培养基,并加入5ml磷酸盐缓冲液晃动清洗。
[0065]
(3)弃去磷酸盐缓冲液,加入新的5ml磷酸盐缓冲液,并使用细胞刮刀将细胞从培养皿底刮下,收集至离心管中。
[0066]
(4)将细胞置于4℃离心机,2000rpm离心5分钟,收集细胞。
[0067]
(5)弃去离心后的上清液,并重新加入10ml磷酸盐缓冲液重悬细胞,再次离心。
[0068]
(6)弃尽离心后的上清液,加入1.5ml ripa裂解液(含1
×
转录起始前复合物(pic),1mm苯甲磺酰氟(pmsf),2mm二硫苏糖醇(dtt)),吹打混匀,置于冰上裂解10~30分钟。
[0069]
(7)将裂解完成的细胞置于4℃离心机,13000rpm离心30分钟,去除不可溶沉淀。
[0070]
(8)取离心后上清液,为细胞总蛋白。
[0071]
2.细胞总蛋白的预处理
[0072]
(1)配制下拉缓冲液,其成分为:20mm hepes,20%甘油,100mm kcl,1.5mm mgcl2,0.2mm edta,并置于冰上预冷。
[0073]
(2)取3ml预冷后的下拉缓冲液,加至细胞总蛋白中,吹吸混匀。
[0074]
(3)将稀释后的细胞总蛋白置于4℃离心机中,13000rpm离心30分钟,去除不可溶沉淀。
[0075]
(4)取离心后上清液,为细胞总蛋白稀释液,置于冰上备用。
[0076]
(5)将200μl吸头尖部减去,吸取100μl蛋白g磁珠,置于1.5ml离心管中。
[0077]
(6)加入预冷的下拉缓冲液,上下颠倒5分钟,使用磁力架弃去缓冲液,并重复此步骤2次。
[0078]
(7)将准备好的细胞总蛋白稀释液加至清洗完成的蛋白g磁珠中,置于4℃上下颠倒孵育,孵育时间为4小时,去除细胞总蛋白中非特异结合的蛋白。
[0079]
(8)孵育未完成后,使用磁力架去除磁珠,上清液则为预处理后的细胞总蛋白,将其置于冰上备用。
[0080]
3.链霉亲和素磁珠的预处理
[0081]
(1)将200μl吸头尖部减去,分别吸取100μl的链霉亲和素磁珠,置于两个1.5ml离心管中。
[0082]
(2)向取出的链霉亲和素磁珠中加入下拉缓冲液,上下颠倒5分钟,弃去缓冲液,并
重复此步骤2次。
[0083]
(3)向清洗完成的链霉亲和素磁珠中加入1ml含有0.5%牛血清蛋白的下拉缓冲液,并加入工作浓度为200μm的生物素标记的全氟辛烷磺酸,其中,生物素标记的全氟辛烷磺酸具有如式(1)所示结构,分子量为928.7。
[0084][0085]
(4)将链霉亲和素磁珠置于4℃上下颠倒混匀,并孵育3~8小时。
[0086]
(5)结合完成后,弃去链霉亲和素磁珠中缓冲液,并加入预冷的下拉缓冲液,上下颠倒5分钟,弃去缓冲液,并重复此步骤2~3次,清洗未结合至链霉亲和素磁珠的游离生物素标记的全氟辛烷磺酸。
[0087]
4.获取全氟辛烷磺酸特异性靶点蛋白
[0088]
(1)将预处理后的细胞总蛋白加至预处理后链霉亲和素磁珠。
[0089]
(2)将链霉亲和素磁珠与预处理后的细胞总蛋白混合物置于4℃,上下颠倒孵育3小时,进行特异性下拉靶点蛋白捕获。
[0090]
(3)捕获完成后,通过磁力架弃去上清液,收集链霉亲和素磁珠。
[0091]
(4)加入下拉缓冲液至包被完成的链霉亲和素磁珠中,上下颠倒5分钟,弃去缓冲液,并重复此步骤2~3次。
[0092]
(5)向清洗完成的磁珠中加入30μl下拉缓冲液,并加入40mm未标记生物素的全氟辛烷磺酸,轻柔吹打混匀,置于冰上20~40分钟,进行竞争性洗脱,期间轻弹混匀,防止磁珠沉淀。
[0093]
(6)重复步骤(5)1~2次,以收集尽可能多的捕获有特异性靶点蛋白的链霉亲和素磁珠体。
[0094]
(7)将捕获有特异性靶点蛋白的链霉亲和素磁珠体通过磁力架收集,洗脱后收集上清液,得到全氟辛烷磺酸特异性靶点蛋白溶液。
[0095]
对比例
[0096]
与实施例1的体系和操作步骤类似,区别在于在链霉亲和素磁珠的预处理步骤(3)中,并加入工作浓度为200μm的生物素;在捕获下拉靶点蛋白步骤(5)中,加入40mm生物素,轻柔吹打混匀,步骤(7)中,得到混合溶液。
[0097]
将实施例和对比例获得的溶液以及蛋白标准品,分别通过聚丙烯酰胺凝胶电泳分离洗脱,得到蛋白条带,并通过银染染色,染色后的结果如图4所示。
[0098]
从图4中可以看出,对比例中没有显示蛋白条带,而实施例中出现蛋白条带,说明通过本发明提供的方法的操作流程,成功实现了全氟辛烷磺酸下拉特异性靶点蛋白,进一步说明基于生物素亲和素系统通过将蛋白g/a磁珠和亲和素磁珠连用的方法,并优化整个流程实现了以化合物下拉蛋白,特异性高,周期短,操作简单,为化合物未知靶点的研究提供新的可行性方法。
[0099]
以上的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1