基于智能手机的适配体荧光脑利钠肽检测装置和传感方法
1.本发明属于生物传感技术领域,具体的说,是涉及一种用于检测生物标志物的荧光检测装置和传感方法。
背景技术:
2.目前,测定脑利钠肽在血液中浓度的方法有酶联免疫吸附分析、化学发光免疫分析等技术0,但仍面临着昂贵、复杂、灵敏度低等局限性。酶联免疫吸附分析具有良好的特异性,但灵敏度比较差,精度比较低;化学发光免疫分析商业检测平台灵敏度高且检测范围广,但往往成本高,抗干扰能力相对较弱,限制了其推广应用。上述方法都是通过抗原抗体特异性识别的免疫分析法,而脑利钠肽在血液中存在多种形式,往往导致交叉反应发生,从而造成对脑利钠肽浓度的高估。
3.因此,生物传感器和免疫传感器逐渐成为检测领域的发展趋势,能够更精准和快速的测定分析物的工具。因此,开发经济快速有效、高灵敏度、选择性好的脑利钠肽检测方法具有较好前景。随着智能手机、生化分析、适配体探针传感技术和其他新技术的发展,即时检测也逐步应运而生,越来越多的检测设备因追求快速、便携、高效等优点而发展起来。虽然这些商业化检测平台可提供具有成本效益的移动医疗保健和个性化医疗服务,但由于技术发展水平的参差,应用于临床的商业化技术仍然面临着一些挑战和未解决的问题0。参考文献:
4.【1】dahiya t,yadav s,yadav n,et al.monitoring of bnp cardiac biomarker with major emphasis on biosensing methods:a review[j].sensors international,2021,2:100103.
[0005]
【2】ashist s k,luppa p b,yeo l y,et al.emerging technologies for next-generation point-of-care testing[j].trends in biotechnology,2015,33(11):692-705.
技术实现要素:
[0006]
根据上述脑利钠肽传统检测方法的局限性和对即时检测的需求,本发明提出了一种基于智能手机供电的脑利钠肽核酸适配体荧光检测装置和传感方法,其采用智能手机直插式供电调控检测,以荧光快检机构为载体,将适配体荧光传感器和检测控制机构集成化,最终实现脑利钠肽的快速精准检测。
[0007]
为了解决上述技术问题,本发明通过以下的技术方案予以实现:
[0008]
根据本发明的一个方面,提供了一种基于智能手机的适配体荧光脑利钠肽检测装置,包括检测控制机构、荧光快检机构、适配体荧光传感器;
[0009]
所述检测控制机构包括电源模块、微控制器、激发光源、信号采集及光电转换模块、信号链处理模块、蓝牙模块;所述电源模块的输入端用于与智能手机的usb接口连接,由智能手机向所述电源模块输出供电电压,实现为所述检测控制机构供电;所述微控制器与
所述激发光源、所述信号采集及光电转换模块、所述信号链处理模块均信号连接,并且能够通过所述蓝牙模块与智能手机信号连接;所述激发光源用于根据微控制器的控制信号开启和关闭,并产生设定波长的激发光;所述信号采集及光电转换模块用于根据微控制器的控制信号捕获待测溶液产生的荧光信号,并将荧光信号转换为电信号传输给所述微控制器;所述信号链处理模块用于接收所述微控制器传输的电信号,并且对电信号进行模数转换、滤波放大的处理,并将处理结果传输给所述微控制器;所述蓝牙模块用于将智能手机的指令信号传输给所述微控制器,并将所述微控制器获得的处理结果传输至智能手机进行显示;
[0010]
所述荧光快检机构用于所述适配体荧光传感器在所述检测控制机构的控制下检测脑利钠肽;所述荧光快检机构包括智能手机支架和主盒,所述智能手机支架用于放置智能手机,通过智能手机进行供电、检测操作和结果显示;所述主盒内部设置有内壳,且所述内壳与所述主盒之间具有间距;所述内壳固定安装有所述信号采集及光电转换模块和主控电路板,并且设置有激发光源固定孔;所述主控电路板集成所述电源模块、所述微控制器、所述信号链处理模块和所述蓝牙模块;所述内壳的内部设置有荧光信号反应台,所述荧光信号反应台远离于所述激发光源固定孔的部分开设有荧光信号反应池,所述荧光信号反应池用于放置盛装待测溶液的石英比色皿;所述荧光信号反应台靠近于所述激发光源固定孔的部分设置有激发光螺纹固定孔,所述激发光螺纹固定孔与所述荧光信号反应池连通,并且与所述激发光源固定孔同轴线设置,从而与所述激发光源固定孔共同固定led激发光源;所述激发光螺纹固定孔与所述荧光信号反应池的连接处设置有激发滤光片槽,所述激发滤光片槽用于装载激发滤光片;所述荧光信号反应台与所述内壳之间设置有连接体,并在连接体内开设有发射光接收孔;所述发射光接收孔与所述荧光信号反应池连通,并且所述发射光接收孔与所述激发光螺纹固定孔以所述荧光信号反应池为节点水平垂直;所述发射光接收孔与所述荧光信号反应池的连接处设置有发射滤光片槽,所述发射滤光片槽用于装载发射滤光片;如此,所述激发光源所产生设定波长的激发光经过激发滤光片后照射在所述荧光信号反应池中,使所述荧光信号反应池内的石英比色皿中待测溶液产生荧光信号,荧光信号经发射滤光片后通过发射光接收孔传输至信号采集及光电转换模块;
[0011]
所述适配体荧光传感器采用羧基荧光素标记寡核苷酸做适配体,羧基化氧化石墨烯做荧光猝灭剂制得,用于检测脑利钠肽,根据多组实验分析脑利钠肽浓度与荧光强度的信号响应关系。
[0012]
进一步地,所述电源模块的输出端与所述微控制器、所述激发光源和所述信号采集及光电转换模块连接,分别向所述微控制器输出3.3v电源电压、向所述激发光源输出5v电源电压和向所述信号采集及光电转换模块输出
±
5v电源电压;所述信号链处理模块和所述蓝牙模块由所述微控制器输出3.3v电压供电。
[0013]
进一步地,所述荧光快检机构采用黑色abs树脂一体成型。
[0014]
进一步地,所述主盒的顶面设置有开口,并在开口处设置遮光翻盖;所述遮光翻盖后侧与所述主盒铰接,用于在检测操作时方便对待测溶液进行更换;所述主盒的前面、后面、侧面均设置有开口,并在开口处安装遮光挡板;所述遮光挡板通过所述主盒设置的挡板滑轨实现插装和拆卸。
[0015]
进一步地,所述主盒顶部设置有信号灯安置孔,用于安装判断主控电路板通电是
否正常的信号灯;所述主盒的后面下部设置有接线口,用于由所述主盒内部引出线路。
[0016]
进一步地,所述内壳由前板、后板和侧板围成,所述信号采集及光电转换模块通过螺钉固定在所述前板表面,所述主控电路板嵌装在所述后板表面,所述激发光源固定孔开设在所述侧板的中间位置。
[0017]
进一步地,所述发射光接收孔设置为锥形孔,且该锥形孔的直径由所述荧光信号反应池向所述内壳方向逐渐缩小,实现光的聚集。
[0018]
进一步地,所述智能手机支架包括斜坡结构,且斜坡底部设置为设有开口的半圆弧形挡板,该开口与智能手机的usb接口位置对应。
[0019]
进一步地,适配体能够特异性将脑利钠肽捕获并恢复荧光,脑利钠肽浓度越大,荧光强度就越大,所用寡核苷酸适配体碱基序列为:
[0020]5’‑
fam-tttttttatacgggagccaacaccacctctcacattatattgtgaatactt cgtgctgtttagagcaggtgtgacggat-3’。
[0021]
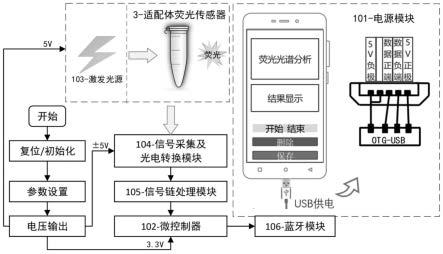
根据本发明的另一个方面,提供了一种基于上述适配体荧光脑利钠肽检测装置的传感方法,包括以下步骤:
[0022]
(1)将100nmol/l的核酸适配体溶液和40μg/ml的羧基化氧化石墨烯分散液等体积混合,溶液ph值环境控制在7.2-7.4,室温静置20
±
5min;
[0023]
(2)将含有一定浓度脑利钠肽的待测溶液等体积加入步骤(1)得到的混合液中,室温静置35
±
5min。
[0024]
(3)取出适量待测溶液于石英比色皿中,将石英比色皿放置在所述荧光信号反应池中,在智能手机上设置参数为:激发波长492nm,发射波长519nm,发射光谱检测范围为505-610nm;检测混合溶液荧光强度,根据物质浓度和荧光强度的线性响应关系得出溶液中脑利钠肽浓度。
[0025]
本发明的有益效果是:
[0026]
(一)本发明配合人的常用操作习惯,设计为荧光快检便携结构,将适配体荧光传感器和检测控制机构集成化,缩小了整个装置的空间体积,结合微控制器调控检测过程和信号采集及光电转换模块灵敏捕获微弱荧光信号并进行光电转换,能够实现对脑利钠肽的即时检测。
[0027]
(二)本发明利用智能手机otg功能进行直插式供电,采用usb接口输出5v电压,不仅接线操作简单,而且智能手机做移动电源突破了检测装置的使用环境,便于携带,满足了即时检测需求。
[0028]
(三)本发明采用寡核苷酸做适配体特异性识别脑利钠肽,碱基序列简单,易获取,成本低,且核酸适配体不易与其他蛋白质类抗原结合,避免了多肽间的交叉反应,特异性较高,反应迅速,检测过程短,适用于快速检测;羧基化氧化石墨烯作荧光猝灭剂化学性质稳定,成本低,制备技术成熟,实现了低成本荧光传感器的开发。
[0029]
(四)本发明检测脑利钠肽无需对待测样本进行复杂的前处理,节省时间和成本,具有快捷高效,操作简单,成本低,灵敏度高等优点。
附图说明
[0030]
图1为本发明实施例所提供的脑利钠肽核酸适配体荧光检测装置系统框图;
[0031]
图2为本发明实施例所提供的脑利钠肽核酸适配体荧光检测装置的装配体轴侧图;
[0032]
图3为本发明实施例所提供的脑利钠肽核酸适配体荧光检测装置的俯视图及其a-a、b-b剖面视图;
[0033]
图4为本发明实施例所提供的脑利钠肽核酸适配体荧光检测装置的主盒和手机支架轴侧图。
[0034]
图5为一系列羧基化氧化石墨烯溶液与仅含有100nmol/l的核酸适配体溶液的荧光光谱图。
[0035]
图6为一系列羧基化氧化石墨烯溶液与含有100nmol/l的核酸适配体和1000pg/ml的脑利钠肽混合溶液的荧光光谱图。
[0036]
图7为图5和图6两种条件下的峰值和峰值差值的条形对比图。
[0037]
图8为最佳荧光猝灭检测时间结果图。
[0038]
图9为最佳荧光恢复检测时间结果图。
[0039]
图10为用适配体荧光传感器检测一系列浓度梯度的脑利钠肽溶液的荧光光谱图。
[0040]
图11为检测脑利钠肽溶液浓度与荧光强度的线性响应曲线。
[0041]
上述图中:1-检测控制机构,101-电源模块,102-微控制器,103-激发光源,104-信号采集及光电转换模块,105-信号链处理模块,106-蓝牙模块;2-荧光快检机构,201-主盒,202-智能手机支架,203-遮光翻盖,204-信号灯安置孔,205-遮光挡板,206-挡板滑轨,207-接线口,208-内壳,209-信号采集及光电转换模块固定孔,210-激发光源固定孔,211-主控电路板固定槽,212-荧光信号反应台,213-底座,214-荧光信号反应池,215-激发光螺纹固定孔,216-激发滤光片槽,217-发射光接收孔,218-发射滤光片槽;3-适配体荧光传感器。
具体实施方式
[0042]
为能进一步了解本发明的内容、特点及效果,兹例举以下实施例,并配合附图详细说明如下:
[0043]
本发明基于核酸适配体的荧光传感技术,以羧基化氧化石墨烯作荧光共振能量转移平台,用于猝灭羧基荧光素标记的核酸适配体上的荧光,当脑利钠肽加入时,核酸适配体与脑利钠肽特异性识别从而使适配体脱离石墨烯表面,荧光得以恢复,根据此原理可以准确测定溶液中脑利钠肽的浓度。为了满足即时检测需求设计荧光快检机构2作为载体,采用智能手机供电,检测控制机构1用于数据采集、处理、传输,最后通过蓝牙传输至智能手机上显示检测结果。
[0044]
如图1所示,本实施例提供了一种基于智能手机的适配体荧光脑利钠肽检测装置,包括:检测控制机构1、荧光快检机构2、适配体荧光传感器3。
[0045]
检测控制机构1用于调控集成化检测进程,完成荧光信号采集与光电转换,数据的处理及输出等,包括:电源模块101、微控制器102、激发光源103、信号采集及光电转换模块104、信号链处理模块105、蓝牙模块106。
[0046]
电源模块101的输入端用于与智能手机的usb接口连接,由智能手机经otg功能输出5v供电电压,并为整个检测控制机构1供电。电源模块101的输出端与微控制器101和信号采集及光电转换模块104连接,分别向微控制器101输出3.3v电源电压和向信号采集及光电
转换模块104输出
±
5v电源电压。激发光源103由电源模块101输出5v电压直接供电,信号链处理模块105、蓝牙模块106由微控制器101输出3.3v电压供电。
[0047]
进一步地,基于智能手机otg功能的直插式供电方式,其usb接口接线原理如图1所示,其中usb电路接口地线和空端作5v电源负极,电源线作5v电源正极,实现了智能手机5v电压输出,作为移动电源给检测控制机构1供电,丰富了使用环境,顺应了即时检测技术发展。
[0048]
微控制器102与激发光源103、信号采集及光电转换模块104、信号链处理模块105信号连接,并且能够通过蓝牙模块106与智能手机信号连接。例如,微控制器101可采用stm32f103c8t6芯片。微控制器102用于控制激发光源103开启和关闭,并控制激发光源103以设定波长的激发光照射石英比色皿内的待测溶液;用于控制信号采集及光电转换模块104捕获和转换荧光信号,并接收信号采集及光电转换模块104输出的电信号;用于将电信号传输给信号链处理模块105,并根据信号链处理模块105处理信息形成处理结果;用于通过蓝牙模块106接收智能手机的指令信号和将处理信息传输至智能手机显示检测结果。
[0049]
激发光源103用于根据微控制器102的控制信号开启和关闭,并且根据微控制器102的控制信号产生设定波长的激发光,激发光经激发滤光片照射石英比色皿内的待测溶液,能够使石英比色皿内的待测溶液产生荧光信号。例如,可采用波长为492nm的led光源作为激发光源103。
[0050]
信号采集及光电转换模块104用于捕获石英比色皿内的待测溶液产生的荧光信号,并将荧光信号转换为电信号传输给微控制器102。例如,信号采集及光电转换模块104可采用硅光电倍增管模块(c13365-3050sa),该模块供电电压为
±
5v,由电源模块101中
±
5v转换电路输出,可灵敏捕获荧光信号并转换为电压信号输出。
[0051]
信号链处理模块用于接收微控制器102传输的电信号,并且对电信号进行模数转换、滤波放大的处理,并将处理结果传输给微控制器102。
[0052]
蓝牙模块106用于将智能手机的指令信号传输给微控制器102,并将微控制器102获得的处理结果传输至智能手机显示检测结果。
[0053]
如图2-图4所示,荧光快检机构2基于人因工程原理使用三维建模软件solidworks进行设计,总体积不大于20cm
×
10cm
×
10cm,外形上主要分为主盒201和智能手机支架202两部分,主盒201和智能手机支架202优选为一体成型设置。主盒201用于适配体荧光传感器3在检测控制机构1控制下检测脑利钠肽,智能手机支架202用于放置智能手机,进行供电、检测操作和结果显示等功能。
[0054]
荧光快检机构2优选采用可遮光的黑色abs树脂作为3d打印材料,解放了适配体荧光传感器的检测环境,保证脑利钠肽的集成化即时检测的顺利进行。
[0055]
主盒201大体呈正方壳体,其顶面、前面、后面、侧面均设置有方形开口,以方便检测控制机构1中各部分元件的安装及拆卸。
[0056]
主盒201顶部的方形开口设置有遮光翻盖203,遮光翻盖203后侧通过销轴与主盒201连接,从而与主盒201形成铰接。遮光翻盖203起到对主盒201顶面开口的遮光作用,并且在检测操作时便于待测溶液更换。优选地,主盒201在遮光翻盖203后方对称设置有两个信号灯安置孔204,信号灯安置孔204配合常用发光二极管设计孔径大小,用于安装信号灯以判断主控电路板通电是否正常。
[0057]
主盒201前面、后面、侧面的方形开口分别安装遮光挡板205,用于对主盒201前方、后方、侧方的开闭和遮光。主盒201对应于每块遮光挡板205均设置有挡板滑轨206,三处挡板滑轨206分别用于插装遮光挡板205。一般来讲,三块遮光挡板205按照后面、侧面、前面的顺序安装,并按照前面、侧面、后面的顺序拆卸;相应的,后面的遮光挡板205开设有用于插接侧面的遮光挡板205的插槽,侧面的遮光挡板205也开设有用于插接前面的遮光挡板205的插槽。
[0058]
优选地,主盒201后面的方形开口下方设置有接线口207,便于主盒201内部引出线路规整和外接。
[0059]
主盒201内部一体连接有内壳208,内壳208由固定于主盒201底板上的前板、后板和侧板围成,且其前板、后板和侧板分别与主盒201前面、后面、侧面具有一定间距。
[0060]
内壳208的前板设置有信号采集及光电转换模块固定孔209,信号采集及光电转换模块固定孔209配合信号采集及光电转换模块104的尺寸设计,包括分别对应于信号采集及光电转换模块104四角处的四个通孔,实现将信号采集及光电转换模块104附着在内壳208前板表面固定。
[0061]
内壳208的侧板设置有圆形通孔,作为激发光源固定孔210。
[0062]
内壳208的后板外侧面设置有长方形凹槽,用于固定主控电路板。主控电路板集成有检测控制机构1的电源模块101、微控制器102、信号链处理模块105和蓝牙模块106。
[0063]
内壳208内部设置有荧光信号反应台212,荧光信号反应台212具有长方体外形。荧光信号反应台212通过底座213固定于主盒201底板表面,以使荧光信号反应台212具有一定高度。
[0064]
荧光信号反应台212远离于激发光源固定孔210的部分开设有开口向上的凹槽,作为荧光信号反应池214。荧光信号反应池214用于放置盛装待测溶液的石英比色皿。
[0065]
荧光信号反应台212靠近于激发光源固定孔210的部分设置有内螺纹孔,作为激发光螺纹固定孔215。激发光螺纹固定孔215与荧光信号反应池214连通,并且与激发光源固定孔210同轴线设置。激发光源固定孔210与激发光螺纹固定孔215共同固定led激发光源,用于激发光沿水平方向产生和传播。
[0066]
激发光螺纹固定孔215与荧光信号反应池214的连接处设置有激发滤光片槽216,激发滤光片槽216用于装载激发滤光片,以达到过滤激发杂散光,提高激发效率的目的。
[0067]
荧光信号反应台212与内壳208的前板之间设置有连接体,连接体内开设有发射光接收孔217。发射光接收孔217与荧光信号反应池214连通,并且在内壳208的前板上形成通孔,发射光接收孔217与激发光螺纹固定孔215以荧光信号反应池214为节点水平垂直。这样,激发光源103所产生设定波长的激发光,经过激发滤光片后照射在荧光信号反应池214中,荧光信号反应池214内的石英比色皿中待测溶液产生荧光信号,荧光发射光与激发光成90
°
角传播。由于产生的荧光信号比较微弱,因而发射光接收孔217设置为锥形孔为佳,且该锥形孔由荧光信号反应池214向内壳208的前板方向逐渐缩小,实现光的聚集并最终传输至信号采集及光电转换模块104。另外,还可以对发射光接收孔217内壁进行喷漆处理,提高光反射效率,更有利于荧光发射光的聚集。
[0068]
发射光接收孔217与荧光信号反应池214的连接处设置有发射滤光片槽218,发射滤光片槽218用于装载发射滤光片。优选地,发射滤光片和激发滤光片均采用高透可见光滤
光片,波长范围为400nm-700nm,用于光波长的筛选。
[0069]
作为一种优选的实施方式,智能手机支架202主体为斜坡结构,斜坡角度适应人眼视野范围,用于架设智能手机。斜坡底部为设有开口的半圆弧形挡板,开口与智能手机的usb接口位置对应,便于usb接口插拔供电。由此,智能手机支架202用于放置智能手机,便于供电、检测操作和结果显示,对于该荧光快检机构的结构化设计,对于实现脑利钠肽的集成化荧光速检具有重要作用。
[0070]
石英比色皿中待测溶液产生荧光信号由适配体荧光传感器3检测,适配体荧光传感器3基于荧光传感技术快速检测脑利钠肽浓度,以羧基荧光素标记寡核苷酸做适配体特异性捕获脑利钠肽,基于荧光共振能量转移原理以羧基化氧化石墨烯作荧光猝灭剂,当加入脑利钠肽时,核酸适配体与脑利钠肽特异性识别从而使适配体荧光得以恢复,使用紫外-可见荧光光谱仪检测荧光强度,获得多组荧光光谱图,根据多组实验数据分析,得出物质浓度与荧光强度的信号响应关系。
[0071]
其中,羧基荧光素标记的核酸适配体碱基序列为:
[0072]5’‑
fam-tttttttatacgggagccaacaccacctctcacattatattgtgaatactt cgtgctgtttagagcaggtgtgacggat-3’。
[0073]
羧基化氧化石墨烯表面带有大量亲水性官能团,具有一定的润湿性能、表面活性和生物学性能;该核酸适配体碱基序列具有两个脑利钠肽特异性识别位点,并在荧光标记基团和真正的dna序列之间添加了oligo(dt)胸腺嘧啶序列,增大了二者的空间位阻,防止发生反应,使适配体更加稳定,特异性识别效率更高。
[0074]
考虑到脑利钠肽和羧基化氧化石墨烯对核酸适配体荧光信号的影响,本发明还设计了预实验确定脑利钠肽荧光检测的最佳实验条件,如羧基化氧化石墨烯溶液的最佳浓度,荧光猝灭的最佳检测时间以及荧光恢复的最佳检测时间。具体实验步骤如下:
[0075]
(1)试剂与材料准备
[0076]
100nmol/l的核酸适配体溶液:选择适量的高浓度核酸适配体溶液95℃水浴加热5分钟,自然冷却至室温并稀释;1000pg/ml的脑利钠肽溶液;一系列含有脑利钠肽的待测溶液;一系列羧基化氧化石墨烯溶液,紫外-可见荧光光谱仪等。
[0077]
(2)羧基化氧化石墨烯最佳浓度实验
[0078]
将一系列羧基化氧化石墨烯溶液分别与仅含有100nmol/l的核酸适配体溶液和含有100nmol/l的核酸适配体与1000pg/ml的脑利钠肽混合溶液进行混合,保证其他条件不变,使用紫外-可见荧光光谱仪进行荧光强度检测,获得不同羧基化氧化石墨烯浓度下的荧光强度值,将两种条件下的峰值以及峰值的差值做对比,获得最佳的羧基化氧化石墨烯浓度值。实验结果如图5-7所示,羧基化氧化石墨烯最佳浓度为40ug/ml。
[0079]
(3)最佳检测时间
[0080]
荧光猝灭的最佳检测时间:将100nmol/l的核酸适配体溶液与40ug/ml羧基化氧化石墨烯溶液等体积混合,溶液ph值环境控制在7.2-7.4,立即取出适量混合溶液进行荧光检测,记为0min,之后每间隔5min检测一次,依次记为0min、5min、10min等。比较每一次检测的荧光强度峰值,估测出最佳的荧光猝灭检测时间。如图8所示,最佳荧光猝灭检测时间为20
±
5min。
[0081]
荧光恢复的最佳检测时间:将100nmol/l的核酸适配体溶液与40ug/ml羧基化氧化
石墨烯溶液等体积混合,溶液ph值环境控制在7.2-7.4,室温放置20min左右。然后加入1000pg/ml的脑利钠肽溶液混合,立即取出适量混合溶液进行荧光检测,记为0min,之后每间隔5min检测一次,依次记为0min、5min、10min等。比较每一次检测的荧光强度峰值,比较不同时间荧光强度,估测出最佳的荧光恢复检测时间。如图9所示,最佳荧光恢复检测时间为35
±
5min。
[0082]
本发明所述检测脑利钠肽得出物质浓度与荧光强度的信号响应关系,具体实验步骤如下:
[0083]
(1)空白对照实验:单独检测100nmol/l的核酸适配体溶液的荧光强度,设置参数为:激发波长492nm,发射波长519nm,发射光谱检测范围为505-610nm,所得结果作为对照。
[0084]
(2)将100nmol/l的核酸适配体溶液与40ug/ml羧基化氧化石墨烯溶液等体积混合,溶液ph值环境控制在7.2-7.4,室温放置20min左右。然后分别加入一系列浓度梯度的脑利钠肽溶液,室温放置35min左右,取出适量混合溶液检测荧光强度,记录不同浓度下的荧光光谱图,如图10所示,单独检测核酸适配体溶液,其荧光强度最大,当脑利钠肽溶液浓度为0时,羧基化氧化石墨烯作猝灭剂,溶液荧光强度最低,随着脑利钠肽浓度的增加,溶液荧光强度逐渐增大。
[0085]
(3)对上述实验结果进行整理以及数据处理,得到脑利钠肽浓度与荧光强度的线性响应方程为:y=2950.8x+5745.3(r2=0.9995),线性拟合曲线如图11所示。
[0086]
综上,本发明所述采用一种基于智能手机的适配体荧光脑利钠肽检测方法,具体检测步骤如下:
[0087]
(1)打开智能手机,开启电源。观察电源信号灯,判断检测电路是否正常,检查荧光快检机构2是否能够正常使用,是否达到遮光环境需求等。
[0088]
(2)将盛有待测溶液的石英比色皿放置在主盒201内的荧光信号反应池214中,关闭遮光翻盖203,然后在智能手机操界面上设置参数为:激发波长492nm,发射波长519nm,发射光谱检测范围为505-610nm,打开激发光源103进行检测,检测结果在智能手机上显示。
[0089]
(3)检测完毕后,保存数据,关闭智能手机电源,打开遮光翻盖203,取出待测溶液并安全处理。
[0090]
可见,本发明提出的基于智能手机供电的脑利钠肽核酸适配体荧光检测装置和传感方法,使用羧基化氧化石墨烯作猝灭剂并设计了脑利钠肽特异性核酸适配体,构建了一种适配体荧光传感器3用于检测脑利钠肽,设计了荧光检测机构2采用智能手机直插式移动电源,结合模块化和集成化设计构建了即时检测移动医疗快检平台,突破了传统检测方法固定使用环境和大型检测设备的局限性,在低成本、高效率的脑利钠肽快检速检领域具有良好的发展前景。
[0091]
尽管上面结合附图对本发明的优选实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,并不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离发明宗旨和权利要求所保护的范围情况下,还可以作出很多形式的具体变换,这些均属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1