一种基于SPR的便携式微纳振荡成像检测装置及方法
一种基于spr的便携式微纳振荡成像检测装置及方法
技术领域
1.本技术涉及生物、化学检测设备技术领域,尤其涉及基于spr的便携式微纳振荡成像检测装置及方法。
背景技术:
2.在这个后基因组时代,分析分子之间的相互作用对于了解各种生理活动的机制至关重要。然而目前常用的检测技术存在耗时、操作复杂等缺点,并且往往需要实验室环境下使用大型设备平台。但对分子之间的相互作用进行现场快速分析仍然是一个挑战。因此,有必要开发快速便携生物检测技术,实现分子相互作用的分析。
3.传统的表面等离子体共振(surface plasma resonance,spr)技术已经商业化,spr成像技术近年来也快速发展。然而常规spr成像需要复杂的光路系统以及独立的检测部件,系统体积庞大,并且需要专业人员操作,推广受到很大限制。传统的滴加进样法操作繁琐、耗时长,且容易影响成像系统结构稳定性。另外温度、光照、气流等外界条件的改变也会给检测带来干扰。
4.目前,市场上很少有基于spr成像的高度集成的便携式系统进行生物检测和分子相互作用分析。将微生物诊断的所有步骤集成到小型化设备中的芯片实验室系统的开发已成为一种趋势,这将极大降低成本、提高使用便携性。然而设备小型化不可避免的会使检测灵敏性和稳定性降低,因此便携式检测仍然是一个挑战。
5.由于不同尺寸、材质及形状的微纳振子在溶液中带有不同的电荷,通过柔性生物长链连接到成像芯片上后施加交流电场调制使微纳振子产生震荡,可采集其幅值及相位等振荡参数进行信号放大。因此将微纳振子技术将spr技术结合有望开发一种便携式的检测装置及方法。
技术实现要素:
6.本技术实施例的目的是提供一种基于spr的便携式微纳振荡成像检测装置及方法,用以解决传统spr成像系统复杂、体积大、成本高、易受干扰及通量低等问题,实现检测装置小型化和一体化,在保证灵敏性和稳定性的基础上实现便携快速分子相互作用分析。
7.根据本技术实施例的第一方面,提供一种基于spr的便携式微纳振荡成像检测装置,包括spr光学成像模块、信号检测控制模块、微样流路控制模块、电场调制模块、一体化封装模块;
8.所述spr光学成像模块包括准直偏振光源、微型棱镜、成像芯片、图像传感器,所述准直偏振光源以特定的spr角与所述微型棱镜耦合,所述成像芯片设置在所述光学棱镜上方,所述图像传感器与所述微型棱镜集成用以反射光采集,所述图像传感器采用微透镜或无透镜的cmos图像传感器;
9.所述信号检测控制模块用于温度控制并获取所述图像传感器和电场调制模块的时间戳实现相位同步;
10.所述微样流路控制模块包括微流控芯片,所述微流控芯片设置在所述成像芯片上方,用以微量样品的流路控制与切换,增加检测稳定性;
11.所述电场调制模块与所述成像芯片和微样流路控制模块电连接,用于给不同材质、形状及尺寸的微纳振子施加振荡动力,以进行信号放大以增强检测灵敏性;
12.所述一体化封装模块包括哑光密闭外壳、成像底座、基座,所述哑光密闭外壳用于装置的封装,所述基座设置在所述哑光密闭外壳内的底部,所述成像底座设置在所述基座上,所述成像底座中设置v型卡槽,所述微型棱镜设置在所述v型卡槽中;
13.其中所述微纳振子材质为带有电荷的粒子,所述微纳振子形状为球状、棒状或片状,所述微纳振子的直径尺寸范围为500nm~5μm。
14.进一步地,在所述spr光学成像模块中,所述成像芯片为微纳振子阵列功能化成像芯片,采用生物分子自组装模式构建微纳振子阵列,spr成像空间分辨率为5~10μm,时间分辨率为10ms。
15.进一步地,所述信号检测控制模块包括温度控制器、数据采集卡,所述温度控制器用以调控环境温度,所述数据采集卡用以获取所述图像传感器和电场调制模块的时间戳,以实现相位同步。
16.进一步地,所述微样流路控制模块还包括进样泵、切换阀,所述微流控芯片包括进样口、电极孔、电极缺口、反应腔、出样孔、芯片卡槽、固定孔,所述芯片卡槽用于所述成像芯片的固定,所述进样口设置3~5个,与所述进样泵和切换阀连接实现不同样品的运输及切换,设置反应腔用于样品进行反应,反应腔体积为50~300μl,所述电极孔用以将对电极连接样品,所述电极缺口用以将工作电极连接成像芯片,所述固定孔用于与所述基座固定连接,所述进样泵控制进样流速在50~500μl/min。
17.进一步地,所述电场调制模块包括电路板、电源,所述电源为所述spr光学成像模块、信号检测控制模块、微样流路控制模块、电场调制模块供电,所述电路板用于通过微流控芯片向样品输出正弦及其他波形交流电调制,交流电调制电压峰峰值电压可调范围为-2~2vpp,频率可调范围为0.1~20hz。
18.进一步地,所述v型卡槽两端分别设置有竖直支架,所述竖直支架内侧均设置有斜面卡槽,所述支架上设置有微型棱镜取放缺口,以便于所述微型棱镜的取放,所述斜面卡槽与所述v型卡槽的深度均为2~4mm。
19.进一步地,所述基座包括高度调节孔、成像底座固定孔、微流控芯片固定孔、沥水槽、成像底座卡槽、基座固定孔、h型凹槽,所述成像底座卡槽用以放置并定向调节所述成像底座,所述高度调节孔用于调节所述成像底座高度,所述成像底座固定孔、微流控芯片固定孔分别用来固定成像底座及微流控芯片,所述基座下方设沥水槽用以排水,所述h型凹槽用以集成所述准直偏振光源与图像传感器,设置基座固定孔用以固定基座。
20.进一步地,所述哑光密闭外壳整体进行黑色哑光处理,包括上盖板、led控制器、围板、底座、提手及橡胶软垫,所述围板设置在所述底座上,所述上盖板通过插销结构连接围板以形成翻盖结构,led控制器与所述信号检测控制模块、微样流路控制模块及电场调制模块相连接,所述橡胶软垫设置在所述底座下方,所述提手设置在所述上盖板上表面。
21.根据本技术实施例的第二方面,提供一种基于spr的便携式微纳振荡成像检测方法,包括以下步骤:
22.spr成像光路搭建:开启电源,打开哑光密闭外壳,打开准直偏振光源,打开图像传感器,根据成像效果分别调整所述准直偏振光源功率及角度、图像传感器的感光度及曝光时间;将微型棱镜置于成像底座上,将成像底座卡入基座,调整至合适成像高度并拧紧螺丝固定,缓慢加入镜油,将微纳振子功能化成像芯片卡入微流控芯片的芯片卡槽,使用双组分胶粘剂封闭,缓慢置于微型棱镜上,拧紧螺丝固定;
23.电场调制连接:依次将电路板的电极通过微流控芯片上连接至成像芯片及样品,工作电极在电极缺口处连接成像芯片,对电极在电极孔处接触液体样本,用柔性材料包被电极封闭反应腔。测试调节电学参数;
24.控制模块搭建:使用管路将进样泵、切换阀及微流控芯片的进样口连接,出样孔连接废液瓶,开启温度控制器,关闭所述哑光密闭外壳;
25.信号采集检测:开启电场调制及图像采集,利用数据采集卡获得电路及成像的同步信号,使用图像处理软件对采集的数据进行分析。
26.进一步地,所述微纳振子阵列功能化成像芯片的制备过程包括以下步骤:
27.成像芯片制备及处理:选用18
×
18~22
×
22mm bk7玻片,分别置于无水丙酮、无水乙醇、超纯水溶液中超声处理15~30min,用以去除杂质;采用磁控溅射设备,物理气相沉积2~3nm cr 10~15s、46~49nm au 45~50s,使用氢火焰抛光金表面;使用氧等离子体按50~100w、3~15min参数进行处理;
28.单分子层长链自组装:将sh-功能化的生物柔性分子长链及sh-功能化的生物柔性分子间隔物分别使用超纯水或酒精稀释至1~5mm,按体积比1:200~1:1000混匀构建不同密度单分子层阵列用以连接不同直径尺寸微纳振子,注入反应腔区域,室温静置于湿润密闭暗盒中,充入氮气后孵育12~36h,以使得所述生物柔性分子长链和生物柔性分子间隔物组成单分子层阵列,其中所述生物柔性分子长链比生物柔性分子间隔物链长,所述生物柔性分子长链指相对于后续所连微纳振子有活性反应基团的生物柔性分子,用以生物特异性识别,所述间隔物指相对于后续所连微纳振子无活性反应基团的生物柔性分子,用以防止非特异性吸附;
29.微纳振子连接:将超纯水缓慢注入反应腔区域1~2min以清洗未组装的生物柔性分子,使用0.01
×
pbs溶液将微纳振子稀释至1~10μg/ml,超声处理2~10min用以分散聚集微纳振子,注入反应腔区域孵育0.5~3h,使用0.01
×
pbs溶液缓慢冲洗若干次,去除非特异性吸附干扰,每次缓慢抽吸2/3样本,反应腔区域中始终保持有液体以避免芯片干燥导致微纳振子黏结。
30.本技术的实施例提供的技术方案可以包括以下有益效果:
31.由上述实施例可知,本技术基于spr开发了便携式成像装置,集成spr光学成像、信号检测控制、微样流路控制、电场调制等功能,将分散的功能及组件通过一体化封装模块的结构设计集成为便携式一体化装置,有望在分子相互作用快速分析领域发挥作用;基于使用微透镜或无透镜的cmos作为图像传感器,可实现便携大视场成像;对检测环境及流路系统进行控制,提高了抗干扰能力及检测稳定性;基于spr对不同材质、尺寸及形状微纳振子进行振荡调控,实现放大信号提高了成像检测的灵敏度;一体化封装模块将各模块集成,减少环境温度变化、外界杂光、机械振动及气流扰动带来的干扰,增加系统稳定性并实现装置的小型化。
32.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
33.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本技术的实施例,并与说明书一起用于解释本技术的原理。
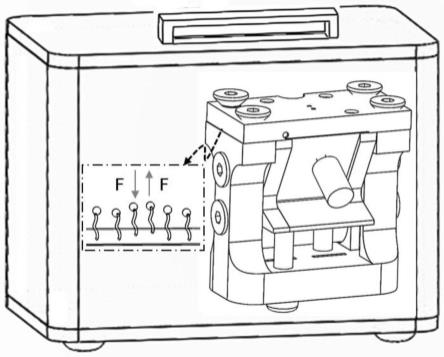
34.图1为便携式微纳振荡成像检测装置外观示意图。
35.图2为便携式微纳振荡成像检测装置工作原理示意图。
36.图3为便携式微纳振荡成像检测装置内部部分组装结构示意图。
37.图4为便携式微纳振荡成像检测装置内部部分组装图结构爆炸示意图。
38.图5为成像底座立体示意图的第一种视角。
39.图6为成像底座立体示意图的第二种视角。
40.图7为成像底座三视示意图。
41.图8为微流控芯片立体俯视示意图。
42.图9为微流控芯片立体仰视示意图。
43.图10为微流控芯片进出样孔剖面示意图
44.图11为微流控芯片平面俯视、仰视、正视示意图。
45.图12为基座立体示意图的第一种视角。
46.图13为基座立体示意图的第二种视角。
47.图14为基座三视示意图。
48.图15为基座部分组装图结构示意图。
49.图16为基座部分组装图结构爆炸示意图。
50.图17为一种基于spr的便携式微纳振荡成像检测装置组装示意图。
51.图18为便携式微纳振荡成像检测装置在不同光源波长下反射率仿真示意图。
52.图19为便携式微纳振荡成像检测装置检测相同频率条件下不同电压对微纳振子振荡变化的示意图。
53.图20为便携式微纳振荡成像检测装置检测相同电压条件下不同频率对微纳振子振荡变化的示意图。
54.附图标记:1、哑光密闭外壳;11、上盖板;12、led控制器;13、围板;14、底座;15、提手;16、橡胶软垫;2、微流控芯片;21、进样口;22、电极孔;23、电极缺口;24、反应腔;25、出样孔;26、固定孔;27、芯片卡槽;3、成像底座;31、斜面卡槽;32、微型棱镜取放缺口;33、空心排水槽;34、v型卡槽;35、底座卡槽;4、基座;41、高度调节孔;42、成像底座固定孔;43、微流控芯片固定孔;44、沥水槽;45、成像底座卡槽;46、基座固定孔;47、h型凹槽;5、准直偏振光源;6、微型棱镜;7、图像传感器;8、成像芯片;9、螺丝。
具体实施方式
55.这里将详细地对示例性实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下示例性实施例中所描述的实施方式并不代表与本技术相一致的所有实施方式。
56.在本技术使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本技术。在本技术和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。
57.应当理解,尽管在本技术可能采用术语第一、第二、第三等来描述各种信息,但这些信息不应限于这些术语。这些术语仅用来将同一类型的信息彼此区分开。例如,在不脱离本技术范围的情况下,第一信息也可以被称为第二信息,类似地,第二信息也可以被称为第一信息。取决于语境,如在此所使用的词语“如果”可以被解释成为“在
……
时”或“当
……
时”或“响应于确定”。
58.如图1-4所示,本技术提供的一种基于spr的便携式微纳振荡成像检测装置可以包括spr光学成像模块、信号检测控制模块、微样流路控制模块、电场调制模块、一体化封装模块;所述spr光学成像模块包括准直偏振光源5、微型棱镜6、成像芯片8、图像传感器7,所述准直偏振光源5以特定的spr角与所述微型棱镜6耦合,所述成像芯片8设置在所述微型棱镜6上方,所述图像传感器7以特定的spr角与所述微型棱镜6集成用以反射光采集,所述图像传感器7采用微型或无透镜的cmos图像传感器7;所述信号检测控制模块用于温度控制并获取所述图像传感器7和电场调制模块的时间戳;所述微样流路控制模块包括微流控芯片2,所述微流控芯片2设置在所述成像芯片8上方,用以微量样品的流路控制与切换、增加检测稳定性;所述电场调制模块与所述成像芯片8和微样流路控制模块电连接,用于给不同材质、形状及尺寸的微纳振子施加振荡动力,以进行信号放大以增强检测灵敏性;所述哑光密闭外壳1用于装置的封装,所述基座4设置在所述哑光密闭外壳1内的底部,所述成像底座3设置在所述基座4上,所述成像底座3中设置v型卡槽34,所述微型棱镜6设置在所述v型卡槽34中;其中所述微纳振子材质为带有电荷的粒子,所述微纳振子形状为球状、棒状或片状,所述微纳振子的直径尺寸范围为500nm~5μm。
59.由上述实施例可知,本技术基于spr开发了便携式成像装置,集成spr光学成像、信号检测控制、微样流路控制、电场调制等功能,将分散的功能及组件通过一体化封装模块的结构设计集成为便携式一体化装置,有望在分子相互作用快速分析领域发挥作用;基于使用透镜或无透镜的cmos作为图像传感器7,可实现便携大视场成像;对检测环境及流路系统进行控制,提高了抗干扰能力及稳定性;基于spr对微纳振子进行振荡调控,实现放大信号提高了成像检测的灵敏度。
60.在具体实施中,所述一体化封装模块包括哑光密闭外壳1、成像底座3、基座4,用于装置的小型化封装。所述哑光密闭外壳1提供一个封闭环境将各模块集成,可减少环境温度变化、外界杂光、机械振动及气流扰动带来的干扰,内部进行黑色哑光处理避免内部杂光干扰,底部设置橡胶软垫16用以减少机械振动影响。所述哑光密闭外壳1进行黑色哑光处理,减少内部杂光反射影响检测,同时提供一个密闭暗室避免外界影响。尺寸不大于100
×
150
×
100mm。外壳分为上盖板11、led控制器12、围板13、底座14、提手15及橡胶软垫16。所述围板13设置在所述底座14上,上盖板11通过插销结构连接围板13,翻盖设计方便操作。整个哑光密闭外壳1进行黑色哑光处理,减少杂光反射影响检测。哑光密闭外壳1同时创造一个密闭暗室,消除外界光线变化及气流扰动对检测的影响,同时配合温度控制器消除温度变化对检测的影响。哑光密闭外壳1正面设置led控制器12,用以连接温度控制器、进样泵、切换
阀及电路板,对检测温度、电压、频率、波形等电学参数及进出样进行控制。哑光密闭外壳1底部设置四个缓冲橡胶软垫16,减少外界震动对检测影响。上盖板11设置提手15方便手提携带。
61.具体地,所述成像底座3上设置v型卡槽34,所述v型卡槽34两端分别设置有竖直支架,所述竖直支架内侧均设置有斜面卡槽31,所述斜面卡槽31与所述v型卡槽34的深度均为2~4mm,所述支架上设置有微型棱镜取放缺口32,以便于所述微型棱镜6的取放。在具体实施中,如图5、6、7所示,所述成像底座3采用“v”字形设计,用以集成准直偏振光源5与图像传感器7实现小型化。成像底座3中间设v型卡槽34,用以增加光路面积。两边支架各设斜面卡槽31用以放置微型棱镜6,微型棱镜6上方滴加镜油以连接成像芯片8。斜面卡槽31及v型卡槽34深度为2~4mm,卡紧微型棱镜6的同时增加光路面积。支架上部设置微型棱镜取放缺口32用以微型棱镜6取放。底座14中设置空心排水槽33用以排水同时避免底部杂质堆积划伤微型棱镜6。
62.具体地,所述图像传感器7采用微型或无透镜的cmos图像传感器7,可以使用算法重构图像实现大视场成像,同时传感器的小尺寸可以实现更紧凑的集成。所述图像传感器像素尺寸2-7μm,采样频率≤100fps。
63.具体地,所述准直偏振光源5前设置偏振片调制为p偏振光,光源波长范围为400~800nm,增强spr成像效果。所述微型棱镜6采用kretschman微型棱镜耦合结构。准直偏振光源5相对于微型棱镜6的入射角度可以微调,以适应不同成像芯片8的成像条件。
64.具体地,所述spr光学成像模块采用小型化spr结构,不包含复杂光路,采用固定入射角模式简化成像模块,所述成像芯片8为微纳振子阵列功能化成像芯片,采用生物分子自组装模式构建微纳振子阵列,spr成像空间分辨率为5~10μm,时间分辨率为10ms。在一实施例中所述成像芯片8采用磁控溅射,在bk7玻片上物理气相沉积2~3nm cr(10~15s)、46~49nm au(45~50s)。所述微纳振子阵列功能化成像芯片的制备过程包括以下步骤:
65.成像芯片制备及处理:选用18
×
18~22
×
22mm bk7玻片,依次置于无水丙酮、无水乙醇、超纯水溶液中超声处理15~30min用以去除杂质;采用磁控溅射设备,物理气相沉积2~3nm cr 10~15s、46~49nm au 45~50s,使用氢火焰抛光金表面;使用氧等离子体按50~100w、3~15min参数进行处理;
66.单分子层阵列自组装:将sh-功能化的生物柔性分子长链及sh-功能化的生物柔性分子间隔物分别使用超纯水或酒精稀释至1~5mm,按体积比1:200~1:1000混匀构建不同密度单分子层阵列用以连接不同直径尺寸微纳振子,注入反应腔区域,室温静置于湿润密闭暗盒中,充入氮气后孵育12~36h,以使得所述生物柔性分子长链和生物柔性分子间隔物组成单分子层阵列,其中所述生物柔性分子长链比生物柔性分子间隔物链长,所述生物柔性分子长链指相对于后续所连微纳振子有活性反应基团的生物柔性分子,用以生物特异性识别,所述间隔物指相对于后续所连微纳振子无活性反应基团的生物柔性分子,用以防止非特异性吸附;在单分子层阵列组装中,利用长链和间隔物之间的体积比来控制长链在阵列中的密度,间隔预定距离的长链可以在下一步在中连接微纳阵子,从而将微纳阵子连接到阵列上,其中间隔的距离由阵子的大小而定;
67.微纳振子连接:将超纯水缓慢注入反应腔区域1~2min以清洗未组装的生物柔性分子,使用0.01
×
pbs溶液将微纳振子稀释至1~10μg/ml,超声处理2~10min用以分散聚集
的微纳振子,注入反应腔区域孵育0.5~3h,使用0.01
×
pbs溶液缓慢冲洗若干次,去除非特异性吸附干扰,每次缓慢抽吸2/3样本,反应腔区域中始终保持有液体以避免芯片干燥导致微纳振子黏结。
68.在一实施例中,所述成像芯片的制备方法包括以下步骤:
69.a.成像芯片8制备及处理:
70.选用22
×
22mm bk7玻片,依次置于无水丙酮、无水乙醇、超纯水溶液中超声30min。采用磁控溅射设备,物理气相沉积2nm cr(10s)、47nm au(47s)。然后使用氢火焰(75l/h)快速(10s)抛光金表面。使用氧等离子体按80w、5min参数进行处理。
71.b.单分子层阵列自组装:
72.将sh-peg-biotin(10kd)长链及sh-peg-oh(2kd)间隔物分别使用超纯水稀释至1mm,按体积比1:500混匀,注入反应腔区域,室温静置于湿润密闭暗盒中,通入氮气后孵育24h。
73.c.微纳振子连接:
74.将超纯水缓慢注入反应腔区域1min。使用0.01
×
pbs溶液将霉亲和素包被的微纳振子稀释至2μg/ml,注入反应腔区域孵育2h。然后使用0.01
×
pbs溶液缓慢冲洗3次,去除非特异性吸附干扰。每次缓慢抽吸2/3样本,反应腔区域中保持有液体以避免芯片干燥导致微纳振子黏结。
75.需要说明的是,上述过程为成像芯片制备方法的一个实施例,其中的参数均为示例,不表示在具体实施中只能采用上述参数。
76.具体地,所述信号检测控制模块包括温度控制器、数据采集卡,所述温度控制器包括温度传感器用于加热的电加热组件和用于降温的半导体制冷片,通过温度传感器实时检测温度,反馈给加热及降温组件实现温度控制,进而调节控制待测样品溶液的温度。减少内部器件工作产生的温度变化及外界环境温度变化对检测结果的影响,提高装置抗干扰能力。所述数据采集卡获取图像传感器7和振荡模块的时间戳,实现电路及成像的同步信号,用来进行相位校准,以便实现微纳振子振荡的幅值及相位的精准检测。
77.具体地,所述微样流路控制模块还包括进样泵、切换阀,所述微流控芯片2包括进样口21、电极孔22、电极缺口23、反应腔24、出样孔25、固定孔26、芯片卡槽27,所述芯片卡槽27用于所述成像芯片8的固定,所述进样口21设置3~5个,与所述进样泵和切换阀连接实现多个样品的运输及切换,设置反应腔24用于样品进行反应,所述电极孔22用以将参比电极及对电极连接样品,所述电极缺口23用以将工作电极连接成像芯片8。
78.在具体实施中,所述微流控芯片2包括进样口21、电极孔22、电极缺口23、反应腔24、出样孔25、固定孔26、芯片卡槽27。微流控芯片2使用透明材质,用以实时观察样品情况。微流控芯片2设有3~5个进样口21和1个出样孔25,可与进样泵和切换阀连用实现多个样品的运输及快速切换。进样口21高于出样孔1~2mm,防止样品倒流。设置反应腔24用于样品反应。设置电极孔22用以将参比电极及对电极连接样本,设置电极缺口23用以将工作电极连接成像芯片8。设置芯片卡槽27用于成像芯片8的固定,四个固定孔26与基座4上的微流控芯片固定孔43固定连接,用以防止成像芯片8滑移造成误差。
79.在一实施例中,结合图8、9、10、11所示,微流控芯片2包括进样口21、电极孔22、电极缺口23、反应腔24、出样孔25、固定孔26、芯片卡槽27。微流控芯片2使用透明pmma材质,方
便实时观察反应腔24中样品情况。使用双组分胶粘剂实现与成像芯片8的封装。微流控芯片2有三个进样口21和一个出样孔25,可结合进样泵和切换阀实现样品快速切换。进样口21底部高于出样孔25,防止样品倒流。设置芯片卡槽27用于成像芯片8的固定,四个固定孔26进一步与基座4固定。
80.具体地,所述基座4包括高度调节孔41、成像底座固定孔42、微流控芯片固定孔43、沥水槽44、成像底座卡槽45、基座固定孔46、h型凹槽47,所述成像底座卡槽45用以放置并定向调节成像底座3,所述高度调节孔41可以调节成像底座3高度,用以适应不同样品的光路要求,所述成像底座固定孔42、微流控芯片固定孔43分别用来固定成像底座3及微流控芯片2,所述基座4下方设沥水槽44用以排水,所述h型凹槽47用以集成所述准直偏振光源5与图像传感器7,设置基座固定孔46用以固定基座4。在具体实施中,所述基座4包括高度调节孔41、成像底座固定孔42、微流控芯片固定孔43、沥水槽44、成像底座卡槽45、基座固定孔46、h型凹槽47。所述成像底座卡槽45用以放置并定向调节成像底座3。1~2个高度调节孔41可以调节成像底座3高度,用以适应不同样品的光路要求。2~4个成像底座固定孔42、2~4个微流控芯片固定孔43分别用来固定成像底座3及微流控芯片2,用以增加系统抗干扰能力。基座4下方设沥水槽44用以排水。设置h型凹槽47,用以集成准直偏振光源5与图像传感器7实现小型化。设置基座固定孔46用以固定基座4。
81.结合图12、13、14所示,基座4包括高度调节孔41、成像底座固定孔42、微流控芯片固定孔43、沥水槽44、成像底座卡槽45、基座固定孔46及h型凹槽47。两个高度调节孔41用以调节成像底座3高度,四个成像底座固定孔42、四个微流控芯片固定孔43分别用来固定成像底座3及微流控芯片2。基座4中下方设计沥水槽44。设置h型凹槽47,增加光路面积,方便集成其他元件。
82.具体地,所述电场调制模块包括电路板、电源,所述电源为所述spr光学成像模块、信号检测控制模块、微样流路控制模块、电场调制模块、一体化封装模块供电,所述电路板用于通过微流控芯片2向样品输出正弦及其他波形交流电调制。所述电路板用以施加不同参数的交流电。所述电源用以给spr光学成像模块、信号检测控制模块、微样流路控制模块、电场调制模块供电。在具体实施中,所述电路板体积小,可使用双电极或三电极通过微流控芯片2向样品输出正弦及其他波形交流电调制。电极可选用铂、金等材料。工作电极在电极缺口23处连接成像芯片8,参比电极及对电极(如有)使用柔性材料包被的电极在电极孔22处连接样本并封闭孔洞。所述电源可提供整个装置用电,实现户外一体化便携检测。
83.结合图15、16所示,为基座4整体组装示意图及结构图。组装完毕后各组件灵活拆卸,具有一定的可调节性和结构稳定性,可以提高整个装置的检测性能。
84.上述基于spr的便携式微纳振荡成像检测装置的工作原理如下:
85.所述准直偏振光源5前设置偏振片将光源调制为p偏振光,在特定spr角度下成像芯片8本身的电子与p偏振入射光相互作用耦合产生振动,从而在界面产生可传播的spr信号。检测样本中细微的折射率变化会产生很明显spr信号,成像芯片8反射光中的spr信号可以被图像传感器7采集。所述图像传感器7采用微型或无透镜的cmos图像传感器7,使用算法重构图像实现大视场成像,同时传感器的小尺寸可以实现更紧凑的集成。在原有spr信号的基础上,在成像芯片8上进行微纳振子阵列功能化,通过施加不同电场调控微纳振子运动形态来实现信号放大。数据采集卡用来获取图像传感器7和振荡模块的时间戳,实现电路及成
像的同步信号,用来进行相位校准,以便实现微纳振子振荡的幅值及相位的精准检测。
86.如图17所示,便携式微纳振荡成像检测装置集成在哑光密闭外壳1内。外壳分为上盖板11、led控制器12、围板13底座14、提手15及橡胶软垫16。上盖板11通过插销结构连接围板13,翻盖设计方便操作。整个哑光密闭外壳1进行黑色哑光处理,减少杂光反射影响检测。哑光密闭外壳1同时创造一个密闭暗室,消除外界光线变化对检测的影响。哑光密闭外壳1正面设置led控制器12,用以连接温度控制器、进样泵、切换阀及电路板,对检测温度、电压、频率、波形等电学参数及进出样进行控制。哑光密闭外壳1底部设置四个缓冲橡胶软垫16,减少外界震动对检测影响。上盖板11设置提手15方便手提携带。
87.微流控芯片2包括进样口21、电极孔22、电极缺口23、反应腔24、出样孔25、固定孔26、芯片卡槽27。微流控芯片2使用透明pmma材质,方便实时观察反应腔24中样品情况。使用双组分胶粘剂实现与成像芯片8的封装。微流控芯片2有三个进样口21和一个出样孔25,可结合进样泵和切换阀实现样品快速切换。进样口21底部高于出样孔25,防止样品倒流。设置芯片卡槽27用于成像芯片8的固定,四个固定孔26进一步与基座4固定。
88.成像底座3采用v字形设计,两边支架各设斜面卡槽31,中间设置v型卡槽34,稳定固定微型棱镜6,并且尽可能增大光路通过面积。支架上部设置微型棱镜取放缺口32,方便微型棱镜6取放。底座14下方空心排水槽33,防止杂质堆积划伤微型棱镜6。设置底座卡槽35方便底座14定向调节高度。
89.基座4包括高度调节孔41、成像底座固定孔42、微流控芯片固定孔43、沥水槽44、成像底座卡槽35、基座固定孔46及h型凹槽47。两个高度调节孔41用以调节成像底座3高度,四个成像底座固定孔42、四个微流控芯片固定孔43分别用来固定成像底座3及微流控芯片2。基座4中下方设计沥水槽44。设置h型凹槽47,增加光路面积,方便集成其他元件。
90.本技术还提供一种基于spr的便携式微纳振荡成像检测方法,该方法可以包括以下步骤:
91.a.spr成像光路搭建:开启电源,打开上盖板11,打开准直偏振光源5,打开图像传感器7,根据成像效果分别调整所述准直偏振光源5发功率及角度、所述图像传感器7的感光度、曝光时间,将微型棱镜6置于成像底座3上,缓慢加入镜油,将微纳振子阵列功能化好的成像芯片8与微流控芯片2中芯片卡槽27通过双组分胶粘剂黏结,缓慢置于微型棱镜6上;
92.b.电场调制连接:依次将电路板的电极通过微流控芯片2连接至成像芯片8及样品,工作电极在电极缺口23处连接成像芯片8,对电极及参比电极(如有)在电极孔22处接触液体样本,用柔性材料包被电极封闭孔洞。调节电学参数,将成像底座3卡入基座4,调整至合适成像高度,调整高度调节孔41至合适成像高度,拧紧成像底座固定孔42及微流控芯片固定孔43;
93.c.控制模块搭建:使用管路将进样泵、切换阀及微流控芯片2的进样口21连接,出样孔连接废液瓶,开启温度控制器,关闭上盖板11;
94.d.信号采集检测:开启电场调制及图像采集,利用数据采集卡获得电路及成像的同步信号,使用图像处理软件对采集的数据进行分析。
95.结合图18所示,对不同准直偏振光源波长的成像检测装置成像效果进行了仿真。如图可知,在400~800nm波长范围内,随着波长增加,反射率随角度变化的斜率越大,即成像越灵敏。然而波长越长分辨率越低,因此需要根据具体需求选择合适波长。
96.结合图19所示,成像芯片功能化:将sh-peg-biotin(10kd)及sh-pfg-oh(2kd)以1:500比例使用超纯水稀释至1mm,连接5μg/ml 5μm链霉亲和素包被的聚苯乙烯微球。在1hz频率下,分别施加0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9vpp电压正弦交流电场。使用cmos图像传感器7记录微纳振子振荡的灰度值实时变化,可以看出微纳振子灰度值以1hz频率呈现周期性变化,并且随电压变大微纳振子灰度值变化越大。
97.结合图20所示,成像芯片功能化:将sh-peg-biotin(10kd)及sh-pfg-oh(2kd)以1:1000比例使用超纯水稀释至1mm,连接5μg/ml 2μm链霉亲和素包被的二氧化硅微球。在0.5vpp电压下,分别施加0、2、4、6、7、9、11hz频率正弦交流电场。使用cmos图像传感器7记录微纳振子振荡的灰度值变化,对采集到的信号进行傅里叶变换(fft),可以看出不同频率调制微纳振子有不同的fft最大幅值响应及位置。
98.本领域技术人员在考虑说明书及实践这里公开的内容后,将容易想到本技术的其它实施方案。本技术旨在涵盖本技术的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本技术的一般性原理并包括本技术未公开的本技术领域中的公知常识或惯用技术手段。
99.应当理解的是,本技术并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1