一种胶体金标记方法及其应用与流程
本发明属于医药生物,具体是一种胶体金标记方法及其应用。
背景技术:
1、胶体金即胶体纳米金,因纳米金颗粒在水溶液中呈胶体状,又被称为胶体金。胶体金免疫标记技术是以胶体金作为示踪标记物应用于抗原抗体反应检测,目前在免疫层析分析中应用非常广泛。胶体金免疫标记的实质是蛋白质等高分子物质被吸附到胶体金颗粒表面的包被过程,胶体金与蛋白质主要依靠三种作用力结合:静电作用力、疏水作用力和金硫键。影响胶体金对待标记蛋白的吸附的主要因素是ph值,不同的标记ph会影响标记效率和结合物的稳定性。当胶体金的ph值接近待标记蛋白的等电点(pi)或略偏碱性的条件时,胶体金和待标记蛋白容易形成牢固的结合物;当胶体金的ph值低于待标记蛋白的等电点时,胶体金和待标记蛋白会发生聚集,导致死金;当胶体金的ph值远大于待标记蛋白的等电点时,胶体金和待标记蛋白的结合能力变弱,胶体金和待标记蛋白均呈游离状态,难以形成金标复合物。另外,胶体金颗粒粒径的均一性对结合物稳定性也起重要作用,在标记蛋白的时,不同粒径的胶体金溶液调整至相同的ph条件下,由于各胶体金颗粒的粒径差异太大,会出现以下情况:一部分胶体金在标记蛋白后可以很稳定;一部分胶体金在标记蛋白后,蛋白构象因为胶体金粒径的影响而产生翻转等变化,使得胶体金颗粒与待标记蛋白相互吸附聚集,导致标记蛋白的胶体金溶液状态很不稳定,标记蛋白的胶体金溶液会快速逐步变色变暗甚至产生沉淀,最终导致胶体金标记失败。因此,在特定的ph值条件下使用粒径相对均一的胶体金进行蛋白质的标记成为了胶体金免疫标记技术的关键,现有技术也公开了一些如何减少由胶体金粒径大小、ph等因素对胶体金标记产生的不利影响技术,如:
2、专利申请cn 111896732 a公开了一种胶体金标记方法,包括以下步骤:制备待用胶体金溶液并调节ph值满足:pi+0.4<ph<pi+0.6,获得标准胶体金溶液;向标准胶体金溶液中添加表面活性剂;后添加待标记蛋白或待标记抗体的溶液;再添加封闭剂,得到包含有待标记蛋白或待标记抗体的胶体金溶液;将包含有所述待标记蛋白或待标记抗体的胶体金溶液离心,弃去上清液,取沉淀物;将沉淀物经胶体金复溶液复溶后得到金标复合物溶液;筛选金标复合物溶液的最佳稀释倍数;将所述金标复合物溶液按照最佳稀释倍数进行稀释,得到金标复合物稀释液,采用所述金标复合物稀释液制备金垫;本发明所提供的方法减少了由胶体金粒径大小、ph等因素而对胶体金标记效率产生的不利影响。
3、专利申请cn 103048457 a公开了一种用于酶联免疫反应的胶体金标记稳定液,其特征在于:在胶体金标记蛋白溶液中还加入有0.24mg/ml的peg20000,1.5%(w/w)牛血清白蛋白,3%(w/w)的蔗糖,0.5%(w/w)的海藻糖,1%(w/w)的酪蛋白和2%(w/w)的十二烷基磺酸钠sds。本发明提供了专门适合于脂蛋白相关磷脂酶a2与胶体金偶联的稳定液配方,使两者结合更快,更紧密稳定共价键。
4、虽然现有技术公开了一些提高胶体金标记蛋白溶液稳定性及标记效率的方法,然而,目前的方法依然存在标记成功率低、容易导致死金、标记后溶液不稳定、待标记蛋白用量高等问题,急需开发一种成本低、标记效率高、标记溶液稳定性好的胶体金标记方法。
技术实现思路
1、针对现有技术的不足,本发明的目的在于提供一种胶体金标记方法及其应用,通过该方法进行胶体金标记,能有效提高标记的灵敏度和稳定性。
2、本发明的目的通过以下技术方案来实现:
3、第一方面,本发明提供了一种胶体金标记方法,所述方法包括:将待标记蛋白与大分子物质混合得到混合物,再将所述混合物加入胶体金溶液中以制备胶体金标记的蛋白。所述胶体金溶液的ph值为胶体金标记所述待标记蛋白的最佳ph值。
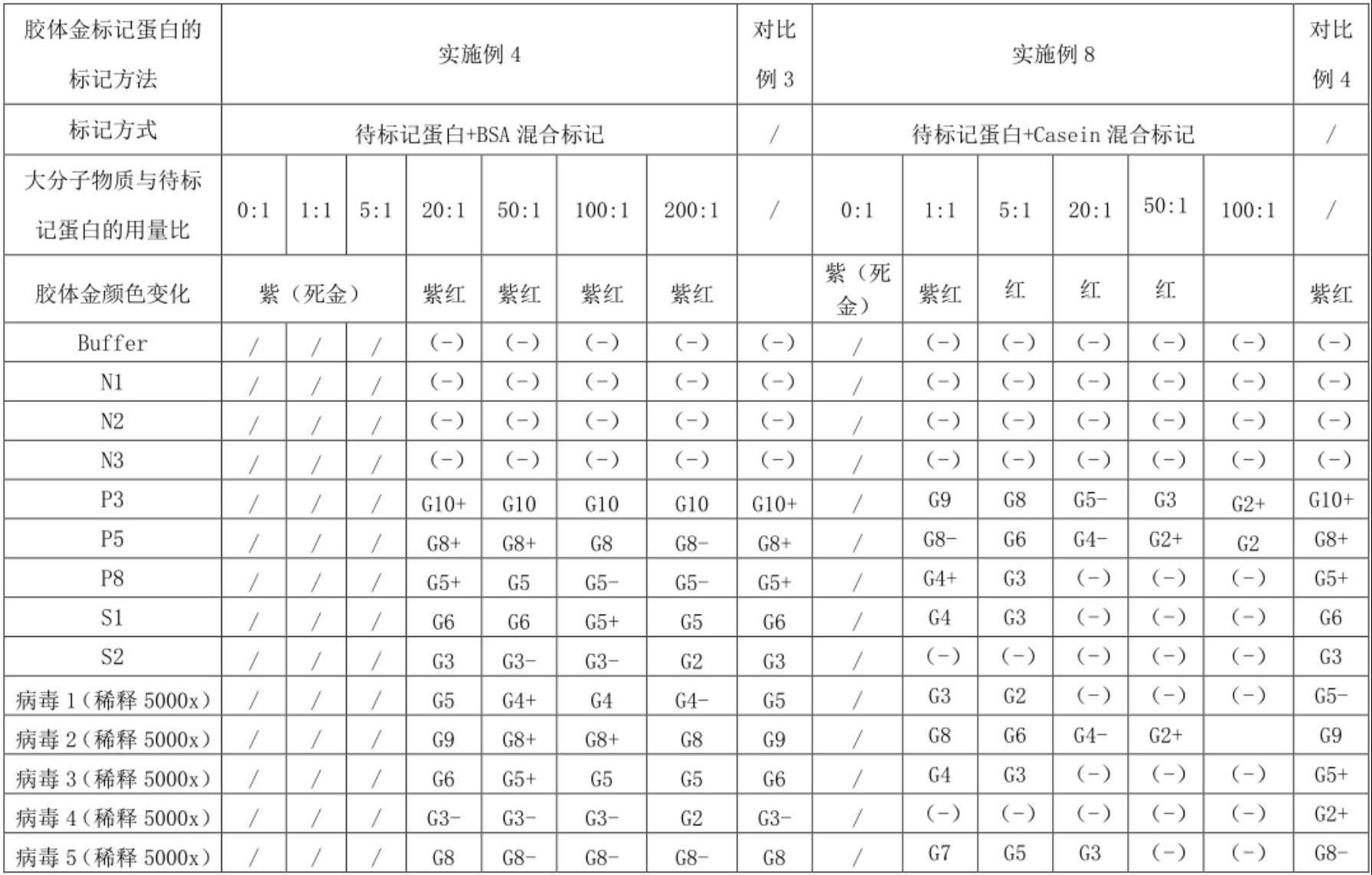
4、在本发明的一些实施例中,所述大分子物质选自bsa(牛血清白蛋白)、casein(酪蛋白)中一种或两种。优选地,所述大分子物质选自bsa。
5、在本发明的一些实施例中,大分子物质选自bsa,bsa与待标记蛋白的质量比为0.1~200:1(具体包括0.1:1、1:1、10:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1、110:1、120:1、130:1、140:1、150:1、160:1、170:1、180:1、190:1、200:1),优选为10~100:1,更优选为20~50:1。
6、在本发明的一些实施例中,大分子物质选自casein,casein与待标记蛋白的质量比为0.1~100:1(具体包括0.1:1、1:1、10:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1),优选为1~50:1,更优选为1~20:1。
7、在本发明的一些实施例中,胶体金标记待标记蛋白的最佳ph值等于该待标记蛋白的等电点pi或大于该待标记蛋白的等电点pi,优选地,pi≤ph≤pi+0.8。
8、在本发明的一些实施例中,所述胶体金标记方法包括如下步骤:
9、(1)选取粒径大小均一的纳米金颗粒配制胶体金溶液,调节胶体金溶液的ph值至胶体金标记待标记蛋白的最佳ph值。
10、(2)将待标记蛋白与大分子物质混合得到大分子物质与待标记蛋白的混合物。
11、(3)将步骤(2)得到的大分子物质与待标记蛋白的混合物加入到步骤(1)的胶体金溶液中,进行标记反应。
12、(4)反应完成后往步骤(3)的反应液中加入封闭剂,进行封闭反应。
13、(5)对步骤(4)封闭反应得到的溶液进行离心后去除上清液,收集到的沉淀物经胶体金复溶液复溶后即得到胶体金标记的蛋白。
14、在本发明的一些实施例中,所述步骤(1)中纳米金颗粒的平均粒径为30nm~50nm,配制得到的胶体金溶液中纳米金颗粒的粒径分布变异系数c.v值≤20%,优选≤10%,更优选≤5%。
15、在本发明的一些实施例中,所述步骤(1)中使用碳酸钾调节胶体金溶液的ph值为胶体金标记待标记蛋白的最佳ph值。优选地,碳酸钾的浓度为0.1m~0.3m。
16、在本发明的一些实施例中,所述步骤(1)包括先测定待标记蛋白在标记浓度下的等电点pi,然后调节胶体金溶液的ph值处于pi≤ph≤pi+0.8的范围内。
17、在本发明的一些实施例中,所述步骤(3)中大分子物质与待标记蛋白的混合物的加入量为使得待标记蛋白的标记浓度为1μg/ml~20μg/ml。
18、在本发明的一些实施例中,所述步骤(3)中标记反应的时间为10min~30min。
19、在本发明的一些实施例中,所述步骤(4)中封闭剂选自bsa、peg20000、casein、酪蛋白钠盐、脱脂奶粉、胎牛血清、明胶或蛋白胨中的一种或两种以上;优选选自bsa、peg20000、casein中的一种或两种以上。
20、在本发明的一些实施例中,所述步骤(4)中封闭剂的加入量为每1ml反应液加入1mg~50mg封闭剂。
21、在本发明的一些实施例中,所述步骤(4)中封闭反应的时间为15min~45min。
22、在本发明的一些实施例中,所述步骤(5)中离心的条件包括:离心转速为5000rpm~12000rpm,离心时间为10min~40min。
23、在本发明的一些实施例中,所述步骤(5)中胶体金复溶液的加入量为沉淀物体积的10倍~50倍。
24、第二方面,本发明提供了一种由第一方面所述的胶体金标记方法标记得到的胶体金标记蛋白。
25、第三方面,本发明提供了一种如第一方面所述的胶体金标记方法和/或第二方面所述的胶体金标记蛋白在制备胶体金免疫层析试剂盒中的应用。
26、本发明采用将大分子物质与待标记蛋白的混合物与胶体金溶液混合的标记方法,将胶体金颗粒标记在待标记蛋白上。本发明人认为标记的原理可能是:在标记过程中,大分子物质与待标记蛋白被竞争性的结合到胶体金颗粒表面上,而由于标记溶液的ph值是使待标记蛋白结合到胶体金颗粒上的最佳ph值,故待标记蛋白与胶体金颗粒的结合整体占优势地位,即,待标记蛋白能占据胶体金颗粒上结合能力较强的结合位点,而大分子物质只能竞争性的结合到结合能力相对较弱的位点,从而保证待标记蛋白与胶体金整体结合能力占主导且胶体金结合能力弱的位点被大分子物质占据,提高了整个标记过程胶体金-待标记蛋白复合物的稳定性。此外,由于不同的蛋白的特性存在差异,在相应的ph值条件下,不同的待标记蛋白与胶体金颗粒结合能力不同,在标记过程中,待标记蛋白的标记浓度也不同。若待标记蛋白与胶体金的结合能力越强,所需要的待标记蛋白的量越少,待标记蛋白的标记浓度可达到1μg/ml,甚至更低,使用较少量的待标记蛋白能成倍地降低试剂盒的开发及生产成本。然而在现有技术中,当待标记蛋白的用量减少时会出现多个胶体金颗粒竞争一个待标记蛋白从而导致出现聚集、死金的现象。在本发明中,通过将大分子物质与待标记蛋白的混合物与胶体金溶液进行混合,由于大分子物质的存在,多余的胶体金颗粒会优先与大分子物质结合而不是去跟其他胶体金颗粒竞争同一待标记蛋白,从而能有效克服因待标记蛋白用量少而导致的不可逆的胶体金聚集、死金问题。另外,在一定浓度范围内,待标记蛋白量越少,每个胶体金颗粒与待标记蛋白的碰撞概率变小,与待标记蛋白量高的情况相比,一个胶体金上结合的待标记蛋白个数少,灵敏度相应会提高,在本发明提出的胶体金标记方法中,当大分子物质是bsa时,待标记蛋白的标记浓度可以低至1μg/ml,不仅节约了标记成本而且能保证在标记浓度较低的条件下仍然获得良好的标记效果,由该胶体金标记蛋白制备得到的试剂盒具有较高的灵敏度。
27、本发明的有益效果如下:
28、本发明提供了一种胶体金标记方法,该方法提出了将待标记蛋白与大分子物质先以一定的比例混合后再加入到已经调节至胶体金标记该待标记蛋白的最佳ph值的胶体金溶液中进行胶体金标记,通过该方法进行胶体金标记,能有效提高标记的灵敏度和稳定性。
- 还没有人留言评论。精彩留言会获得点赞!