利用纳米孔芯片上的隧穿增强光学光谱直接测序生物分子及其修饰
本公开涉及分子检测领域,特别是一种纳米孔光学电子装置和一种用于对生物分子及其修饰进行测序的方法。
背景技术:
1、rna组(rnome)中有140多种已知的修饰核糖核苷酸,它们影响核糖核酸(rna)的结构和功能。例如,修饰与剪接在一起能改变rna的拓扑结构和化学性质,这控制着核酸如何调节细胞和生物体的功能。修饰中的缺陷可能导致多器官衰竭、癌症和神经系统疾病。此外,rna基因组修饰的准确知识对于rna病毒爆发的早期识别和控制,以及包括mrna疫苗在内的基于rna的治疗方法的开发也非常有价值,因为来自互补脱氧核糖核酸(cdna)的序列信息只能提供粗略的指导。
2、然而,这些修饰是如何分布在rna转录物中仍然未知。下一代脱氧核糖核酸(dna)测序技术通过将rna反转录为cdna来确定rna序列,这会导致rna修饰的位置和一致性(identity)的丢失。尽管蛋白质纳米孔测序仪在长读长(long read length)的快速单分子dna测序中非常成功,并且有可能直接对rna进行测序,但它缺乏单核苷酸分辨率,这使得识别修饰的核糖核苷酸极具挑战性,甚至是不可能的。
3、bcpi-240210第2/36页
4、此外,蛋白质和肽由20个氨基酸组成,并且可能具有甚至更多的修饰。传统的纳米孔技术不具备仅基于离子电流读数解码这些变化的能力,并且本领域中对蛋白质/肽进行测序的方法具有非常有限的带宽和/或特异性。
5、因此,迫切需要一种有效的技术来在单分子和/或全转录组范围(transcriptome-wide scale)内确定全长生物分子中所有修饰的一致性和位置。
技术实现思路
1、本公开涉及一种纳米孔光学电子装置和一种用于对生物分子及其修饰进行测序的方法。
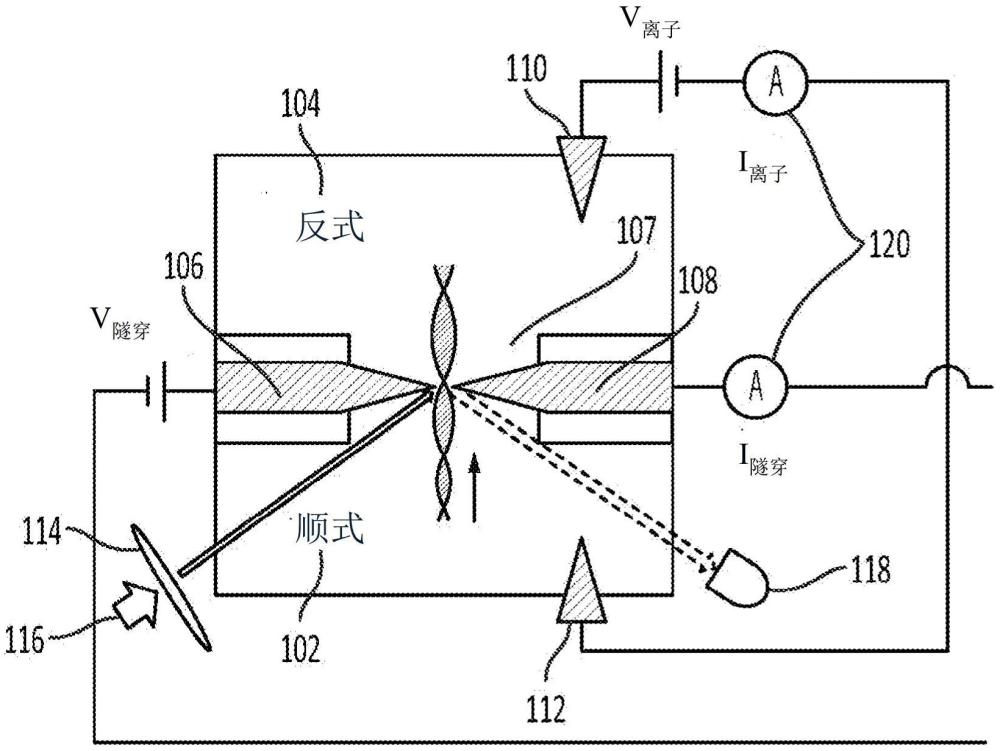
2、根据本公开的实施例的第一方面,提供了一种用于对生物分子进行测序的纳米孔光学电子装置。所述纳米孔光学电子装置包含:
3、在平面基底中的顺式流体腔室和反式流体腔室;
4、纳米流体通道,其连接所述顺式流体腔室和所述反式流体腔室;
5、在所述纳米流体通道中的第一电极和第二电极,所述第一电极及所述第二电极在所述第一电极与所述第二电极之间形成纳米间隙;
6、分别在所述顺式流体腔室和所述反式流体腔室中的第三电极和第四电极;
7、光学耦合元件,其被配置为将电磁束与所述纳米间隙耦合;
8、光学检测器,其被配置为当生物分子易位(translocate)通过所述纳米间隙时检测来自所述纳米间隙的光学信号;以及
9、电流测量电路,其被配置为测量所述第一电极和所述第二电极之间的隧穿电流以及所述第三电极和所述第四电极之间的离子电流。
10、在一些实施例中,所述平面基底可以是透明基底,诸如玻璃或石英。
11、在一些实施例中,所述平面基底可以是非透明基底,诸如涂布有氧化物层的硅。
12、在一些实施例中,所述第一电极、所述第二电极、所述第三电极及所述第四电极可由金、钯、铂、银或其组合形成。
13、在一些实施例中,所述第一电极和所述第二电极可在所述bcpi-240210第3/36页纳米流体通道内并在反馈控制下被电化学沉积一种或多种金属材料,借此形成具有所述生物分子从所述顺式流体腔室易位到所述反式流体腔室的单一路径的所述纳米间隙,其中所述第一电极和所述第二电极之间的距离在1nm与100nm之间,所述纳米间隙与所述第一电极和所述第二电极自对准并且在所述顺式流体腔室和所述反式流体腔室之间的路径中具有最窄的瓶颈。
14、在一些实施例中,所述第一电极和所述第二电极在所述纳米流体通道内并在反馈控制下被电化学沉积一种或多种金属材料,可包括脉冲宽度为50ms或更小且脉冲之间的静止期为约2秒的脉冲电化学沉积。
15、在一些实施例中,所述脉冲宽度可在2ms至5ms的范围内;在一些实施例中,所述脉冲宽度可小于2ms但大于1μs。
16、在一些实施例中,所述第一电极与所述第二电极之间的距离可在1nm至10nm的范围内。
17、在一些实施例中,所述第一电极和所述第二电极与所述纳米流体通道正交,并与所述平面基底上的纳米间隙形成自对准的横向隧穿结。
18、在一些实施例中,所述一种或多种金属材料可包括但不限于银(ag)、镍(ni)、钴(co)、ni合金、co合金、金、钯、铂、铱、或其合金或其组合。
19、在一些实施例中,所述电磁束可以是激光束。
20、在一些实施例中,所述激光束可以是紫外激光束;在一些实施例中,所述激光束可以是可见激光束;在一些实施例中;所述激光束可以是红外激光束。
21、在一些实施例中,所述光学耦合元件可包括透镜组件、光纤光学耦合元件、波导元件或其组合。
22、在一些实施例中,所述光学耦合元件可包括透镜组件。
23、在一些实施例中,所述光学耦合元件可包括光纤光学耦合元件,诸如光纤-内-光纤-外(fiber-in-fiber-out)耦合元件。
24、在一些实施例中,所述光学耦合元件可包括波导元件。
25、在一些实施例中,所述光学耦合元件可进一步包括偏振器。
26、在一些实施例中,所述光学信号选自由荧光或磷光信号、尖端增强拉曼信号、表面增强拉曼信号及其组合所构成的群组。
27、在一些实施例中,所述光学信号是荧光或磷光信号。
28、在一些实施例中,所述光学信号是尖端增强拉曼信号。
29、在一些实施例中,所述光学信号是表面增强拉曼信号。
30、在一些实施例中,所述第一电极和所述第二电极可包括氧化物层,诸如金属氧化物层。
31、在一些实施例中,所述第一电极和所述第二电极可包括表面修饰层,所述表面修饰层包括但不限于聚乙二醇硫醇(peg-硫醇)、烷基硫醇、半胱氨酸、4(5)-(2-巯基乙基)-1h-咪唑-2-甲酰胺或其组合。
32、在一些实施例中,所述第一电极和所述第二电极可包括阅读器(reader)分子,诸如半胱氨酸、4(5)-(2-巯基乙基)-1h-咪唑-2-甲酰胺。
33、在一些实施例中,所述生物分子可包括但不限于rna、dna、蛋白质、肽。
34、在一些实施例中,所述生物分子可以是rna。
35、在一些实施例中,所述生物分子可以是dna。
36、在一些实施例中,所述生物分子可以是肽或蛋白质。
37、在一些实施例中,所述隧穿电流、所述离子电流和所述光学信号在时间上重合并且在空间上共定位,并且源自于易位所述纳米间隙的同一生物分子。
38、根据本公开的实施例的第二方面,提供了一种用于对生物分子进行测序的方法,该方法包含:
39、提供纳米孔光学电子装置,该纳米孔光学电子装置包括:
40、在平面基底中的顺式流体腔室和反式流体腔室,
41、纳米流体通道,其连接所述顺式流体腔室和所述反式流体腔室,
42、在所述纳米流体通道中的第一电极和第二电极,所述第一电极和所述第二电极在所述第一电极与所述第二电极之间形成纳米间隙,
43、分别在所述顺式流体腔室和所述反式流体腔室中的第三电极和第四电极,
44、光学耦合元件,其被配置为将电磁束与所述纳米间隙耦合,光学检测器,其被配置为当生物分子易位通过所述纳米间隙时检测来自所述纳米间隙的光学信号,以及
45、电流测量电路,其被配置为测量所述第一电极和所述第二电极之间的隧穿电流以及所述第三电极和所述第四电极之间的离子电流;
46、在所述顺式流体腔室中提供包括生物分子的样本溶液;
47、提供在所述第三电极和所述第四电极之间横跨所述纳米流体通道的第一偏压;
48、提供横跨所述第一电极和所述第二电极、横跨所述纳米间隙的第二偏压;
49、同时测量:
50、在所述第一电极与所述第二电极之间的隧穿电流,
51、当所述生物分子易位通过所述纳米孔时,在所述第三电极与所述第四电极之间的离子电流,及
52、当所述生物分子易位通过所述纳米孔时,来自所述纳米间隙的光学信号;以及
53、使所述隧穿电流、所述离子电流和所述光学信号相关,以确定所述生物分子的序列。
54、在一些实施例中,所述平面基底可以是透明基底,诸如玻璃或石英。
55、在一些实施例中,所述平面基底可以是非透明基底,诸如涂布有氧化物层的硅。
56、在一些实施例中,所述第一电极、所述第二电极、所述第三电极及所述第四电极可由金、钯、铂、银或其组合形成。
57、在一些实施例中,所述第一电极和所述第二电极可在所述纳米流体通道内并在反馈控制下被电化学沉积一种或多种金属材料,借此形成具有所述生物分子从所述顺式流体腔室易位到所述反式流体腔室的单一路径的所述纳米间隙,其中所述第一电极和所述第二电bcpi-240210第6/36页极之间的距离在1nm与100nm之间,且所述纳米间隙与所述第一电极和所述第二电极自对准并且在所述顺式流体腔室和所述反式流体腔室之间的路径中具有最窄的瓶颈。
58、在一些实施例中,所述第一电极和所述第二电极在所述纳米流体通道内并在反馈控制下被电化学沉积一种或多种金属材料,可包括脉冲宽度为50ms或更小且脉冲之间的静止期为约2秒的脉冲电化学沉积。
59、在一些实施例中,所述脉冲宽度可在2ms至5ms的范围内;在一些实施例中,所述脉冲宽度可小于2ms但大于1μs。
60、在一些实施例中,所述第一电极与所述第二电极之间的距离可在1nm与10nm的范围内。
61、在一些实施例中,所述一种或多种金属材料可包括但不限于银(ag)、镍(ni)、钴(co)、ni合金、co合金、金、钯、铂、铱、或其合金或其组合。
62、在一些实施例中,所述第一电极和所述第二电极与所述纳米流体通道正交,并与所述平面基底上的纳米间隙形成自对准的横向隧穿结。
63、在一些实施例中,所述电磁束可以是激光束。
64、在一些实施例中,所述激光束可以是紫外激光束;在一些实施例中,所述激光束可以是可见激光束;在一些实施例中;所述激光束可以是红外激光束。
65、在一些实施例中,所述光学耦合元件可包括透镜组件、光纤光学耦合元件、波导元件或其组合。
66、在一些实施例中,所述光学耦合元件可包括透镜组件。
67、在一些实施例中,所述光学耦合元件可包括光纤光学耦合元件,诸如光纤-内-光纤-外耦合元件。
68、在一些实施例中,所述光学耦合元件可包括波导元件。
69、在一些实施例中,所述光学耦合元件可进一步包括偏振器。
70、在一些实施例中,所述光学信号选自由荧光或磷光信号、尖端增强拉曼信号、表面增强拉曼信号及其组合所构成的群组。bcpi-240210第7/36页
71、在一些实施例中,所述光学信号是荧光或磷光信号。
72、在一些实施例中,所述光学信号是尖端增强拉曼信号。
73、在一些实施例中,所述光学信号是表面增强拉曼信号。
74、在一些实施例中,所述第一电极和所述第二电极可包括氧化物层,诸如金属氧化物层。
75、在一些实施例中,所述第一电极和所述第二电极可包括表面修饰层,所述表面修饰层包括但不限于聚乙二醇硫醇(peg-硫醇)、烷基硫醇、半胱氨酸、4(5)-(2-巯基乙基)-1h-咪唑-2-甲酰胺或其组合。
76、在一些实施例中,所述第一电极和所述第二电极可包括阅读器分子,诸如半胱氨酸、4(5)-(2-巯基乙基)-1h-咪唑-2-甲酰胺。
77、在一些实施例中,所述生物分子可包括但不限于rna、dna、蛋白质、肽。
78、在一些实施例中,所述生物分子可以是rna。
79、在一些实施例中,所述生物分子可以是dna。
80、在一些实施例中,所述生物分子可以是肽或蛋白质。
81、在一些实施例中,所述第一偏压可在-5mv至-1500mv的范围内。
82、在一些实施例中,所述第二偏压可在-1000mv至1000mv的范围内。
83、在一些实施例中,所述隧穿电流、所述离子电流和所述光学信号源自于当所述生物分子易位所述纳米间隙时的重合(coincidental)及共定位(colocalized)的易位事件。
84、在一些实施例中,所述方法进一步包括在提供所述第一偏压之前,提供在所述第三电极和所述第四电极之间横跨所述纳米流体通道的第三偏压历时第一时间段。
85、在一些实施例中,所述方法可进一步包括相对于所述纳米间隙的横向方向调整所述电磁束的偏振方向。
86、在一些实施例中,所述方法可进一步包括调整所述样本溶液的离子强度。
87、在一些实施例中,所述方法进一步包含在所述样本溶液中添加易位速度调节物,其中所述易位速度调节物可以是二氧化硅纳米bcpi-240210第8/36页
88、粒子。
89、在一些实施例中,所述方法进一步包含调整所述第一电极与所述第二电极之间的距离。
90、在一些实施例中,所述方法进一步包含调整所述第一电极和所述第二电极的锐度。
91、在一些实施例中,使所述重合及共定位的隧穿电流、所述离子电流和所述光学信号相关以确定所述生物分子的序列,包含通过利用机器学习算法来分析所述重合及共定位的隧穿电流,所述离子电流和所述光学信号以确定所述生物分子的序列,其中所述机器学习算法可以是支持向量机。
92、因此,本文公开的纳米孔光学混合电子装置和用于对生物分子及其修饰进行测序的方法,将自对准横向隧穿结与平面基底上的纳米孔集成,这有助于当生物分子易位纳米孔时记录生物分子的光学特征。横向隧穿结进一步为生物分子易位通过纳米孔提供了强大且高度局部化的光学增强。组合的重合及共定位的隧穿电流、离子电流和增强的光学信号提供了多维信号空间,用于准确识别不同的rna修饰、肽序列/修饰和其他生物分子。通过分析重合及共定位的隧穿电流、离子电流和增强的光学信号(诸如拉曼光谱)的相关性,可以以高产率和高准确度对rna和/或dna的碱基和碱基修饰以及肽/蛋白质的氨基酸和氨基酸修饰进行测序,从而实现直接生物分子测序。
93、其他方面将部分地在随后的描述中阐述,并且部分地将从描述中变得显而易见,或者可以通过实践所呈现的实施例来了解。
- 还没有人留言评论。精彩留言会获得点赞!